
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект практических занятий физическая химия
- •Применение первого начала термодинамики к процессам в идеальных газах
- •Расчет теплоемкости Вычисление средней теплоемкости
- •Расчет теплоемкости по Нейману и Коппу
- •Расчет теплоемкости твердого вещества по Эйнштейну-Дебаю
- •Расчет теплоемкости газа по квантово-статистической теории
- •Расчет количества теплоты для нагревания/охлаждения вещества
- •Вычисление теплового эффекта химической реакции Вычисление теплового эффекта химической реакции через систему термохимических уравнений
- •Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования гидратированных ионов
- •Вычисление теплового эффекта при заданной температуре
- •Вычисление теплового баланса процесса
- •Вычисление изменения энтропии химической реакции Вычисление изменения энтропии химической реакции при обычных условиях
- •Вычисление изменения энтропии химической реакции при заданной температуре
- •Вычисление энергии Гиббса химической реакции и определение направления протекания процесса Вычисление энергии Гиббса для реакций, протекающих при обычных условиях
- •Вычисление изобарно-изотермического потенциала реакций в водных растворах по стандартным энергиям Гиббса образования гидратированых ионов
- •Вычисление энергии Гиббса химической реакции при заданной температуре
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Расчет энергии Гиббса и константы равновесия при заданной температуре
- •6. Вычислить изменение энтропии реакции при 850 k:
- •8. Вычислить константу равновесия данной реакции по уравнению:
- •Метод Темкина-Шварцмана
- •Метод приведенных энергий Гиббса
- •Уравнение изобары химической реакции
- •1) Константу равновесия при данной температуре,;
- •2) Тепловой эффект реакции.
Уравнение изотермы химической реакции (влияние состава на равновесие)
![]() – уравнение
изотермы химической реакции
– уравнение
изотермы химической реакции
![]()
Пример. Константа диссоциации фосгена COCl2(g) = CO(g) + Cl2(g) при 600°С и давлении 1,38·105 Па равна 5,8. Определить, в каком направлении будет протекать процесс при следующих значениях парциальных давлений компонентов:
Вариант |
|
|
|
1 |
1 |
1 |
1 |
2 |
1,03 |
2 |
3 |
3 |
1,03 |
3 |
3 |
Решение. Пользуясь уравнением изотермы химической реакции
 ,
,
вычислить значения энергии Гиббса реакции, и сделать вывод о направлении протекания процесса.

реакция идет в прямом направлении.
![]() −
−
– состояние термодинамического равновесия.
![]() −
−
– процесс идет в обратном направлении.
Расчет энергии Гиббса и константы равновесия при заданной температуре
Пример. Вычислить энергию Гиббса реакции 4NH3(g) + 5O2(g) = 6H2O(g) + 4NO(g) при 850 K.
Решение. 1. Составить таблицу справочных данных, необходимых для расчета:
Компонент |
NH3(g) |
O2(g) |
H2O(g) |
NO(g) |
, кДж/моль |
−45,94 |
0 |
−241,81 |
91,26 |
, Дж·моль−1·K−1 |
192,66 |
205,04 |
188,72 |
210,64 |
a, Дж·моль−1·K−1 |
29,80 |
31,46 |
30,00 |
29,58 |
b·103, Дж·моль−1·K−1 |
25,48 |
3,39 |
10,71 |
3,85 |
c’·10−5, Дж·моль−1·K−1 |
−1,67 |
−3,77 |
0,33 |
−0,59 |
2. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:

3. Составить уравнение для расчета изменения энтропии реакции в соответствии с законом Гесса и произвести необходимые вычисления:

4. Пользуясь законом Гесса, найти изменение коэффициентов теплоемкости в ходе процесса:


5. Вычислить тепловой эффект реакции при 850 K:
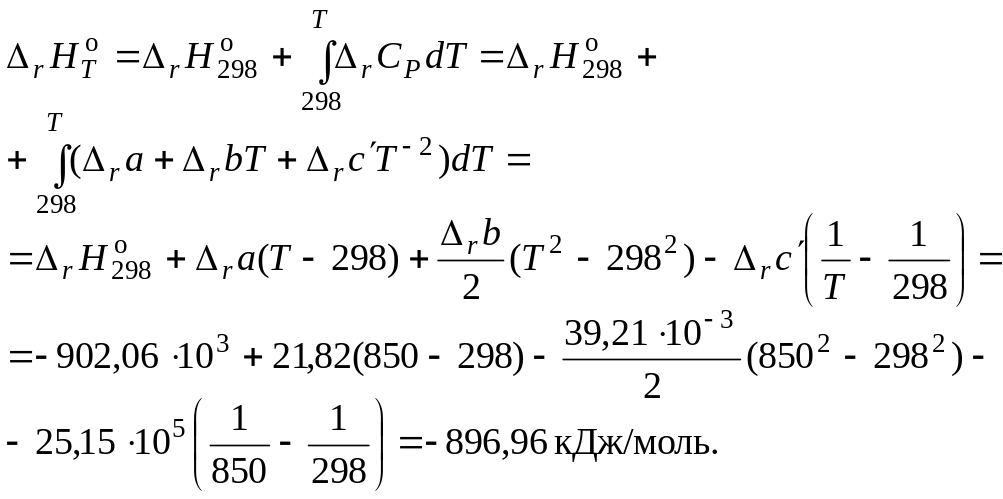
6. Вычислить изменение энтропии реакции при 850 k:


7. Вычислить изменение энергии Гиббса, учитывая разность в размерности теплового эффекта и энтропии:
![]()
8. Вычислить константу равновесия данной реакции по уравнению:
![]()

Метод Темкина-Шварцмана
Пример. Вычислить энергию Гиббса реакции 4NH3(g) + 5O2(g) = 6H2O(g) + 4NO(g) при 850 K.
Решение. 1. Составить таблицу справочных данных, необходимых для расчета:
Компонент |
NH3(g) |
O2(g) |
H2O(g) |
NO(g) |
, кДж/моль |
−45,94 |
0 |
−241,81 |
91,26 |
, Дж·моль−1·K−1 |
192,66 |
205,04 |
188,72 |
210,64 |
a, Дж·моль−1·K−1 |
29,80 |
31,46 |
30,00 |
29,58 |
b·103, Дж·моль−1·K−1 |
25,48 |
3,39 |
10,71 |
3,85 |
c’·10−5, Дж·моль−1·K−1 |
−1,67 |
−3,77 |
0,33 |
−0,59 |
2. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:
3. Составить уравнение для расчета изменения энтропии реакции в соответствии с законом Гесса и произвести необходимые вычисления:
4. Пользуясь законом Гесса, найти изменение коэффициентов теплоемкости в ходе процесса:
5. По таблице «Метод Темкина-Шварцмана» найти значения интегралов М0, М1 и М‒2 при заданной температуре 850 K.
В данном случае значения интегралов находят как среднее арифметическое для значений температуры 800 и 900 K.
Таблица 45, стр. 92
T, K |
M0 |
M1∙10‒3 |
M2∙10‒6 |
M‒2∙105 |
800 |
0,3597 |
0,1574 |
0,0733 |
0,2213 |
900 |
0,4361 |
0,2012 |
0,1004 |
0,2521 |
850 |
0,3979 |
0,1793 |
|
0,2376 |
6. Подставить данные в расчетную формулу:
![]() :
:
 7.
Вычислить константу равновесия по
формуле:
7.
Вычислить константу равновесия по
формуле:

