
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект практических занятий физическая химия
- •Применение первого начала термодинамики к процессам в идеальных газах
- •Расчет теплоемкости Вычисление средней теплоемкости
- •Расчет теплоемкости по Нейману и Коппу
- •Расчет теплоемкости твердого вещества по Эйнштейну-Дебаю
- •Расчет теплоемкости газа по квантово-статистической теории
- •Расчет количества теплоты для нагревания/охлаждения вещества
- •Вычисление теплового эффекта химической реакции Вычисление теплового эффекта химической реакции через систему термохимических уравнений
- •Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования гидратированных ионов
- •Вычисление теплового эффекта при заданной температуре
- •Вычисление теплового баланса процесса
- •Вычисление изменения энтропии химической реакции Вычисление изменения энтропии химической реакции при обычных условиях
- •Вычисление изменения энтропии химической реакции при заданной температуре
- •Вычисление энергии Гиббса химической реакции и определение направления протекания процесса Вычисление энергии Гиббса для реакций, протекающих при обычных условиях
- •Вычисление изобарно-изотермического потенциала реакций в водных растворах по стандартным энергиям Гиббса образования гидратированых ионов
- •Вычисление энергии Гиббса химической реакции при заданной температуре
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Расчет энергии Гиббса и константы равновесия при заданной температуре
- •6. Вычислить изменение энтропии реакции при 850 k:
- •8. Вычислить константу равновесия данной реакции по уравнению:
- •Метод Темкина-Шварцмана
- •Метод приведенных энергий Гиббса
- •Уравнение изобары химической реакции
- •1) Константу равновесия при данной температуре,;
- •2) Тепловой эффект реакции.
Вычисление теплового баланса процесса
Пример
1. Вычислить
тепловой баланс работы доменной печи
(приведенный к обычным условиям) в
расчете на 1 тонну чугуна по следующим
реакциям:
![]() ;
;
![]() ;
;
![]() ;
;
![]()
Решение. 1. Для реакции составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
C (т) |
СО2(г) |
СO(г) |
, кДж/моль |
0 |
-393,51 |
-110,53 |
2. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:
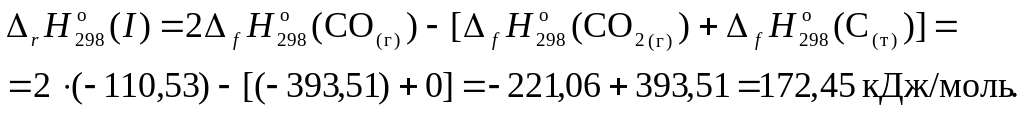
3. Для реакции составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
СO(г) |
|
СО2(г) |
, кДж/моль |
-822,16 |
-110,53 |
-1117,13 |
-393,51 |
4. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:
![]()
5. Для реакции составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
СO(г) |
|
СО2(г) |
, кДж/моль |
-1117,13 |
-110,53 |
-264,85 |
-393,51 |
6. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:
![]()
7. Для реакции составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
СO(г) |
Fe(s) |
СО2(г) |
, кДж/моль |
-264,85 |
-110,53 |
0 |
-393,51 |
8. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:
![]()
9. Вычислить суммарный тепловой эффект по всем реакциям:
![]()
Вычисление изменения энтропии химической реакции Вычисление изменения энтропии химической реакции при обычных условиях
В силу того, что энтропия – функция состояния, то к ней применим закон Гесса:
![]() ,
,
где
ν – стехиометрический коэффициент;
индекс i относится к
исходным веществам, индекс k
– к продуктам реакции.
![]() – энтропия образования вещества,
приведенная к стандартным условиям при
температуре Т.
– энтропия образования вещества,
приведенная к стандартным условиям при
температуре Т.
Пример 1. Вычислить изменение энтропии реакции 4NH3(g) + 5O2(g) = 6H2O(g) + 4NO(g) при 298 K.
Решение. 1. Составить таблицу справочных данных, необходимых для расчета:
Компонент |
NH3(g) |
O2(g) |
H2O(g) |
NO(g) |
|
192,66 |
205,04 |
188,72 |
210,64 |
2. Составить уравнение для расчета изменения энтропии реакции в соответствии с законом Гесса и произвести необходимые вычисления:
![]()
Пример 2. Вычислить изменение энтропии реакции обжига сфалерита (сульфида цинка) для обычных условий.
Решение. 1. Уравнение реакции обжига сфалерита: 2ZnS(s) + 3О2(g) = ZnO(s) + SO2(g)
2. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
ZnS(s) |
О2(g) |
ZnO(s) |
SO2(g) |
|
57,66 |
205,04 |
43,51 |
248,07 |
3. Составить уравнение для расчета изменения энтропии реакции и произвести необходимые вычисления:
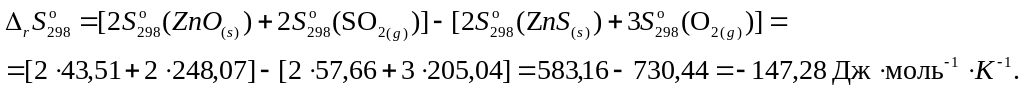
Пример 3. Вычислить изменение энтропии реакции горения ацетилена приведенное к обычным условиям
Решение. 1. Уравнение реакции горения ацетилена: 2С2Н2(г) + 5О2(г) = 4СО2(г) + 2Н2О(г)
2. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
C2H2(г) |
О2(g) |
СO2(г) |
Н2O(г) |
, Дж∙моль‒1∙K‒1 |
200,82 |
205,04 |
213,66 |
188,72 |
3. Составить уравнение для расчета изменения энтропии реакции и произвести необходимые вычисления:

