
- •Введение
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •М етодика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №8 электролитическая диссоциация произведение растворимости
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
Лабораторная работа №4 приготовление растворов
Ц е л ь р а б о т ы: ознакомиться со способами выражения концентрации растворов; овладеть методикой расчётов концентраций растворов и приготовления растворов определённых концентраций.
О б о р у д о в а н и е и м а т е р и а л ы: аналитические весы с разновесами, набор ареометров, мерный цилиндр, мерная колба ёмкостью 500см3, пипетки, конические колбы для титрования, химический стакан ёмкостью 600см3; концентрированный раствор соляной кислоты, раствор гидроксида натрия известной концентрации, кристаллогидрат сульфата никеля или другой соли, стеклянная палочка.
Методика выполнения работы
Опыт №1. Приготовление раствора соляной кислоты заданной концентрации
Получить у преподавателя задание на приготовление раствора соляной кислоты определённой массовой доли из исходного раствора кислоты.
Для расчета объема исходной кислоты необходимо знать ее массовую долю и плотность раствора. Плотность раствора можно измерить с помощью ареометра. Кислоту наливают в цилиндр и опускают в нее ареометр так, чтобы он не касался стенок цилиндра. Ареометр представляет собой пустотелую закрытую стеклянную трубку с расширением на нижнем конце. В верхней части трубки находится шкала с делениями, соответствующими различным значениям плотности. Нижняя часть ареометра наполнена свинцовой дробью. Наблюдение нужно вести по нижнему краю мениска жидкости.
Далее, пользуясь данными табл. 4.1, определить массовую долю растворенного вещества в растворе исходной соляной кислоты.
Таблица 4.1
Соотношения массовых долей и плотностей раствора hCl (20єС)
Массовая доля HCl W, % |
Плотность раствора HCl, с, г/см3 |
4,0 |
1,019 |
8,0 |
1,039 |
12,0 |
1,059 |
16,0 |
1,079 |
20,0 |
1,100 |
24,0 |
1,121 |
28,0 |
1,142 |
Если в таблице нет замеренных значений плотности, то массовую долю необходимо вычислить методом линейной интерполяции. Пусть замеренная плотность раствора HCl равна 1,089. По табл. 4.1 выбрать значения плотности меньше и больше замеренного и соответствующие им массовые доли.
Найти разность в значениях массовой доли и плотности:
20,0% ---------1,100 г/см3
16,0%--------- -1,079 г/см3
20,0-16,0=4%--------1,100-1,079=0,021 г/см3
Затем из большего значения плотности вычесть замеренное значение (1,089 г/см3): 1,100-1,089 = 0,011 г/см3.
Составить соотношение:
4%-----0,021 г/см3
Х%-----0,011 г/см3
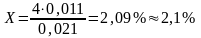 .
.
Полученное значение (2,1%) отнять от 20%:
Wисх(HCl ) = 20,0-2,1=17,9%.
Это и будет массовая доля соляной кислоты, позволяющая рассчитать объем исходного раствора, необходимого для приготовления HCl заданной концентрации.
Далее рассчитать объем исходной кислоты и приготовить раствор. С помощью пипетки отмерить рассчитанный объем исходной кислоты HCl, перенести в мерную колбу и довести воду до заданного объема.
Опыт №2.Определение концентрации приготовленного раствора соляной кислоты методом кислотно-основного титрования
В три конические колбочки налить при помощи мерной пипетки по 1 см3
приготовленной соляной кислоты и добавить в каждую по 2–3 капли фенолфталеина. Поставить колбочку на лист белой бумаги. Постоянно перемешивая жидкость, приливать в нее из пипетки небольшими порциями раствор щелочи известной концентрации до появления слабо-розовой окраски раствора. В кислом растворе фенолфталеин бесцветен, а в слабощелочном растворе приобретает малиновую окраску. Появление окраски свидетельствует о полной нейтрализации кислоты щелочью.
Повторить титрование три раза и сделать расчет концентрации приготовленного раствора HCl (Соп). Определить относительную ошибку опыта, сравнивая Соп с заданной концентрацией Сm.
Результаты свести в табл. 4.2.
Таблица 4.2
