
- •Введение
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •М етодика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №8 электролитическая диссоциация произведение растворимости
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
Контрольные вопросы
1. Как изменяются восстановительные свойства металлов в зависимости от величины стандартных электродных потенциалов?
2. Объясните устройство, принцип работы и назначение водородного электрода.
3. Что называется поляризацией гальванического элемента?
4. Какие гальванические элементы называют концентрационными? Объясните принцип работы концентрационного элемента.
5. Работа гальванического элемента основана на протекании следующей реакции: Zn+NiCl2=ZnCl2+Ni. Напишите схему гальванического элемента; приведите уравнения катодного и анодного процессов.
6. Схема гальванического элемента имеет следующий вид: Sn/SnCl2//HCl/H2(Ag). Напишите уравнения катодного и анодного процессов.
Лабораторная работа № 12 коррозия металлов и защита от неё
Ц е л ь р а б о т ы: ознакомиться с видами электрохимической коррозии и методами уменьшения скорости коррозии.
О б о р у д о в а н и е и м а т е р и а л ы: растворы 0,01 М и 1 М серной кислоты, 0,4 М уксусной кислоты, сульфата меди, железосинеродистого калия; штатив с пробирками, U-образные трубки, металлы: Zn, Sn, Cu,Fe, Al.
Методика выполнения
Опыт №1. Коррозия при контакте различных металлов
В стеклянную трубку, изогнутую под прямым углом, укреплённую в штативе, налить 0,01 М серной кислоты. С противоположных сторон введите цинковую и медную пластинки Рис. 12.1 или проволоки так, чтобы они не касались друг друга (рис. 12.1.). На каком месте наблюдается выделение пузырьков водорода?
Погрузить пластинки таким образом,
чтобы они контактировали друг с другом. Что наблюдается при соприкосновении пластинок? При нарушении контакта между ними?
Составить схему действий образующейся гальванопары. Как повлияет контакт с медью на коррозию цинка? Описать наблюдаемые явления и объяснить их.
Опыт №2. Образование микрогальванопар
В две пробирки налить по 2–3 см3 1 М серной кислоты. Опустить в них по одинаковому кусочку гранулированного цинка. Наблюдать медленное выделение водорода. В одну из пробирок прилить 3–4 капли раствора CuSО4.
Обратить внимание на изменение скорости выделения водорода в пробирке с CuSО4 по сравнению с контрольной. Какие процессы протекают при этом? Описать наблюдаемые явления и объяснить результаты опыта.
Опыт №3. Электрохимическая коррозия железа и защита от неё
а). В пробирку налить 5 см3 воды, 2–3 капли K3[Fe(CN)6] и столько же раствора FeSО4. Образуется синий осадок турнбулевой сини Fе3[Fе(СN)6]2. Он свидетельствует о наличии в растворе катионов Fe 2+.
б). В две пробирки налить до половины объёма дистиллированную воду. Добавить по 3 капли 1 М серной кислоты, столько же раствора K3[Fe(CN)6] и перемешать стеклянной палочкой. Взять две тонкие железные проволоки и очистить их наждачной бумагой. Одной проволокой обмотать кусочек цинка, другой – кусочек олова. Каждый металл опускать в отдельную пробирку с кислотой.
Что наблюдается через несколько минут в одной из пробирок? Чем это объяснить? Почему в пробирке с парой Fe-Zn синее окрашивание не наступает или наступает значительно позднее? На основании этого опыта объяснить, почему оцинкованное железо более устойчиво против коррозии, чем луженое?
Описать наблюдаемые явления и ответить на поставленные вопросы. Дать схему перехода электронов при коррозии оцинкованного и луженого железа и указать, в каком случае при местном разрушении защитного покрова будет происходить ржавление железа под остающимся неизменным защитным слоем?
Опыт №4. Коррозия в результате различного доступа кислорода
Очистить стальную пластинку наждаком, промыть и вытереть фильтровальной бумагой и на чистую поверхность нанести каплю специального реактива, состоящего из 0,5 М раствора хлорида натрия, к которому добавлен железосинеродистый калий и фенолфталеин (2–3 капли фенолфталеина на 10 см3 раствора).
Из-за различного доступа кислорода к поверхности металла на ней образуется гальванопара особого вида: около краёв капли, куда кислороду проникнуть легче, возникают менее активные катодные участки; в центре, где толщина слоя воды больше и кислороду проникнуть труднее, анодный участок (рис. 12.2).
–
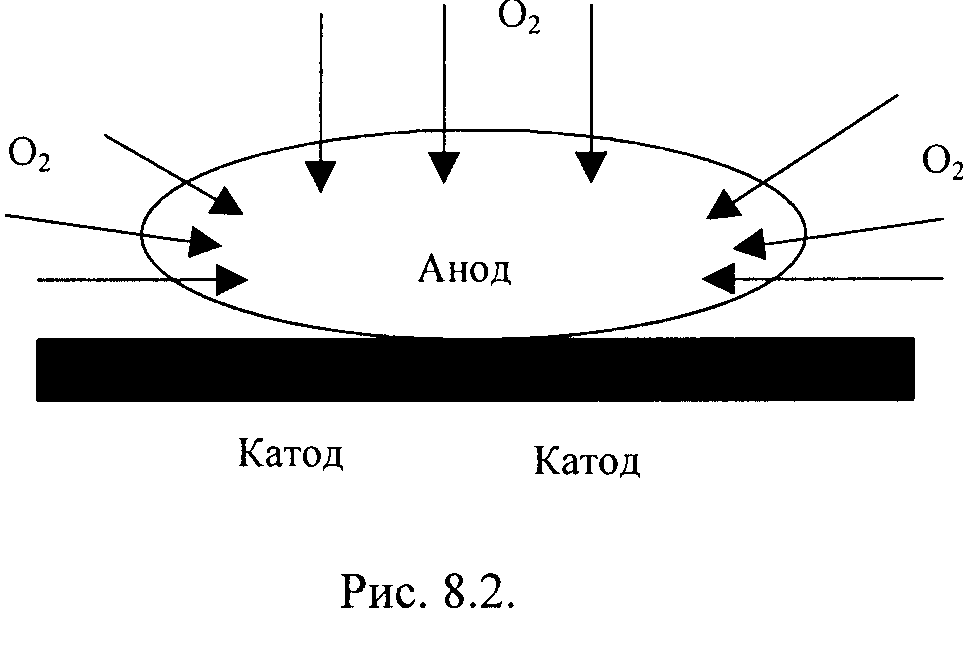
Рис.12.2
Опыт №5. Протекторная защита металлов
В U-образную трубку электролизера налить 0,4 М раствор уксусной кислоты и несколько капель раствора йодида калия. В одно колено опустить свинцовую пластинку, в другое – цинковую. Соединить их медным проводом. В пробирку с теми же растворами опустить свинцовую пластинку. В каком сосуде появится раньше жёлтый осадок йодида свинца? Составить схему действия гальванопары и объяснить полученные результаты.
Опыт №6. Ингибиторы коррозии
В три пробирки налить по 4–5 см 3 1 М серной кислоты. В одну положить кусочек железа, во вторую – цинка, в третью – алюминия. Слегка нагреть, чтобы интенсивно выделялся водород. Затем в каждую пробирку внести немного порошка уротропина. Наблюдать изменение скорости выделения водорода. Сделать выводы.
