
- •Введение
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •М етодика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №8 электролитическая диссоциация произведение растворимости
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
Результаты измерений
Масса бюкса, г |
Масса бюкса с СuSО4, г |
Навеска СuSО4, г |
Vводы, см3 |
Т1 (до реакции), К |
Т2 (после реакции), К |
ДТ, К |
ДНоп (опыт- ное) |
ДНт (теоре- ти- ческое) |
|
|
|
|
|
|
|
|
|
Расчет теплового эффекта:
1.Рассчитать, сколько теплоты (ДН, Дж) выделяется при растворении взятой навески СuSО4:
ДН = (mж ·Сж + mст ·Сст) · ДТ , (Дж),
где mж и mст – масса жидкости в стакане и масса самого стакана, кг; Сж и Сст – удельные теплоемкости стекла и жидкости (Сст = 0,75·103 Дж/кг· К, Своды = 4,18·103 Дж/кг· К), mж = Vводы·с (с=1г/см3).
2. Рассчитать тепловой эффект реакции нейтрализации (ДНоп, кДж):
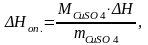
где М СuSО4 - молярная масса соли.
3. Определить относительную ошибку опыта. Гидратация безводной соли и растворение пятиводной соли (кристаллогидрата в воде) выражается уравнениями:
СuSО4 + 5 Н2О = СuSО4 · 5 Н2О, ДН = -74,4 кДж,
СuSО4 · 5 Н2О + аq = СuSО4 · аq, ДН = +11,0 кДж,
ДНт (СuSО4 · 5 Н2О) = -63,4 кДж,
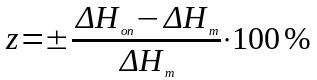 .
.
Опыт №3. Установление количественного значения теплового эффекта реакции нейтрализации
Отмерить цилиндром 50 см3 0,5М раствора соляной кислоты и перелить в стакан, который затем поместить в калориметр. Закрыть плотно крышкой с отверстием. Опустить термометр и замерить температуру раствора соляной кислоты. Отмерить цилиндром 50 см3 0,5М раствора гидроксида натрия, вылить в раствор соляной кислоты. Быстро перемешать и отметить температуру раствора с точностью до 0,1 єС.
Результаты свести в таблицу 3.2.
Таблица 3.2
Результаты измерений
V0,5МHCl, см3, ТHCl, г/см3 |
V0,5МNаОН, см3 |
Т1 до реакции, К |
Т2 после реакции, К |
ДТ, К |
ДНт(теоретическое) |
ДНоп (опыт ное) |
50 |
50 |
|
|
|
|
|
Расчет теплового эффекта:
1.Рассчитать, сколько теплоты (ДН, Дж) выделяется при нейтрализации 50 см3 0,5М раствора HCl:
ДН = (mж ·Сж + mст ·Сст) · ДТ ,
где mж и mст – масса жидкости в стакане и масса самого стакана, кг; Сж и Сст – удельные теплоемкости стекла и жидкости (Сст = 0,75·103 Дж/кг· К, Своды = 4,18·103 Дж/кг· К), Vр-ра = VHCl +VNаОН, mж = Vр-ра·с (с=1г/см3)
2. Вычислить массу прореагировавшей соляной кислоты:
mHCl = ТHCl,· VHCl, где ТHCl, – титр соляной кислоты.
3. Рассчитать тепловой эффект реакции нейтрализации (ДНоп, кДж):
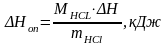 ,
,
где МHCl – молярная масса соляной кислоты.
4. Зная, что ДНт реакции нейтрализации равно (-54,8 кДж), определить относительную ошибку опыта:
.
Контрольные вопросы
1. Что называется стандартной энтальпией образования соединения? Какие условия принято называть стандартными?
2. Какие химические реакции называются экзотермическими, эндотермическими?
3. Почему энтальпия нейтрализации сильной кислоты сильным основанием одинакова для различных кислот и оснований?
4. Чему равна энтропия идеального кристалла при абсолютном нуле? В каких единицах изменяется энтропия?
5. Какую информацию о веществе можно получить, используя значения энергии Гиббса?
6. Какими одновременно действующими факторами определяется направленность химического процесса?
7. Стандартные энтальпии образования ДН0298(кДж/моль) НН3 и РН3 равны соответственно – 46,2 и + 5,4. Какой следует сделать вывод из этих данных об относительной устойчивости молекул НН3 и РН3?
