
- •Введение
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •М етодика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №8 электролитическая диссоциация произведение растворимости
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
Направление окислительно-восстановительных реакций
Опыт №8. Влияние характера среды на протекание окислительно-восстановительных реакций
В три пробирки налить по 1–2 мл раствора КМnO4, затем прибавить: в первую – 5 капель разбавленной серной кислоты, во вторую – 5 капель дистиллированной воды, в третью – 5 капель концентрированного раствора щёлочи. После этого в каждую из пробирок прибавить шпателем одинаковое количество сухой соли Na2SO3. Встряхиванием раствора добиться изменения окраски в каждой из пробирок. Составить уравнение реакций на основе электронного баланса, имея ввиду следующее:
а)
во всех трёх случаях ион
 переходит в ион
,
причём оба иона являются бесцветными
и на окраску раствора не влияют;
переходит в ион
,
причём оба иона являются бесцветными
и на окраску раствора не влияют;
б) в кислой среде ион МnО-4 переходит в ион Мn2+
в)
в нейтральной среде ион МnО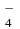 восстанавливается до МnО2;
восстанавливается до МnО2;
г)
в щелочной среде образуется ион
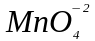 ,
который окрашивает раствор в зелёный
цвет.
,
который окрашивает раствор в зелёный
цвет.
Опыт №9. Влияние кислотности среды на направление реакции взаимодействия йода с щёлочью
Кристаллик йода обработать в пробирке небольшим количеством раствора щёлочи при слабом нагревании. Наблюдать переход йода в раствор. Составить уравнение реакции, имея в виду, что одним из продуктов реакции является йодат щелочного металла.
Полученный раствор подкислить разбавленной серной кислотой. Наблюдать выделение свободного иода. Составить уравнения реакции взаимодействия иодида и иодата в присутствии. Н2SO4. Объяснить, почему реакция пошла в обратном направлении.
Контрольные вопросы
1. Какие вещества могут быть:
а) только окислителями;
б) только восстановителями;
в) одновременно и окислителями и восстановителями? От чего это зависит?
2. Чем объяснить двойственность свойств пероксида водорода в окислительно-восстановительных реакциях?
3. Какие известны типы окислительно-восстановительных реакций?
4. Чем отличаются реакции межмолекулярного от реакций внутримолекулярного окисления-восстановления?
5. Привести 3 пары веществ, которые могут реагировать между собой по типу реакций окисления-восстановления с участием атомов одного и того же элемента в разных степенях окисления?
6.Какие из перечисленных веществ могут подвергаться диспропорционированию: КС1; NaNO2; CuSO4; I2; SO2; K2CrO4?
7. В какой среде КМnO4 является более сильным окислителем?
8. Почему изменением рН раствора можно добиться протекания окислительно-восстановительной реакции в обратном направлении?
9. Какой фундаментальный закон природы лежит в основе составления уравнений окислительно-восстановительных реакций методом электронно- ионного баланса?
Лабораторная работа № 11 гальванический элемент
Ц е л ь р а б о т ы: познакомиться с устройством и принципом действия гальванического элемента, научиться определять ЭДС гальванических элементов.
О б о р у д о в а н и е и м а т е р и а л ы: растворы сульфата цинка, сульфата железа (II), хлорида олова (II), ацетата свинца, сульфата меди, нитрата серебра, серной кислоты; пластинки металлов: Zn, Fe, Sn, Pb, Cu; химические стаканы (150 см3); штатив с пробирками; электролитический ключ.
