
- •Особливості відбору проб на аналіз
- •Консервування та підготовка проб води до аналізу
- •Методи аналізу води
- •1.1. Визначення кольоровості води
- •1.2. Визначення запаху
- •Лабораторна робота № 2 визначення зависей та розчинених речовин
- •2.1. Визначення прозорості води
- •2.2. Визначення каламутності води
- •2.3. Визначення вмісту розчинених речовин (сухого залишку)
- •Лабораторна робота № 3 визначення перманганатної й дихроматної окиснюваності
- •3.1. Визначення перманганатної окиснюваності води
- •3.2. Визначення хімічного споживання кисню
- •3.3. Визначення дихроматної окиснюваності води прискореним методом
- •Лабораторна робота № 4 визначення біохімічного споживання кисню
- •Лабораторна робота № 5 визначення твердості води
- •5.1. Визначення твердості води спиртово-мильним методом
- •5.2. Визначення загальної твердості комплексометричним методом
- •5.3. Визначення загальної карбонатної твердості
- •5.4. Визначення залишкової карбонатної твердості
- •Лабораторна робота № 6 визначення розчиненого кисню методом вінклера
- •Лабораторна робота № 7 визначення кислотності й лужності води
- •7.1. Визначення рН води
- •7.2. Визначення кислотності води
- •7.3. Визначення лужності
- •Лабораторна робота № 8 визначення сполук нітрогену — аміаку, нітритів і нітратів
- •8.1. Визначення аміаку
- •Напівкількісний метод
- •Кількісний фотоколориметричний метод
- •8.2. Визначення нітритів
- •Якісний метод з наближеною кількісною оцінкою
- •Кількісний фотометричний метод
- •8.3. Визначення нітратів
- •Лабораторна робота № 9 визначення активного хлору
- •Лабораторна робота № 10 дослідження антропогенної евтрофікації водойм
- •11.3. Функціональна схема аналізатора
- •11.4. Підготовка аналізатора до роботи
- •11.4.1. Техніка безпеки
- •11.4.2. Градуювання аналізатора
- •11.5. Вимірювання масової концентрації ртуті
- •12.3. Функціональна схема й принцип роботи аналізатора
- •12.4. Принцип дії аналізатора
- •12.4.1. Принцип дії каналу вимірювань масової концентрації розчиненого у воді кисню о2
- •12.4.2. Принцип дії каналу вимірювання рН
- •12.4.3. Принцип дії каналу вимірювання температури
- •12.5. Приготування аналізатора до вимірювань
- •12.5.1. Приготування чутливого елемента о2
- •12.5.2. Приготування електродної системи рН
- •12.6. Порядок проведення вимірювань
- •12.6.1. Техніка безпеки
- •12.6.2. Порядок проведення вимірювань
- •12.6.3. Відлік показників вимірювань
- •12.6.4. Графічний аналіз результатів вимірювань
- •Додаток
- •Бібліографічний список
3.3. Визначення дихроматної окиснюваності води прискореним методом
Метод використовується для аналізу слабозабруднених стічних вод. Якщо у воді містяться хлорид-іони, їх потрібно або відділити, або визначити їх вміст і результат відняти від загальної окиснюваності води.
Обладнання і реактиви: конічна колба для титрування на 250 мл; мірна колба місткістю 1 л; піпетки Мора; сульфатна кислота (=1,84 г/см3); сульфат аргентуму Аg2SО4 (кристалічний); N‑фенілантранілова кислота (0,25 г кислоти розчиняють у 12 мл розчину NaOH з С=0,1 моль/л, і розбавляють водою до 250 мл); розчин К2Сr2О7 з С(1/z К2Сr3O7)=0,025 моль/л (1,226 перекристалізованого K3Сr2О7 висушеного за температури 130°С протягом двох годин, розчиняють у дистильованій воді й доводять об'єм розчину до 1 л); сіль Мора з С(1/z)=0,025 моль/л (9,8 г солі Мора розчиняють у воді, що містить 20 мл сульфатної кислоти (=1,84 г/см3) й доводять об'єм розчину до 1 л.
Хід роботи
50 мл стічної води вносять у конічну колбу з притертою пробкою місткістю 250 мл. Доливають 25 мл розчину дихромату калію, додають 0,3…0,5 г сульфату аргентуму і 20 мл концентрованої сульфатної кислоти. Колбу закривають пробкою і залишають на десять хвилин. Періодично перемішують, не відкриваючи пробки.
Не охолоджуючи розчину, приливають 5—7 крапель індикатора й титрують розчином солі Мора до переходу забарвлення розчину з бурувато-зеленого до чисто-зеленого.
Окиснюваність води, мг О2/л, визначають за формулою
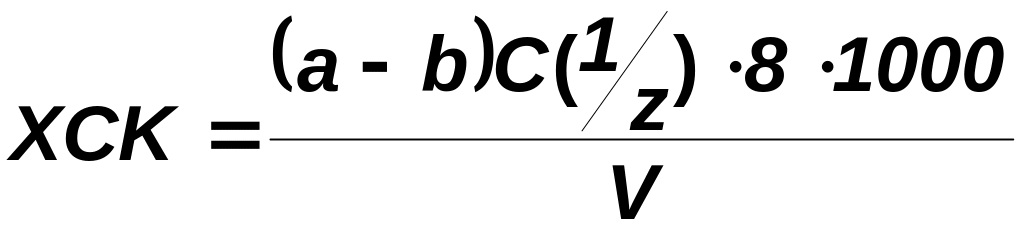 ,
,
де а і b — об'єм солі Мора, витрачений на титрування контрольної проби й аналізованого розчину відповідно, мл; С(1/z) — молярна концентрація еквівалентів розчину солі Мора; V — об'єм проби, взятий для аналізу, мл; 8 — еквівалент кисню.
Контрольні запитання і завдання
Про що свідчить висока окиснюваність води?
Чому для визначення окиснюваності води використовують або перманганат калію, або дихромат калію?
Як впливає висока окиснюваність води (значна концентрація органічних речовин) на вміст кисню у водоймі?
Лабораторна робота № 4 визначення біохімічного споживання кисню
БСК5 — це кількість кисню в міліграмах, потрібна для окиснення органічних речовин, що містяться в 1 л води, аеробними бактеріями до СО2 і Н2О впродовж п’яти діб без доступу повітря й світла.
БСК5 — важливий екологічний показник стану природних во-дойм. При високому вмісті органічних речовин у воді швидко розмножуються аеробні бактерії, для життєдіяльності яких необхідний кисень. Це може зумовити зниження вмісту розчиненого кисню, призвести до гіпоксичних умов і загибелі окремих видів гідробіонтів. БСК5 не містить затрат на нітрифікацію.
Перед проведенням аналізу на біохімічне споживання кисню заздалегідь визначають окиснюваність води: перманганатну (якщо вода містить незначну кількість органічних речовин), дихроматну (за умови високого вмісту органічних речовин, включно з важкоокиснюваними).
Стічну воду відстоюють протягом двох годин і розбавляють її призначеною для цього водою. Розбавляння розраховують діленням значення ХСК (мг О2/л) на 4. Цей результат показує, у скільки разів треба розбавити воду, що аналізується. Без розбавляння визначають БСК5 від 0 до 6 мг О2/л. Вміст кисню у пробі після інкубації не має бути нижче 2…3 і вище за 5…6 мг О2/л.
Мінімальний об'єм відібраної проби — 10 мл; якщо потрібна менша кількість води, виконують ступінчасте розбавляння. Пробу відміряють і наливають у мірну колбу місткістю 500 мл, доливають до риски водою для розбавляння. Якщо проба розбавлена менше, ніж 1:20, її слід термостатувати. Пробу в колбі перемішують.
Приготування води для розбавляння. Воду для розбавляння готують із дистильованої води, яку відстоювали впродовж чотирьох-п’яти діб, додаючи туди поживні для мікроорганізмів солі. До них відносять:
фосфатний буферний розчин — рН = 7,2; 8,5 г КН2РО4; 21,75 г NH4Cl розчиняють у дистильованій воді й доводять об'єм до 1 л;
сульфат магнію: 22,5 г МgSO4∙7Н2О розчиняють у дистильованій воді й додають води до 1 л;
хлорид феруму (III): 0,25 г FеСІ2∙6Н2O розчиняють у дистильованій воді й доводять об'єм до 1 л.
хлорид кальцію: 27,5 г СаСІ2 розчиняють у дистильованій воді й доводять об'єм до 1 л.
У дистильовану воду вносять по 1 мл поживних солей на 1 л води. Для аерації суміш перемішують струшуванням колби. Безпосередньо перед визначенням БСК у воду для розбавляння додають культуру мікроорганізмів (1 мл на 1 л води) і 200 мг гідрокарбонату натрію NaНСО3 на 1 л води для створення рН у межах 6,8…7,5.
Як культуру мікроорганізмів використовують «ґрунтову бовтанку»: 25 г ґрунту з горщиків для квітів вносять у 0,5 л дистильованої води, перемішують, відстоюють протягом однієї години, два рази фільтрують; фільтрат додають до води для розбавляння в кількості 1 мл на 1 л води.
Вода для розбавляння за кімнатної температури (18…20°С) має містити 8…9 мг/л розчиненого кисню. БСК води для розбавляння визначають одночасно з визначенням БСК проби. БСК5 води для розбавляння не має перевищувати 0,5 мг/л.
Обладнання і реактиви: склянки для визначення БСК5, піпетки, бюретка, штатив, лійка з гумовим наконечником, вода для розбавляння, розчин тіосульфату натрію Na2S2O, C(1/z)= 0,1 моль/л (титр перевіряють один раз на тиждень за стандартним розчином дихромату калію); крохмаль, 0,5%-й розчин; концентрована сульфатна кислота; сульфат або хлорид мангану (розчиняють 400 г МnSО4∙2Н2О, 480 г МnSО4∙4Н2О, 364 г МnSО4∙Н2O або 425 г МnСl∙4Н2О) у дистильованій воді й доводять об'єм до 1 л, потім фільтрують); лужний розчин йодиду калію або натрію (700 г КОН або 500 г NaОН розчиняють у дистильованій воді так, щоб об'єм становив приблизно 800 мл). Коли осад карбонатів осяде на дні колби, прозору рідину зливають в іншу колбу. Окремо в невеликій кількості води розчиняють 150 г КІ або 135 г NaI. Розчини змішують і доводять об'єм до 1 л. Під час підкислення й розбавляння розчин не повинен давати з крохмалем синього забарвлення (відсутні NO2–,IO3, Fe3+), однак має синіти від однієї краплі розчину йоду з С(1/z I2)=0,1 моль/л (відсутні речовини, що поглинають йод).
Якщо у лужному розчині містяться речовини, що при підкисленні виділяють йод, розчин обробляють стопом Деварда. Для цього до розчину додають 1 г стопу, залишають на ніч, потім нагрівають до закипання. Після охолодження, відібравши невелику порцію розчину й підкисливши його за допомогою реактиву Грісса перевіряють, чи остаточно видалені нітрити (розчин має бути безбарвним; за наявності нітритів — рожевіє). Розчин зберігають у склянці з темного скла.
Хід роботи
Склянки для визначення БСК ополіскують і заповнюють доверху водою через лійку з гумовим наконечником для запобігання попадання бульбашок повітря (дві склянки з досліджуваною водою і чотири склянки з водою для розбавляння). В одній склянці з аналізованою водою і в двох склянках з водою для розбавляння відразу ж визначають концентрацію розчиненого кисню, в решті склянок вимірювання проводять через п’ять діб.
У склянку, заповнену пробою, на дно вносять 2 мл розчину МnSO4, потім під рівень проби вводять 2 мл лужного розчину КI. Склянку закривають пробкою. Перемішують до утворення пластівців осаду МnО2.
Дають осаду відстоятися, потім додають 1 мл концентрованої Н2SО4 і перемішують до повного його розчинення.
Відбирають дві проби по 50 мл і титрують розчином Na2S2O3 з С(1/z)=0,01 моль/л.
Воду для розбавляння відбирають по 100 мл з кожної колби.
Біохімічне споживання кисню обчислюють за формулою
![]() –
БСКрозб.води∙N,
–
БСКрозб.води∙N,
де А1 і В1 — об'єм розчину Na2S2О3, з С(1/z)=0,01 моль/л, витраченого на титрування досліджуваної проби відповідно до і після інкубації упродовж 5 діб, мл; V — об'єм проби води, взятої на титрування, мл; K — поправковий коефіцієнт для приведення молярної концентрації розчину Nа2S2О3 точно до 0,01; 0,01 — молярна концентрація розчину Na2S2O3; 8 — еквівалент кисню; БСК води для розбавляння (БСКрозб.води) обчислюють за різницею вмісту розчиненого кисню до і після інкубації; N — розбавляння проби.
Контрольні запитання і завдання
Чому під час приготування води для розбавляння в неї додають фосфати, солі магнію, кальцію та феруму?
Які організми — аеробні або анаеробні — в умовах визначення БСК5 беруть участь в окисненні органічних сполук ? Які кінцеві продукти окиснення органічних речовин аеробними бактеріями?
Чому БСК5 є важливим екологічним показником стану природних водойм?
