
- •Назначение и свойства промывочной жидкости для бурения осложненных зон.
- •Часть 1. Теоретические основы структурирования промывочных жидкостей
- •Структура промывочных жидкостей
- •Гидрофобные (коагуляционные) структуры
- •Толщина диффузионного слоя с увеличением концентрации ионов и их заряда снижается в соответствии с уравнением
- •Гидрофильные структуры
- •1.2.1 Структура воды
- •1.2.2 Поверхностная энергия твердых тел.
- •Поверхностные натяжения твердых тел
- •1.2.3. Взаимодействие воды с поверхностью твердых тел.
- •2. Структура глинистого раствора.
- •2.1 Структурообразователи
- •2.2 Механизм гидрофильного структурообразования глинистых растворов
- •2.3. Объёмная электрическая энергия промывочной жидкости
- •Среднее значение
- •2.4. Приборы для определения прочности структуры промывочных жидкостей
- •3. Структурирование глинистых растворов
- •3.1. Способы структурирования
- •3.2. Структурирование промывочной жидкости за счет повышения концентрации дисперсной фазы
- •3.3. Структурирование буровых растворов путем диспергирования твердой фазы
- •Влияние числа импульсов генератора на свойства растворов
- •3.4. Влияние температуры на прочность структуры глинистых растворов
- •4. Роль электролитов в структурировании промывочных жидкостей.
- •4.1. Общие сведения об электролитах, применяемых при бурении скважин.
- •Зависимость рН растворов солей от их концентрации
- •Теплота растворения электролитов
- •4.2. Электролиты в роли структурообразователя
- •4.3. Активация твердой фазы электролитами.
- •4.4. Дезактивация дисперсной фазы электролитами
- •5. Роль полимеров в структурировании промывочных жидкостей.
- •5.1. Полимеры – структурообразователи.
- •5.1.2. Синтетические структурообразователи
- •5.2. Активность полимеров
- •Расчетные значения энергии поляризации
- •5.3. Другие функции полимеров.
- •5.4. Активация полимеров.
- •5.5. Активация дисперсионной среды полимерных растворов.
- •5.6. Активация твердой фазы полимерами
- •5.7. Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •5.8 Стабильность (седиментационная и агрегативная устойчивость) раствора.
- •5.9 Стабилизация буровых растворов полимерами.
- •Устойчивость реагентов к агрессии солей
- •6. Деструктурирование промывочных жидкостей
- •6.1. Искусственное деструктурирование (разжижение) промывочных жидкостей путем снижения концентрации твердой фазы
- •6.2. Деструктурирование промывочных жидкостей путём активации твёрдой фазы. Понизители вязкости.
- •6.3. Деструктурирование минерализованных промывочных жидкостей
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей
- •7.1.Вязкость ньютоновских жидкостей
- •Силу трения можно выразить формулой
- •Тогда касательное напряжение составит
- •Коэффициент кинематической вязкости будет
- •7.2. Вязкость структурированных жидкостей
- •7.2.1. Анализ существующих теорий
- •7.2.2. Влияние скорости течения, диаметра труб и концентрации твердой фазы на вязкость и коэффициент трения структурированных жидкостей
- •Влияние вязкости полимерного раствора и скорости
- •Зависимость показания раствора от концентрации кельцана
- •7.2.3. Влияние активации и дезактивации твёрдой фазы на коэффициент трения (вязкость) структурированных жидкостей.
- •7.3. Деструктурирование промывочных жидкостей при циркуляции.
- •7.3.1. Влияние длительности циркуляции структурированной жидкости на её вязкость
- •7.3.2. Влияние температуры на вязкость промывочных жидкостей.
- •7.4. Определение вязкости (касательных напряжений) промывочных жидкостей.
- •Значения вязкости различных буровых растворов
- •7.5. Влияние прочности структуры и вязкости промывочных жидкостей на процесс бурения
- •7.6. Тиксотропия промывочных жидкостей
- •Выводы:
- •7.7.Плотность промывочной жидкости.
- •Плотность аэрированной жидкости определяется по формуле
- •Часть II. Стабилизация неустойчивых стенок скважин. Задачами второй части исследований являются:
- •8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость горных пород стенок скважин.
- •9. Промывочные жидкости для бурения уплотненных глин.
- •9.1. Уплотненные глины
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глин.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •10. Промывочные жидкости для бурения неуплотненных глин
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин (общие понятия).
- •10.5. Исследование крепящих свойств полимерполисолевых растворов.
- •10.5.1. Теоретические рассуждения.
- •10.5.2. Экспериментальные исследования.
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород.
- •11.1. Микротрещиноватые глинистые породы. Осложнения при бурении
- •11.2. Влияние технологических параметров бурения на раскрытие трещин
- •11.3. Влияние гидродинамического давления на раскрытие трещин
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для кольматации трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •12.5. Применение пен при бурении трещиноватых пород
- •13. Промывочные жидкости для бурения соленосных отложений
- •13.1. Осложнения при бурении соленосных отложений
- •13.2. Растворение хемогенных горных пород Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.
- •Измерение массы и длины образцов соли при растворении в воде
- •13.3. Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.4. Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
- •Скорость растворения галита в перемешиваемом растворе, м/с10-7 (емкость 10л)
- •Из анализа результатов следует:
- •13.5. Промывочные жидкости, применяемые для бурения соленосных отложений
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •Продолжение таблицы 13.7
- •13.6. Анализ качества применяющихся промывочных жидкостей для бурения соленосных отложений
- •Скорость растворения галита в циркулирующих растворах
- •13.7. Силикатные растворы
- •Состав и свойства сульфатосиликатных и карбонатосиликатных растворов
- •13.8. Лигниноглинистые растворы
- •Заключение
- •Библиографический список
- •3. Структурирование глинистых растворов 42
- •4. Роль электролитов в структурировании промывочных жидкостей. 55
- •5. Роль полимеров в структурировании промывочных жидкостей. 78
- •6. Деструктурирование промывочных жидкостей 116
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей 131
- •9. Промывочные жидкости для бурения 188
- •10. Промывочные жидкости для бурения неуплотненных глин 222
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород. 264
- •12. Промывочные жидкости для бурения трещиноватых горных пород. 279
- •13. Промывочные жидкости для бурения соленосных отложений 304
2.2 Механизм гидрофильного структурообразования глинистых растворов
В настоящее время существует несколько взглядов на структуру промывочных жидкостей. Ряд исследователей [9, 41, 42] считает, что глинистые минералы в воде расщепляются на отдельные пластины, толщиной 7-15 Ао.
Вокруг пластинок образуются гидратные и диффузные слои противоионов. На ребрах пластин (активных центрах коагуляции) толщина гидратных и диффузных слоев невелика и при соприкосновении пластин активными центрами происходит их слипание с образованием пространственных каркасов подобно каркасам гидрофобных структур.
Причем при коагуляции частиц возможны следующие варианты слипания частиц: ребро с ребром, ребро с плоскостью и плоскость с плоскостью.
В зависимости от варианта связи изменяется энергия взаимодействия между частицами и прочностью структуры. Характер связи оказывает влияние на диффузию и седиментацию глинистых растворов.
Предполагается [9], что в концентрированных суспензиях наряду с нормально и перпендикулярно расположенными пластинами часть гибких листочков могут изгибаться в направлении базальной поверхности. Если заряд на ребрах отрицательный, то за счет отталкивания частиц базальными поверхностями пластинок ориентируются параллельно друг другу.
Соединение пластинок по базальным поверхностям приводит к их агрегации. При этом часть воды связана с поверхностью глинистых частиц, а часть захвачена в ячейки структуры.
Между глинистыми частицами и водой существует четыре формы связи: 1) химически связанная вода (в виде кристаллогидратов); 2) адсорбационно связанная вода (в виде молекулярного слоя на поверхности глинистых пластин); 3) капиллярно связанная вода (между глинистыми пакетами); 4) свободная вода (в ячейках пространственных структур).
Работами Ф.Д. Овчаренко [49] и других исследователей установлено, что поверхностные свойства глинистых минералов, а следовательно, и коагуляционное структурирование в водных суспензиях зависит от особенностей строения глинистых частиц, но не в идеальной форме в виде пластин, а с учетом большого числа и глубины несовершенства и дефектов в кристаллической решетке. Именно этими факторами определяется химия поверхности и форма частиц глинистых минералов, влияющих на характер процессов структурирования. В результате дефектов в кристаллической решетке наблюдается неравномерное распределение зарядов на поверхности частиц.
В настоящее время существует мнение [14], что глинистые частицы ничем не отличаются от другой коллоидной частицы изометричной формы. Поверхностные свойства глинистого минерала имеют ту же природу, что и свойства любого дисперсного вещества, и учитывать необходимо только силы межмолекулярного взаимодействия частиц с дисперсной средой.
Электронно-микроскопические снимки с увеличением в 20000 раз саригюхского и пыжевского монморилонитов [14], проведенные Э.Г. Агабальянцом, показывают, что никаких отдельных глинистых пластин в глинистой суспензии не наблюдается. Видны только глинистые частицы различных размеров приблизительно изометрической формы.
Рассмотрим механизм структурообразования глинистых растворов. В соответствии с современными взглядами, глина представляет собой совокупность гидрофильных глинистых частиц различных фракций. Наиболее активна коллоидная фракция размером от микрона и менее.
Энергия взаимодействия полярных молекул воды с полярной поверхностью глинистых частиц, зависит от поверхностной энергии (гидрофильности) твёрдой частицы, ориентации молекул воды относительно её поверхности (ориентационного взаимодействия) и электростатического взаимодействия гидратов частиц.
Суммарную энергию взаимодействия молекул воды с поверхностью частицы твёрдой фазы можно выразить суммой энергий ориентационного и электростатического (ион - дипольного) взаимодействия [33]
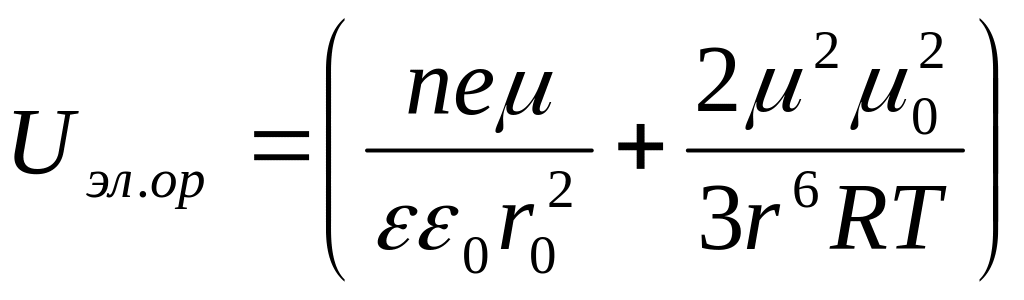 (2.1)
(2.1)
где е - заряд частицы; - дипольный момент молекулы воды; 0 – дипольный момент функциональной группы.
Из формулы следует, что межмолекулярное (ван-дер-ваальсовое) взаимодействие с увеличением расстояния r убывает весьма интенсивно, электростатическое значительно медленнее и поэтому распространяется на большие расстояния.
Заряд гидрофильных частиц твердой фазы определяется полярностью функциональных групп, их количеством и суммарной удельной поверхностью (дисперсностью).
Поверхность глинистых частиц представлена группами атомов SiO, SiOH, А1(ОН). Вместо водорода в группе SiOH могут быть обменные катионы. Эти группы вследствие наличия высокоотрицательных атомов кислорода полярны и обладают отрицательным зарядом. На полярной поверхности глинистых частиц в соответствии с правилом Ребиндера будут адсорбироваться полярные молекулы воды с образованием гидратных (сольватных) слоев.
Поверхностную энергию частиц (гидрофильность) можно определить по формуле Полинга (1.20)
![]()
ЭВ - электроотрицательность отрицательнозаряженных атомов, n - число отрицательнозаряженных атомов, ЭА - электроотрицательность положительно-заряженых атомов.
Экспериментальными исследованиями взаимодействия воды с глинистыми частицами занимались известные грунтоведы Н.А. Цытович. Е.М Сергеев и др.
В соответствии с их исследованиями глинистые частицы (обладающие огромной удельной поверхностью) под воздействием молекулярных и электростатических сил активно адсорбируют молекулы воды. Благодаря адсорбционным плёнкам воды осуществляется связь между глинистыми частицами.
У самой поверхности частиц силы притяжения достигают сотен и тысяч мегапаскалей. Молекулы воды, удерживаемые этими силами, образуют плёнку прочносвязанной воды (слой адсорбированной воды).
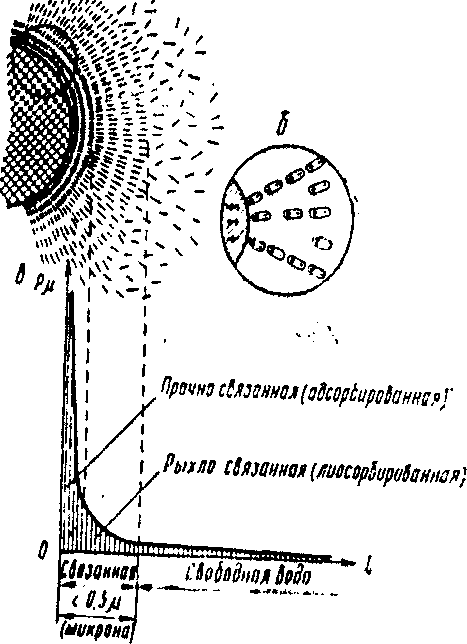
Рис. 2.1 Схема молекулярного взаимодействия сил в системе: твердая частица – вода (по Н. А. Цытовичу):
а - схема строения лиосорбной пленки
воды; б - расположение диполей воды вокруг электрически заряженной частицы; в - эпюра изменений величины молекулярных сил в зависимости от расстояния до поверхности минеральной частицы.
По исследованиям Н.А. Цытовича, толщина слоя может составлять более сотни нанометров (рис.1.4). По словам Б.В. Дерягина, слой прочносвязанной воды обладает высокой плотностью (до - 1500 кг/м3), высокой вязкостью, низкой температурой замерзания воды (около -78°С).
С удалением от поверхности частиц силы притяжения убывают обратно пропорционально расстоянию в седьмой степени:
![]() ,
(2.2)
,
(2.2)
т.е. в адсорбированном слое действуют преимущественно силы межмолекулярного взаимодействия, что соответствует формуле (2.1)
Далее за слоем прочносвязанной воды располагается слой рыхлосвязанной (лиосорбной) воды. Этот слой достигает величины, равной 0,5 мкм (500 нм).
Прочность связей молекул рыхлосвязанной воды меньше и её величина с удалением от частицы убывает значительно медленнее, чем в слое адсорбированной воды. Положение внешней границы, рыхлосвязанной воды зависит, от природы глинистых частиц.
Таким образом, на небольшом удалении от глинистых частиц прочность структуры воды измеряется значительной величиной, что и определяет высокую прочность структуры промывочной жидкости. Толщину плёнки воды в глинистом растворе можно приблизительно рассчитать по формуле
![]() ,
(2.3)
,
(2.3)
где V - объём раствора; S - удельная поверхность глинистых частиц.
Как показано в таблице 2.1, удельная поверхность различных глинистых минералов составляет 500-1000 м2/г. Даже при содержании 1% высококоллоидальной глины (10кг/м3= 10000 г/м3) в растворе толщина плёнки
воды составит:
![]()
При такой толщине плёнки воды уже возможно взаимодействие межмолекулярных сил воды с твёрдыми частицами. При увеличении концентрации глины толщина плёнки еще уменьшится, а прочность межмолекулярных связей возрастет.
Учёными [36] так же установлено, что в глинах наблюдается медленное передвижение плёночной влаги от частиц с большой толщиной плёнок к частицам с малой толщиной до тех пор, пока диполи воды не будут испытывать одинаковое притяжение около всех частиц породы.
При наличии в стационарной промывочной жидкости изометричных дисперсных частиц с равными расстояниями между ними образуются так называемые периодические коллоидные структуры. Если концентрация твёрдой фазы достаточно высока и между всеми частицами расстояния оказываются меньше двух толщин сольватных оболочек (плёночной воды) промывочная жидкость переходит в гидрогель.
В растворах полимеров прочность структуры промывочной жидкости повышается благодаря переплетению макромолекул между собой и образованию пространственных сеток. Причём в результате взаимной ориентации макромолекул между полярными и гидрофобными (углеводородными) звеньями возникают дополнительные достаточно прочные водородные связи. Вокруг гидрофильных (полярных) звеньев образуются также, как и в глинистых растворах, сольватные оболочки, которые заполняют ячейки пространственного каркаса прочно- и рыхлосвязанной водой. При значительной концентрации полимера в стационарной жидкости возникают полимерные гели-студни.
В зависимости от гидрофильности полимера гель может образовываться при различной концентрации. Чем выше гидрофильность полимера, тем при меньшей концентрации образуется гель.
Таким образом, прочность структуры структурированных, жидкостей определяется силой взаимодействия частиц твёрдой фазы между собой и молекулами воды, прочностью структуры самой воды в сольватном слое и зависит от концентрации твёрдой фазы.
В зависимости от концентрации твёрдой фазы растворы принято делить на разбавленные и концентрированные.
Для разбавленных растворов характерно наличие значительных расстояний между частицами, при которых прочность структуры воды обусловлена преимущественно дальнедействующими ион-дипольными связями молекул воды с поверхностью твёрдой фазы.
Для концентрированных растворов расстояния между частицами дисперсной фазы малы, связь между частицами осуществляется преимущественно за счёт межмолекулярного взаимодействия молекул воды с функциональными группами частиц твёрдой фазы.
