
- •Назначение и свойства промывочной жидкости для бурения осложненных зон.
- •Часть 1. Теоретические основы структурирования промывочных жидкостей
- •Структура промывочных жидкостей
- •Гидрофобные (коагуляционные) структуры
- •Толщина диффузионного слоя с увеличением концентрации ионов и их заряда снижается в соответствии с уравнением
- •Гидрофильные структуры
- •1.2.1 Структура воды
- •1.2.2 Поверхностная энергия твердых тел.
- •Поверхностные натяжения твердых тел
- •1.2.3. Взаимодействие воды с поверхностью твердых тел.
- •2. Структура глинистого раствора.
- •2.1 Структурообразователи
- •2.2 Механизм гидрофильного структурообразования глинистых растворов
- •2.3. Объёмная электрическая энергия промывочной жидкости
- •Среднее значение
- •2.4. Приборы для определения прочности структуры промывочных жидкостей
- •3. Структурирование глинистых растворов
- •3.1. Способы структурирования
- •3.2. Структурирование промывочной жидкости за счет повышения концентрации дисперсной фазы
- •3.3. Структурирование буровых растворов путем диспергирования твердой фазы
- •Влияние числа импульсов генератора на свойства растворов
- •3.4. Влияние температуры на прочность структуры глинистых растворов
- •4. Роль электролитов в структурировании промывочных жидкостей.
- •4.1. Общие сведения об электролитах, применяемых при бурении скважин.
- •Зависимость рН растворов солей от их концентрации
- •Теплота растворения электролитов
- •4.2. Электролиты в роли структурообразователя
- •4.3. Активация твердой фазы электролитами.
- •4.4. Дезактивация дисперсной фазы электролитами
- •5. Роль полимеров в структурировании промывочных жидкостей.
- •5.1. Полимеры – структурообразователи.
- •5.1.2. Синтетические структурообразователи
- •5.2. Активность полимеров
- •Расчетные значения энергии поляризации
- •5.3. Другие функции полимеров.
- •5.4. Активация полимеров.
- •5.5. Активация дисперсионной среды полимерных растворов.
- •5.6. Активация твердой фазы полимерами
- •5.7. Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •5.8 Стабильность (седиментационная и агрегативная устойчивость) раствора.
- •5.9 Стабилизация буровых растворов полимерами.
- •Устойчивость реагентов к агрессии солей
- •6. Деструктурирование промывочных жидкостей
- •6.1. Искусственное деструктурирование (разжижение) промывочных жидкостей путем снижения концентрации твердой фазы
- •6.2. Деструктурирование промывочных жидкостей путём активации твёрдой фазы. Понизители вязкости.
- •6.3. Деструктурирование минерализованных промывочных жидкостей
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей
- •7.1.Вязкость ньютоновских жидкостей
- •Силу трения можно выразить формулой
- •Тогда касательное напряжение составит
- •Коэффициент кинематической вязкости будет
- •7.2. Вязкость структурированных жидкостей
- •7.2.1. Анализ существующих теорий
- •7.2.2. Влияние скорости течения, диаметра труб и концентрации твердой фазы на вязкость и коэффициент трения структурированных жидкостей
- •Влияние вязкости полимерного раствора и скорости
- •Зависимость показания раствора от концентрации кельцана
- •7.2.3. Влияние активации и дезактивации твёрдой фазы на коэффициент трения (вязкость) структурированных жидкостей.
- •7.3. Деструктурирование промывочных жидкостей при циркуляции.
- •7.3.1. Влияние длительности циркуляции структурированной жидкости на её вязкость
- •7.3.2. Влияние температуры на вязкость промывочных жидкостей.
- •7.4. Определение вязкости (касательных напряжений) промывочных жидкостей.
- •Значения вязкости различных буровых растворов
- •7.5. Влияние прочности структуры и вязкости промывочных жидкостей на процесс бурения
- •7.6. Тиксотропия промывочных жидкостей
- •Выводы:
- •7.7.Плотность промывочной жидкости.
- •Плотность аэрированной жидкости определяется по формуле
- •Часть II. Стабилизация неустойчивых стенок скважин. Задачами второй части исследований являются:
- •8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость горных пород стенок скважин.
- •9. Промывочные жидкости для бурения уплотненных глин.
- •9.1. Уплотненные глины
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глин.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •10. Промывочные жидкости для бурения неуплотненных глин
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин (общие понятия).
- •10.5. Исследование крепящих свойств полимерполисолевых растворов.
- •10.5.1. Теоретические рассуждения.
- •10.5.2. Экспериментальные исследования.
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород.
- •11.1. Микротрещиноватые глинистые породы. Осложнения при бурении
- •11.2. Влияние технологических параметров бурения на раскрытие трещин
- •11.3. Влияние гидродинамического давления на раскрытие трещин
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для кольматации трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •12.5. Применение пен при бурении трещиноватых пород
- •13. Промывочные жидкости для бурения соленосных отложений
- •13.1. Осложнения при бурении соленосных отложений
- •13.2. Растворение хемогенных горных пород Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.
- •Измерение массы и длины образцов соли при растворении в воде
- •13.3. Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.4. Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
- •Скорость растворения галита в перемешиваемом растворе, м/с10-7 (емкость 10л)
- •Из анализа результатов следует:
- •13.5. Промывочные жидкости, применяемые для бурения соленосных отложений
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •Продолжение таблицы 13.7
- •13.6. Анализ качества применяющихся промывочных жидкостей для бурения соленосных отложений
- •Скорость растворения галита в циркулирующих растворах
- •13.7. Силикатные растворы
- •Состав и свойства сульфатосиликатных и карбонатосиликатных растворов
- •13.8. Лигниноглинистые растворы
- •Заключение
- •Библиографический список
- •3. Структурирование глинистых растворов 42
- •4. Роль электролитов в структурировании промывочных жидкостей. 55
- •5. Роль полимеров в структурировании промывочных жидкостей. 78
- •6. Деструктурирование промывочных жидкостей 116
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей 131
- •9. Промывочные жидкости для бурения 188
- •10. Промывочные жидкости для бурения неуплотненных глин 222
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород. 264
- •12. Промывочные жидкости для бурения трещиноватых горных пород. 279
- •13. Промывочные жидкости для бурения соленосных отложений 304
4.4. Дезактивация дисперсной фазы электролитами
Вследствие того, что межмолекулярные связи частиц твердой фазы увеличиваются с уменьшением их гидрофильности прочность структуры бурового раствора можно повышать путем дезактивации (гидрофобизации) твердой фазы.
Дезактивацию дисперсной фазы производят снижением ее потенциала электролитами или путем гидрофобизации поверхности частиц гидрофобными полимерами или неполярными жидкостями.
Все структурообразователи, применяемые для приготовления буровых растворов, обладают отрицательным зарядом. Поэтому нейтрализацию потенциала частиц проводят катионоактивными электролитами.
Исследованиями [1,2] установлено, что в контакте с частицами твердой фазы в процессе насыщения бурового раствора электролитами образуется двойной электрический слой, состоящий из заряженной поверхности твердой фазы и слоя катионов, нейтрализующих заряд частиц. Снижение потенциала поверхности частиц зависит от заряда катионов (рис. 4.1.). С увеличением заряда интенсивность снижения потенциала с повышением концентрации электролитов растет. Для двухвалентных катионов потенциал частиц может понизится до нуля. Для трехвалентных катионов он даже может изменять знак на обратный [2]. Такое изменение обусловлено специальными процессами, происходящими как во внутренней, так и во внешней обкладке ДЭС. В одних случаях это вызывается разностью потенциалов в двух фазах, в других – специфической (сверхэквивалентной) адсорбцией противоионов во внешней обкладке ДЭС под воздействием межмолекулярных сил.
Исследования электролитических явлений в этих системах показывают, что частицы кварца с отрицательно заряженной поверхностью при критической концентрации AlCl3 начинают перемещаться к отрицательному электроду. Роль внутренней обкладки в этом случае выполняет адсорбированный слой ионов Al3+.
Академик Гедройц (известный исследователь грунтов) в своих фундаментальных трудах [2] установил, что по адсорбционной способности (способности вытеснять противоионы с поверхности частиц грунтов силанольного типа ≡ SiO3 на границе с почвенным раствором) катионы можно распределять в следующем порядке:
![]() ,
,
т.е. адсорбционная способность катионов увеличивается с возрастанием их заряда и уменьшением их ионного радиуса.
Вследствии незначительного ионного радиуса (протона), ионы водорода со слабокислотными кремниевыми радикалами образуют прочные (водородные) связи и поэтому способны вытеснять все вышеприведенные катионы. Высокую адсорбционную способность ионы водорода имеют и по отношению к высокомолекулярным ионитам (полимерам) со слабо кислотными радикалами. Для ионитов сильнокислотного типа ионы Н+ имеют слабую связь и поэтому занимают место в конце ряда (после Li).
При адсорбировании катионов на поверхности твердой фазы, как отмечено, ее потенциал нейтрализуется, вследствие чего сила взаимодействия молекул воды с адсорбированным слоем понижается, понижается и толщина гидратного слоя. При снижении толщины сольватного слоя до некоторого значения увеличивается и его прочность, что повышает и прочность бурового раствора в целом. При дальнейшем повышении концентрации катионов в растворе и снижении толщины гидратного слоя до критического значения частицы начнут слипаться (коагулировать), а после полной нейтрализации частиц – агрегатировать и седиментировать.
Снижение толщины гидратного слоя частиц твердой фазы усугубляется дефицитом молекул воды, расходуемых на сольватацию ионов соли.
При снижении толщины гидратного слоя твердой фазы увеличивается и кулоновское взаимодействие твёрдой фазы с катионами. Особенно интенсивно это взаимодействие наблюдается при наличии в растворе поливалентных катионов (рис. 4.2, 4.3), которые способны "сшивать" частицы при значительно меньших концентрациях, чем одновалентных катионов.
Процесс “сшивания” частиц (флокуляции) не сразу заканчивается их агрегатированием и седиментацией, и при флокуляции частиц возможны высокие значения СНС и вязкости раствора, поэтому момент перехода от структурирования к агрегатированию по показателям СНС и вязкости не всегда удаётся определить. Но в процессе их активной агрегации и коагуляции резко снижается количество связанной воды и поэтому водоотдача бурового раствора сильно возрастает.
Р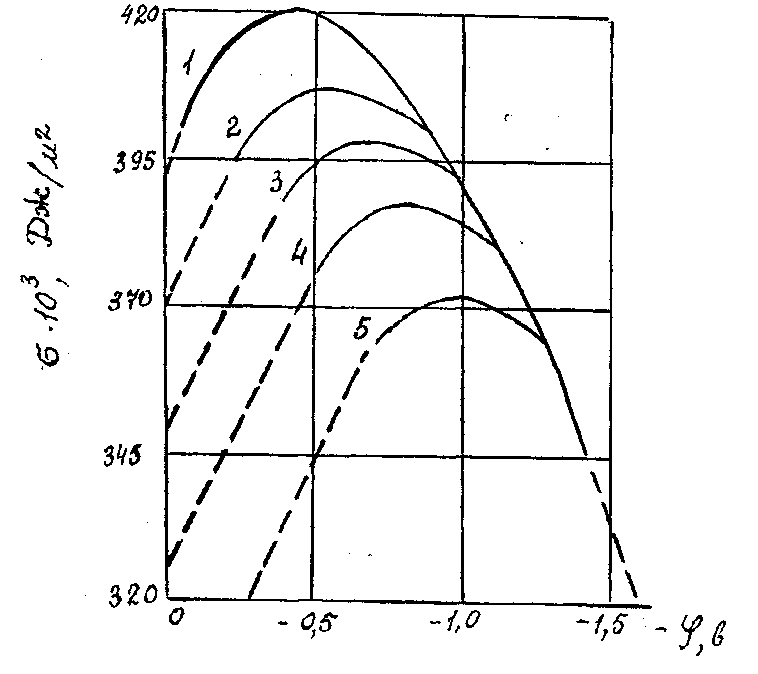 езкое
повышение водоотдачи промывочной
жидкости при структурировании его
электролитами и будет сигнализировать
о коагуляции твёрдой фазы.
езкое
повышение водоотдачи промывочной
жидкости при структурировании его
электролитами и будет сигнализировать
о коагуляции твёрдой фазы.
Рис.4.3. Зависимость поверхностного натяжения растворов электролитов от разности потенциалов на электродах. 1 – раствор КОН; 2 – раствор KCl; 3 – раствор KBr; 4 – раствор KI; 5 – растворK2S.
При обработке буровых растворов электролитами таким образом возможны четыре случая.
1. При невысокой концентрации щелочных электролитов за счёт активации частиц и их пептизации:
а) прочность структуры понижается;
б) водоотдача понижается.
2. При частичной нейтрализации твёрдой фазы нещелочными электролитами (в области структурирования):
а) прочность структуры растёт;
б) водоотдача повышается.
3. При флокуляции буровых растворов (в области структурирования):
а) прочность структуры растёт;
б) водоотдача остаётся постоянной.
4. При полной коагуляции буровых растворов (агрегатировании) и седиментации агрегатов:
а) прочность структуры снижается;
б) водоотдача растёт.
Рассмотрим несколько примеров.
Пример 1. Щелочной электролит, введенный в глинистый раствор (см. раздел 4.3). На рис 4.2. показан график зависимости СНС, вязкости и водоотдачи глинистого раствора от концентрации кальцинированной соды. Из графика видно, что при небольшой концентрации соды Na2CO3 под воздействием гидроксильной группы щелочи происходит пептизация и активация глинистых частиц, что ведет к увеличению толщины и уменьшению прочности гидратного слоя, а значит, к уменьшению показателей СНС и водоотдачи.
При увеличении концентрации электролита наблюдается частичная нейтрализация поверхностного потенциала глинистых частиц, толщина гидратного слоя понижается, увеличивается его прочность и взаимодействие частиц (СНС растёт). В растворе появляются флоккулы. Вследствие нейтрализации (гидрофобизации) поверхности частиц водоотдача увеличивается. При дальнейшем повышении концентрации соды прочность гидратной плёнки и взаимодействие глинистых частиц с ионами Na+ увеличивается настолько, что начинается процесс агрегатирования. Прочность структуры и вязкость раствора понижаются, а водоотдача возрастает. При введении нещелочного одновалентного катионоактивного электролита (например NaС1) активации твёрдой фазы не наблюдается, но чётко прослеживается область структурирования и агрегатирования.
Пример 2. Нещелочной электролит трёхвалентного металла, введённый в глинистый раствор. На рис. 4.4 показана зависимость прочности структуры 2,7% -й суспензии натриевого бентонита от концентрации соли трёхвалентного, металла AlCl3. Здесь дезактивация глинистых частиц (снижение потенциала и повышение прочности структуры) наблюдается уже при концентрации соли равной 0,13%, а при концентрации равной 0,55% наблюдается смена знака электрокинетического потенциала на обратный.
Обращает на себя внимание то, что при малой концентрации (от 0 до 0,027%) темп повышения прочности структуры невысок. Это объясняется тем, что при небольшой концентрации соли в растворе происходит интенсивное взаимодействие ионов А13+ с водой: 2А13+ + ЗН2О = 2Al(ОН)3 + 3Н+
Соединение Al(ОН)3 малоактивно, слабо понижает поверхностный потенциал глинистых частиц. С увеличением концентрации раствора повышается кислотность среды (понижается рН), взаимодействие иона Al3+ с водой понижается, в растворе появляются более активные соединения (ионы Al(ОН)2+ и Al(ОН)2+).
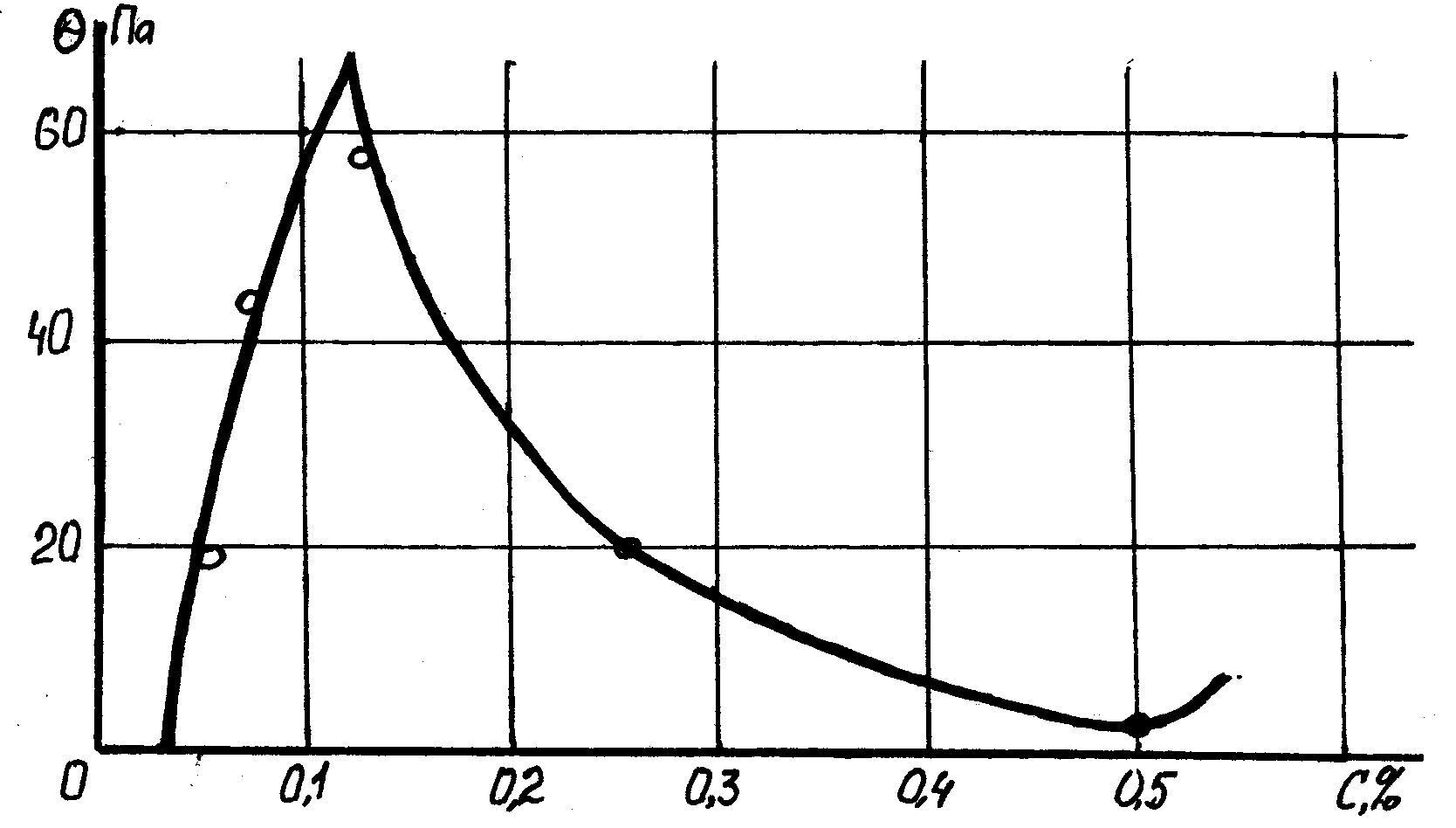
Рис.4.4. Зависимость прочности структуры 2,7% суспензии натриевого бентонита от концентрации соли трехвалентного металла AlCl3
Р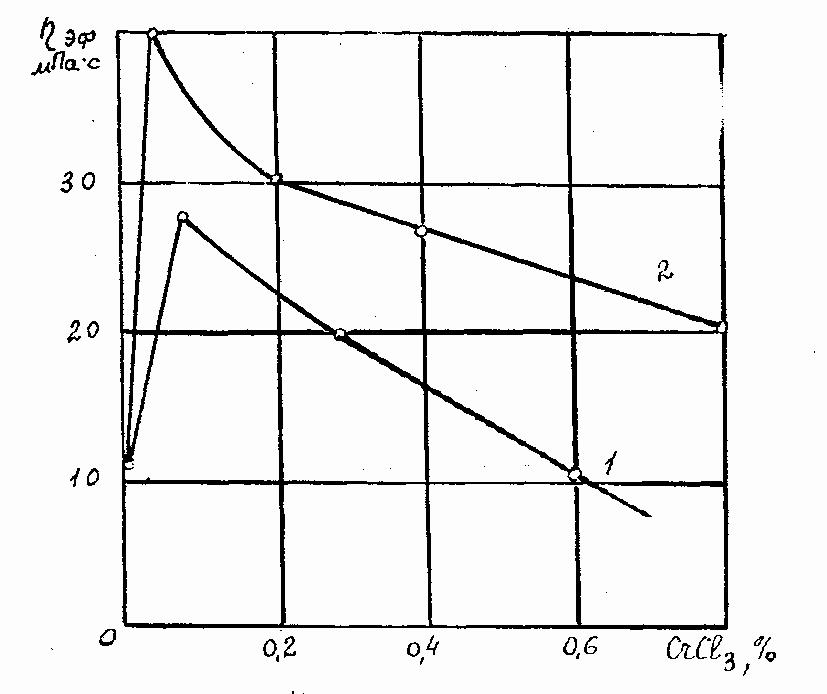 ис.4.5.
Зависимость эффективной вязкости
раствора биополимера от концентрации
CrCl3:
1 – 0.3% биополимера ; 2 – 0,4% биополимера.
ис.4.5.
Зависимость эффективной вязкости
раствора биополимера от концентрации
CrCl3:
1 – 0.3% биополимера ; 2 – 0,4% биополимера.

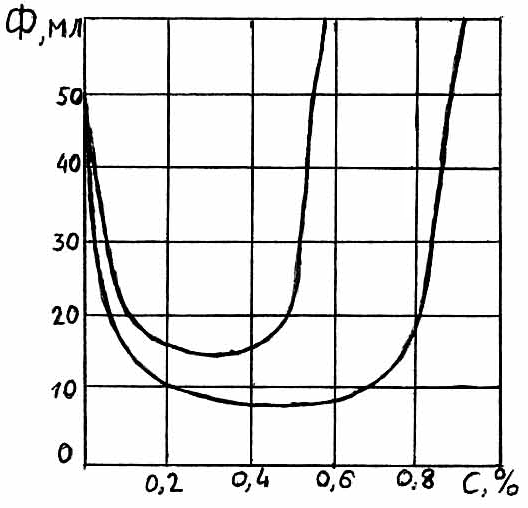
рис.4.6. Зависимость показателя фильтрации рис.4.7. Зависимость вязкости растворов
раствора биополимера от содержания CrCl3: полимеров от концентрации поваренной
1 – биополимер 0,5%; 2 – биополимер 0,4%. Соли. 1 – КМЦ-600; 2 – метас.
В кислой среде при рН = 2 - 4 (по исследованиям учёных [17] появляются весьма активные ионы трёхвалентного металла А13+.
Пример 3. Электролит трёхвалентного металла, введённый в полимерный раствор.
На рис.4.5 показана зависимость эффективной вязкости раствора биополимера от концентрации СrС1з [17].
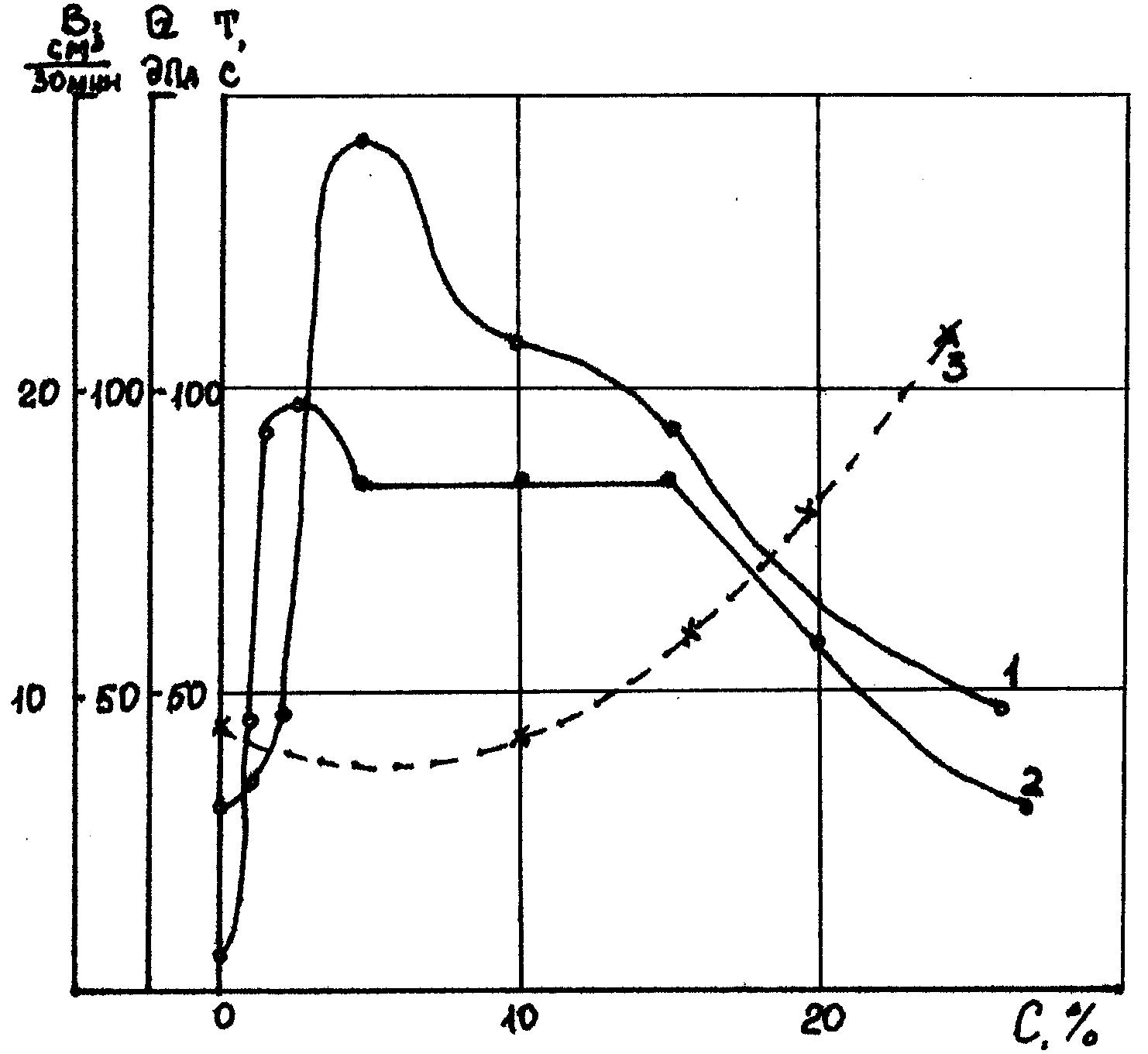

Рис.4.8. Зависимость свойств полимербенто- Рис4.9 Зависимость свойств полимербенто
нитового раствора (4% бентонита и 0,25% нитового раствора (4% бентонита и 0,25%
метаса) от концентрации NaCl: 1–условная метаса)от концентрации CаС12 1-условная
вязкость, с; 2 – статическое напряжение вязкость, с; 2 – статическое напряжение
сдвигу, дПа; 3 – водоотдача, см3/30 мин. сдвигу, дПа; 3 – водоотдача, см3/30 мин.
Повышение вязкости раствора в этом случае связано, судя по снижению водоотдачи (рис. 4.6), не со снижением поверхностного потенциала, как это мы наблюдали на примере глинистых растворов, а, видимо, за счёт полимеризации биополимера.
При повышении концентрации выше 0,1% СгСl3, происходит агрегация (сшивание) биополимера.
Одновалентные катионы не способствуют полимеризации, поэтому при повышении концентрации катионо-активных электролитов одновалентных металлов наблюдается только нейтрализация заряда функциональных групп к снижение вязкости раствора (рис. 4.7). При этом показатель фильтрации изменяется мало или даже понижается, так как на фильтровальной бумаге адсорбируется менее гидрофильный слой полимеров.
Пример 4. Нещелочной электролит, введённый в полимерглинистый раствор.
На рис. 4.8. и 4.9 [17] показаны зависимости прочности структуры, вязкости и водоотдачи полимербентонитового раствора(4%-го бентонита и 0,25%-го метаса) от концентрации электролитов NaCl и CaCl.
Области активации твердой фазы на графиках отсутствуют. При малой концентрации электролитов (до 0,02%) наблюдается частичная нейтрализация потенциала частиц. Прочность структуры раствора резко возрастает, водоотдача увеличивается. При повышении концентрации электролита (хлористого натрия до 0,2 - 0,3%. хлористого кальция до 0,1 %) наблюдается флокуляция раствора. Прочность структуры растет, водоотдача стабилизируется. Причем для электролита с двухвалентными катионами прочность структуры при флокуляции растет более интенсивно, чем для электролитов с одновалентными катионами (эффект «сшивания»). При дальнейшем повышении концентрации электролитов происходит агрегатирование глинистых частиц, прочность структуры понижается, водоотдача растет.
