
- •Назначение и свойства промывочной жидкости для бурения осложненных зон.
- •Часть 1. Теоретические основы структурирования промывочных жидкостей
- •Структура промывочных жидкостей
- •Гидрофобные (коагуляционные) структуры
- •Толщина диффузионного слоя с увеличением концентрации ионов и их заряда снижается в соответствии с уравнением
- •Гидрофильные структуры
- •1.2.1 Структура воды
- •1.2.2 Поверхностная энергия твердых тел.
- •Поверхностные натяжения твердых тел
- •1.2.3. Взаимодействие воды с поверхностью твердых тел.
- •2. Структура глинистого раствора.
- •2.1 Структурообразователи
- •2.2 Механизм гидрофильного структурообразования глинистых растворов
- •2.3. Объёмная электрическая энергия промывочной жидкости
- •Среднее значение
- •2.4. Приборы для определения прочности структуры промывочных жидкостей
- •3. Структурирование глинистых растворов
- •3.1. Способы структурирования
- •3.2. Структурирование промывочной жидкости за счет повышения концентрации дисперсной фазы
- •3.3. Структурирование буровых растворов путем диспергирования твердой фазы
- •Влияние числа импульсов генератора на свойства растворов
- •3.4. Влияние температуры на прочность структуры глинистых растворов
- •4. Роль электролитов в структурировании промывочных жидкостей.
- •4.1. Общие сведения об электролитах, применяемых при бурении скважин.
- •Зависимость рН растворов солей от их концентрации
- •Теплота растворения электролитов
- •4.2. Электролиты в роли структурообразователя
- •4.3. Активация твердой фазы электролитами.
- •4.4. Дезактивация дисперсной фазы электролитами
- •5. Роль полимеров в структурировании промывочных жидкостей.
- •5.1. Полимеры – структурообразователи.
- •5.1.2. Синтетические структурообразователи
- •5.2. Активность полимеров
- •Расчетные значения энергии поляризации
- •5.3. Другие функции полимеров.
- •5.4. Активация полимеров.
- •5.5. Активация дисперсионной среды полимерных растворов.
- •5.6. Активация твердой фазы полимерами
- •5.7. Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •5.8 Стабильность (седиментационная и агрегативная устойчивость) раствора.
- •5.9 Стабилизация буровых растворов полимерами.
- •Устойчивость реагентов к агрессии солей
- •6. Деструктурирование промывочных жидкостей
- •6.1. Искусственное деструктурирование (разжижение) промывочных жидкостей путем снижения концентрации твердой фазы
- •6.2. Деструктурирование промывочных жидкостей путём активации твёрдой фазы. Понизители вязкости.
- •6.3. Деструктурирование минерализованных промывочных жидкостей
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей
- •7.1.Вязкость ньютоновских жидкостей
- •Силу трения можно выразить формулой
- •Тогда касательное напряжение составит
- •Коэффициент кинематической вязкости будет
- •7.2. Вязкость структурированных жидкостей
- •7.2.1. Анализ существующих теорий
- •7.2.2. Влияние скорости течения, диаметра труб и концентрации твердой фазы на вязкость и коэффициент трения структурированных жидкостей
- •Влияние вязкости полимерного раствора и скорости
- •Зависимость показания раствора от концентрации кельцана
- •7.2.3. Влияние активации и дезактивации твёрдой фазы на коэффициент трения (вязкость) структурированных жидкостей.
- •7.3. Деструктурирование промывочных жидкостей при циркуляции.
- •7.3.1. Влияние длительности циркуляции структурированной жидкости на её вязкость
- •7.3.2. Влияние температуры на вязкость промывочных жидкостей.
- •7.4. Определение вязкости (касательных напряжений) промывочных жидкостей.
- •Значения вязкости различных буровых растворов
- •7.5. Влияние прочности структуры и вязкости промывочных жидкостей на процесс бурения
- •7.6. Тиксотропия промывочных жидкостей
- •Выводы:
- •7.7.Плотность промывочной жидкости.
- •Плотность аэрированной жидкости определяется по формуле
- •Часть II. Стабилизация неустойчивых стенок скважин. Задачами второй части исследований являются:
- •8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость горных пород стенок скважин.
- •9. Промывочные жидкости для бурения уплотненных глин.
- •9.1. Уплотненные глины
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глин.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •10. Промывочные жидкости для бурения неуплотненных глин
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин (общие понятия).
- •10.5. Исследование крепящих свойств полимерполисолевых растворов.
- •10.5.1. Теоретические рассуждения.
- •10.5.2. Экспериментальные исследования.
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород.
- •11.1. Микротрещиноватые глинистые породы. Осложнения при бурении
- •11.2. Влияние технологических параметров бурения на раскрытие трещин
- •11.3. Влияние гидродинамического давления на раскрытие трещин
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для кольматации трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •12.5. Применение пен при бурении трещиноватых пород
- •13. Промывочные жидкости для бурения соленосных отложений
- •13.1. Осложнения при бурении соленосных отложений
- •13.2. Растворение хемогенных горных пород Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.
- •Измерение массы и длины образцов соли при растворении в воде
- •13.3. Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.4. Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
- •Скорость растворения галита в перемешиваемом растворе, м/с10-7 (емкость 10л)
- •Из анализа результатов следует:
- •13.5. Промывочные жидкости, применяемые для бурения соленосных отложений
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •Продолжение таблицы 13.7
- •13.6. Анализ качества применяющихся промывочных жидкостей для бурения соленосных отложений
- •Скорость растворения галита в циркулирующих растворах
- •13.7. Силикатные растворы
- •Состав и свойства сульфатосиликатных и карбонатосиликатных растворов
- •13.8. Лигниноглинистые растворы
- •Заключение
- •Библиографический список
- •3. Структурирование глинистых растворов 42
- •4. Роль электролитов в структурировании промывочных жидкостей. 55
- •5. Роль полимеров в структурировании промывочных жидкостей. 78
- •6. Деструктурирование промывочных жидкостей 116
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей 131
- •9. Промывочные жидкости для бурения 188
- •10. Промывочные жидкости для бурения неуплотненных глин 222
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород. 264
- •12. Промывочные жидкости для бурения трещиноватых горных пород. 279
- •13. Промывочные жидкости для бурения соленосных отложений 304
10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
В отличии от уплотненной глины в неуплотненной глине поры имеют значительные размеры, в которые способны вместе с водой проникать как гидратированные ионы так и макромолекулы полимеров. В зависимости от вида электролитов результаты взаимодействия проникших в поры глины ионов могут быть различными. Как отмечено выше, все электролиты можно разделить на три группы: щелочные, кислотные и нейтральные.
При взаимодействии щелочных электролитов (невысокой концентрации) с глинистыми частицами происходит активация последних (смотри часть 1,
п 4.3)
SiOH+NaOH![]()
SiO-
+H2O+Na+,
SiO-
+H2O+Na+,
в результате чего объемная энергия глины возрастает, увеличивается «всасывание» воды, повышается влажность, понижается пластическая прочность глины.
С увеличением концентрации щелочи количество катионов в растворе возрастает , увеличивается плотность эффузивного слоя и при
некоторой критической концентрации электролита происходит постепенная дезактивация глинистых частиц, в результате чего толщина гидратного слоя воды вокруг частиц понижается, понижается влажность глины, повышается ее пластическая прочность глины.
Степень гидратации и дегидратации для различных щелочных электролитов при повышении их концентрации различна. Она зависит от гидрофильности катионов, силы взаимодействия их с анионами раствора и растворимости электролитов.
На рис. 10.1. показан график зависимости гидратации и дегидратации образцов неуплотненной глины, помещенных в растворы различных щелочных электролитов (этот и последующие графики построены по экспериментальным материалам В.Д. Городнова)
Р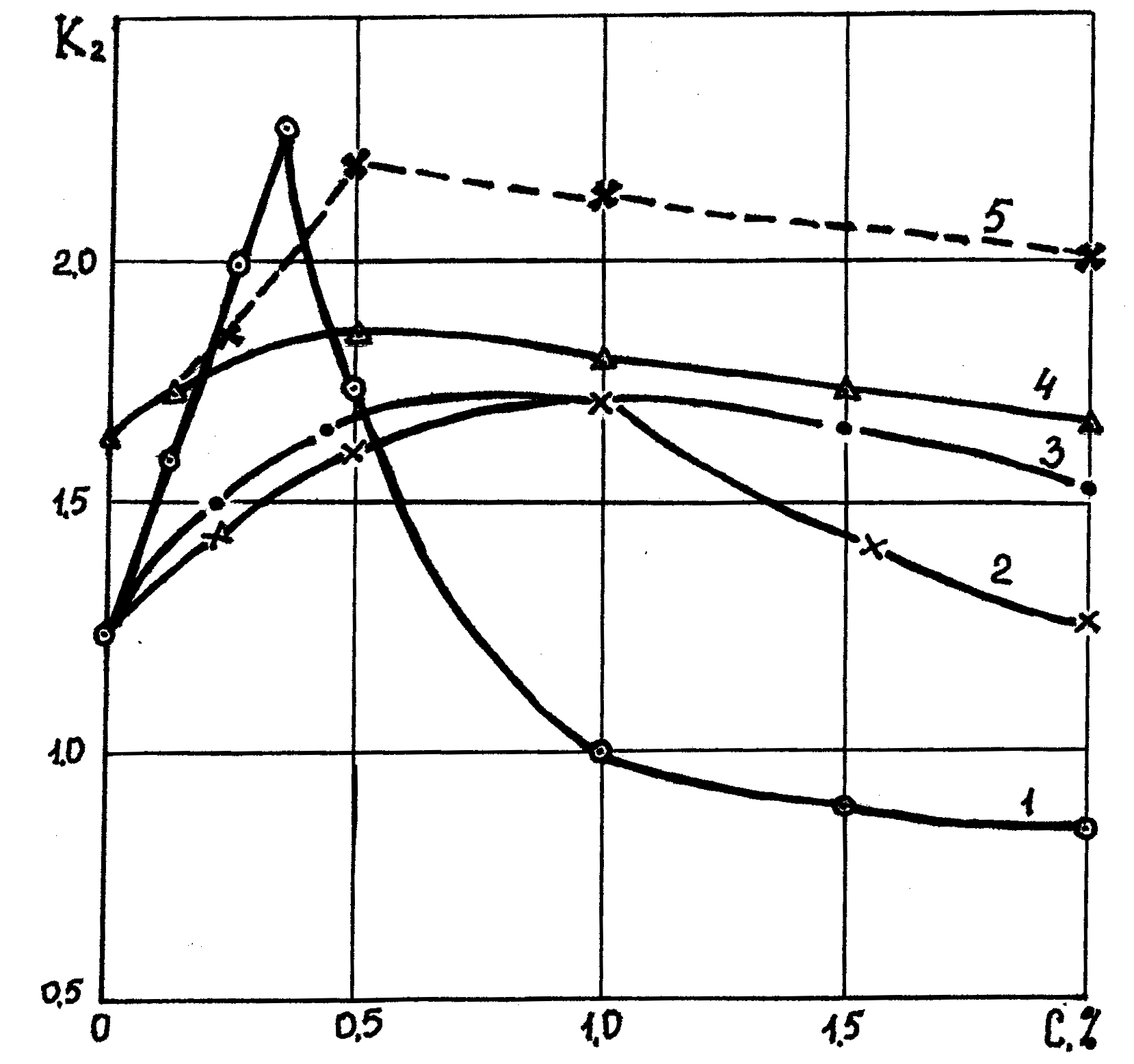 ис.10.1.
Зависимость влажности глинистых образцов
К2
помещенных в раствор щелочных электролитов
от концентрации последних: 1- в раствор
NaOH, 2 - в раствор Na2SiО3,
3 - раствор Na2СО3,
4 - в раствор Na3РO4.
5 -в раствор Ва(ОН)
ис.10.1.
Зависимость влажности глинистых образцов
К2
помещенных в раствор щелочных электролитов
от концентрации последних: 1- в раствор
NaOH, 2 - в раствор Na2SiО3,
3 - раствор Na2СО3,
4 - в раствор Na3РO4.
5 -в раствор Ва(ОН)
Наиболее активно гидратация протекает при введении в раствор щелочей NaOH, КОН, Ва(ОН)2, менее активно (вследствие меньшей концентрации гидроксильных групп в растворе) для щелочных солей и совсем неактивно для слаборастворимых оснований Са(ОН)2.
Активность дегидратации зависит от плотности и активности катионов в диффузном слое вокруг глинистых частиц, концентрации и активности анионов электролитов. В растворах щелочных солей при гидролизе образуется значительное количество достаточно активных анионов НРО42-, Н2РО4-, НСО3- и т.д., снижающих активность катионов.
В растворах хорошо растворимых щелочей (например, растворах NaOH с растворимостью 108 г. на 100мл. воды) после гидратации частиц концентрация катионов быстро возрастает, дегидратация глинистых частиц протекает интенсивно.
В растворах менее растворимых щелочей Ba(OH)2 (с растворимостью 39 грамм на 100 мл. воды), количество катионов в растворе значительно меньше. Да и катионы более гидрофильны и менее подвижны. Поэтому несмотря на большую валентность катионов нейтрализация глинистых частиц происходит слабее, область дегидратации значительно растягивается.
При взаимодействии нещелочных электролитов с глинистыми частицами гидратация частиц не возможна, даже при малой концентрации электролита в результате нейтрализации потенциала глинистых частиц наблюдается их дегидратация.
Активность взаимодействия катионов с глинистыми частицами в соответствии с исследованиями К.К. Гедройца (см. часть 1, п 4.4.) зависит от их валентности и ионного радиуса. Для почв, грунтов (в том числе и глинистых) вследствие малого ионного радиуса наибольшую активность проявляет ион водорода Н+, а наиболее сильным нещелочным электролитом являются кислоты активно нейтрализующие потенциал частиц, интенсивно понижающие влажность глины.
Как показывают экспериментальные исследования с помощью кислот можно понизить влажность глины до 30%, чего вследствие гидрофильности других катионов достичь невозможно. На рис.10.2. показана зависимость влажности глинистых образцов в растворе соляной кислоты от ее концентрации. В противоположность действию на глинистые частицы щелочных электролитов вместо гидратации мы наблюдаем дегидратацию частиц.
За счет нейтрализации заряда глинистых частиц при концентрации кислоты до 0,3% влажность глины понижается (до 30%), а при дальнейшем повышении концентрации в растворе появляется избыток анионов Cl+ (так как часть катионов адсорбируется глинистыми частицами), который образует
второй слой ДЭС глинистых частиц. Происходит их постепенная активация и гидратация до нормальной влажности глины.

Рис.10.2. Зависимость влажности глинистых образцов в растворе соляной кислоты от ее концентрации
Растворы нейтральных электролитов при малых концентрациях не вызывают экстремальных значений повышения или понижения влажности глины. Начиная с нулевой концентрации они с увеличением концентрации плавно понижают влажность глины до некоторого предела характерного для данного раствора. Вследствие гидрофильности катионов понизить влажность глины до нуля невозможно. Интенсивность понижения влажности глины зависит от заряда, гидрофильности или глинофильности катионов, активности анионов электролита. Темп снижения влажности глины с увеличением концентрации электролитов зависит и от степени их диссоциации. При малой концентрации в соответствии с законом Оствальда степень диссоциации электролита более высокая, поэтому темп снижения влажности глины выше чем при более высокой концентрации электролита.
Из рисунка 10.3. видно, что интенсивность снижения влажности в растворе более гидрофильного электролита NaCl (1) значительно меньше, чем в растворе менее гидрофильного электролита КС1 (2), и совсем низкая интенсивность снижения влажности для электролитов с весьма активными анионами
Na2SO4 (3)
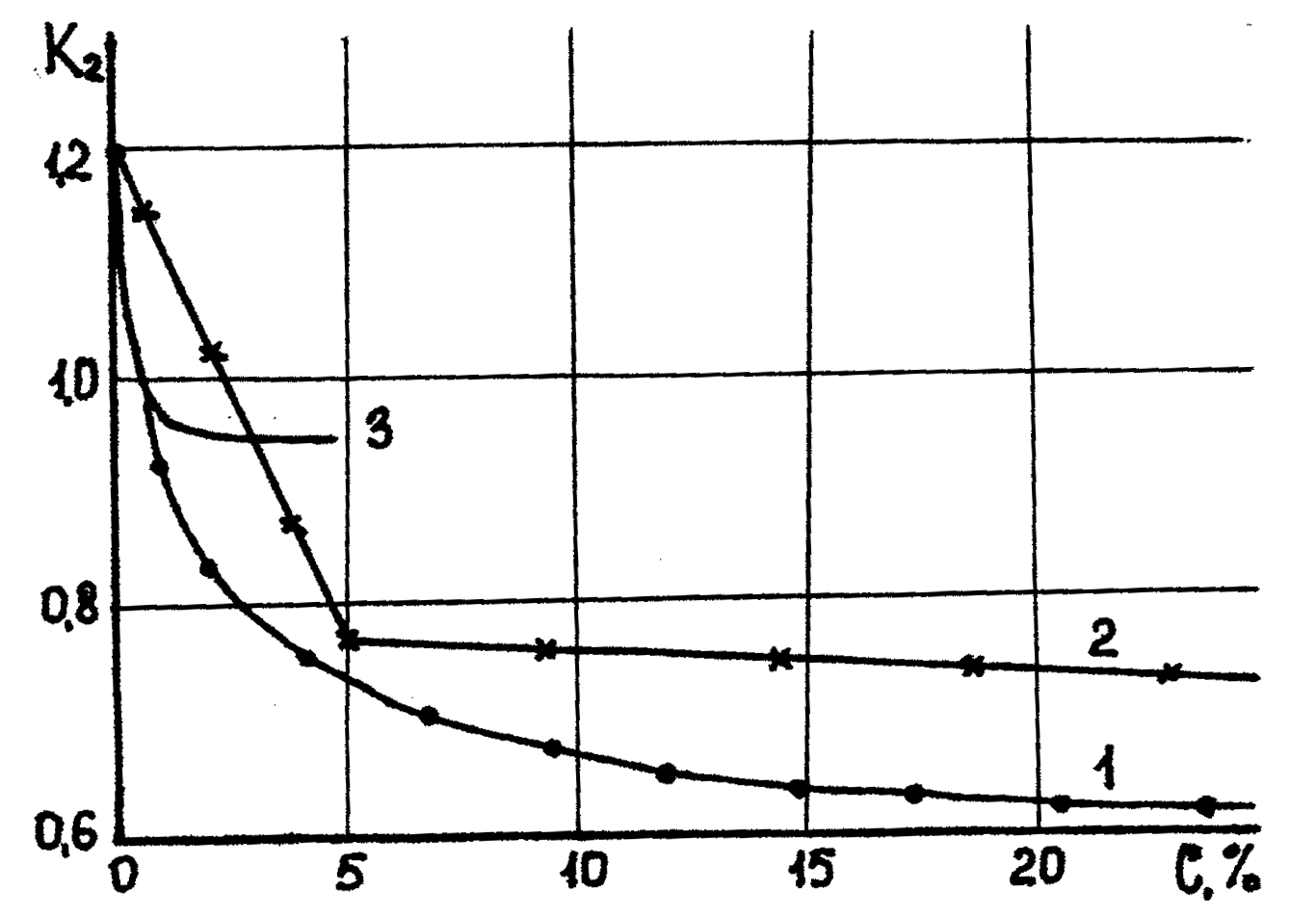
Рис. 10.3. Зависимость влажности глинистых образцов в растворе электролитов солей одновалентных металлов от концентрации последних: 1 – CaCl2; 2 – СaSO4; 3 – BaCl2; 4 - KАlSO4

Рис. 10.4. Зависимость влажности глинистых образцов в растворе нещелочных электролитов поливалентных металлов от концентрации последних: 1-CaCl2; 2-СаSО4; 3-ВаСl2; 4-КАlSO4.
То же самое можно наблюдать и для электролитов с поливалентными катионами (рис.10.4).
Прочность глинистых пород находится в прямой зависимости от их влажности. Глинистые частицы, как отмечено, связаны между собой пленками воды. Прочность же пленок зависит от энергии межмолекулярного взаимодействия (U) каждой молекулы воды с глинистыми частицами.
Глинистые частицы породы находятся на относительно небольшом расстоянии друг от друга, и каждая молекула воды взаимодействует одновременно не с одной (как в буровом растворе), а с целым рядом близлежащих глинистых частиц. Энергию взаимодействия молекул воды с этими частицами можно определить суммированием энергий взаимодействий молекулы воды с каждой частицей в отдельности, например, с помощью интегрирования.
Приближенный расчет в предположении аддитивности (суммирования) энергии межмолекулярных взаимодействий как отмечено выше был проведен Буром и Гамакером [6, 9].
Для вывода уравнения энергии межмолекулярного притяжения использовалось уравнение энергии притяжения одной молекулы к поверхности адсорбента (в данном случае глинистых частиц):
![]() (10.1)
(10.1)
где С - константа, зависящая от природы взаимодействующих молекул, n - число частиц; h - расстояние от молекулы воды до глинистых частиц (толщина пленки воды).
В результате после интегрирования Бур и Гамакер получили формулу
![]() , (10.2)
, (10.2)
где А-константа Гамакера, равная примерно 10-19 Дж.
Удельная сила взаимодействия молекул воды с поверхностью глинистых частиц (прочность пленки) соответственно будет равной
![]() , (10.3)
, (10.3)
где Со - постоянная величина.
С увеличением влажности глины толщина пленки увеличивается, а ее прочность и прочность глины в целом понижаются
Влажность глины можно выразить формулой
![]() ,
(10.4)
,
(10.4)
где Vв - количество воды, поглощенной глиной; S - суммарная поверхность глинистых частиц, m – количество частиц, h – толщина пленки воды. Отсюда
![]() ,
(10.5)
,
(10.5)
Подставляя значения h в формулу (10,3). получим
![]() , (10.6)
, (10.6)
т.е. прочность глины обратно пропорциональна ее влажности в кубе.
Отношение прочностей образца глины различной влажности можно записать в виде
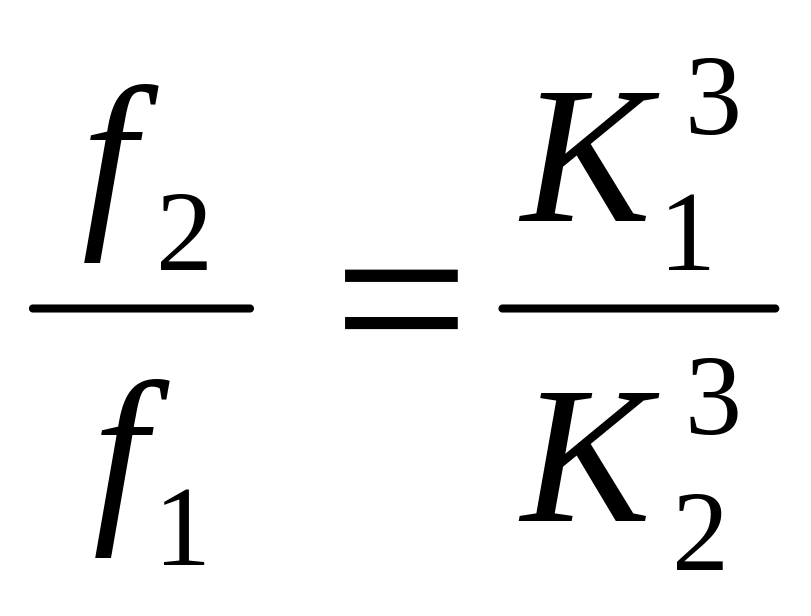 , (10.7)
, (10.7)
а прочность образца любой влажности fi
![]() ,
(10.8)
,
(10.8)
где f - начальная прочность образца глины; К - начальная влажность образца, Кi влажность насыщенного водой образца.
Экспериментальные данные подтверждают полученные расчеты (табл.10.1).
Прочность «сухих» уплотненных пород с весьма тонкими водными пленками (h) во многих случаях не уступает прочности других осадочных пород: известняков, песчаников. С увеличением толщины гидратной пленки межмолекулярное взаимодействие между частицами резко понижается, понижается и пластическая прочность глины (рис.10.5). Прочность гидратной пленки с уменьшением толщины быстро возрастает. У самой поверхности частицы сила взаимодействия молекул воды достигает тысяч кг/см2 (см. часть 1, 3.3). С удалением от частицы эти силы снижаются обратно пропорционально расстоянию в седьмой степени.
Таблица 10.1
