
- •Назначение и свойства промывочной жидкости для бурения осложненных зон.
- •Часть 1. Теоретические основы структурирования промывочных жидкостей
- •Структура промывочных жидкостей
- •Гидрофобные (коагуляционные) структуры
- •Толщина диффузионного слоя с увеличением концентрации ионов и их заряда снижается в соответствии с уравнением
- •Гидрофильные структуры
- •1.2.1 Структура воды
- •1.2.2 Поверхностная энергия твердых тел.
- •Поверхностные натяжения твердых тел
- •1.2.3. Взаимодействие воды с поверхностью твердых тел.
- •2. Структура глинистого раствора.
- •2.1 Структурообразователи
- •2.2 Механизм гидрофильного структурообразования глинистых растворов
- •2.3. Объёмная электрическая энергия промывочной жидкости
- •Среднее значение
- •2.4. Приборы для определения прочности структуры промывочных жидкостей
- •3. Структурирование глинистых растворов
- •3.1. Способы структурирования
- •3.2. Структурирование промывочной жидкости за счет повышения концентрации дисперсной фазы
- •3.3. Структурирование буровых растворов путем диспергирования твердой фазы
- •Влияние числа импульсов генератора на свойства растворов
- •3.4. Влияние температуры на прочность структуры глинистых растворов
- •4. Роль электролитов в структурировании промывочных жидкостей.
- •4.1. Общие сведения об электролитах, применяемых при бурении скважин.
- •Зависимость рН растворов солей от их концентрации
- •Теплота растворения электролитов
- •4.2. Электролиты в роли структурообразователя
- •4.3. Активация твердой фазы электролитами.
- •4.4. Дезактивация дисперсной фазы электролитами
- •5. Роль полимеров в структурировании промывочных жидкостей.
- •5.1. Полимеры – структурообразователи.
- •5.1.2. Синтетические структурообразователи
- •5.2. Активность полимеров
- •Расчетные значения энергии поляризации
- •5.3. Другие функции полимеров.
- •5.4. Активация полимеров.
- •5.5. Активация дисперсионной среды полимерных растворов.
- •5.6. Активация твердой фазы полимерами
- •5.7. Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •5.8 Стабильность (седиментационная и агрегативная устойчивость) раствора.
- •5.9 Стабилизация буровых растворов полимерами.
- •Устойчивость реагентов к агрессии солей
- •6. Деструктурирование промывочных жидкостей
- •6.1. Искусственное деструктурирование (разжижение) промывочных жидкостей путем снижения концентрации твердой фазы
- •6.2. Деструктурирование промывочных жидкостей путём активации твёрдой фазы. Понизители вязкости.
- •6.3. Деструктурирование минерализованных промывочных жидкостей
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей
- •7.1.Вязкость ньютоновских жидкостей
- •Силу трения можно выразить формулой
- •Тогда касательное напряжение составит
- •Коэффициент кинематической вязкости будет
- •7.2. Вязкость структурированных жидкостей
- •7.2.1. Анализ существующих теорий
- •7.2.2. Влияние скорости течения, диаметра труб и концентрации твердой фазы на вязкость и коэффициент трения структурированных жидкостей
- •Влияние вязкости полимерного раствора и скорости
- •Зависимость показания раствора от концентрации кельцана
- •7.2.3. Влияние активации и дезактивации твёрдой фазы на коэффициент трения (вязкость) структурированных жидкостей.
- •7.3. Деструктурирование промывочных жидкостей при циркуляции.
- •7.3.1. Влияние длительности циркуляции структурированной жидкости на её вязкость
- •7.3.2. Влияние температуры на вязкость промывочных жидкостей.
- •7.4. Определение вязкости (касательных напряжений) промывочных жидкостей.
- •Значения вязкости различных буровых растворов
- •7.5. Влияние прочности структуры и вязкости промывочных жидкостей на процесс бурения
- •7.6. Тиксотропия промывочных жидкостей
- •Выводы:
- •7.7.Плотность промывочной жидкости.
- •Плотность аэрированной жидкости определяется по формуле
- •Часть II. Стабилизация неустойчивых стенок скважин. Задачами второй части исследований являются:
- •8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость горных пород стенок скважин.
- •9. Промывочные жидкости для бурения уплотненных глин.
- •9.1. Уплотненные глины
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глин.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •10. Промывочные жидкости для бурения неуплотненных глин
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин (общие понятия).
- •10.5. Исследование крепящих свойств полимерполисолевых растворов.
- •10.5.1. Теоретические рассуждения.
- •10.5.2. Экспериментальные исследования.
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород.
- •11.1. Микротрещиноватые глинистые породы. Осложнения при бурении
- •11.2. Влияние технологических параметров бурения на раскрытие трещин
- •11.3. Влияние гидродинамического давления на раскрытие трещин
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для кольматации трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •12.5. Применение пен при бурении трещиноватых пород
- •13. Промывочные жидкости для бурения соленосных отложений
- •13.1. Осложнения при бурении соленосных отложений
- •13.2. Растворение хемогенных горных пород Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.
- •Измерение массы и длины образцов соли при растворении в воде
- •13.3. Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.4. Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
- •Скорость растворения галита в перемешиваемом растворе, м/с10-7 (емкость 10л)
- •Из анализа результатов следует:
- •13.5. Промывочные жидкости, применяемые для бурения соленосных отложений
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •Продолжение таблицы 13.7
- •13.6. Анализ качества применяющихся промывочных жидкостей для бурения соленосных отложений
- •Скорость растворения галита в циркулирующих растворах
- •13.7. Силикатные растворы
- •Состав и свойства сульфатосиликатных и карбонатосиликатных растворов
- •13.8. Лигниноглинистые растворы
- •Заключение
- •Библиографический список
- •3. Структурирование глинистых растворов 42
- •4. Роль электролитов в структурировании промывочных жидкостей. 55
- •5. Роль полимеров в структурировании промывочных жидкостей. 78
- •6. Деструктурирование промывочных жидкостей 116
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей 131
- •9. Промывочные жидкости для бурения 188
- •10. Промывочные жидкости для бурения неуплотненных глин 222
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород. 264
- •12. Промывочные жидкости для бурения трещиноватых горных пород. 279
- •13. Промывочные жидкости для бурения соленосных отложений 304
13.4. Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
Существующие методы снижения растворяющей способности промывочных жидкостей основаны преимущественно на уравновешивании объемной энергии ее компонентов и использовании неполярной (не способной растворять) жидкости.
Растворяющую способность промывочной жидкости на водной основе, как мы отметили выше, можно определить по скорости растворения. В соответствии с законом Фика она определяется по формуле (13.9):
,
где Сх - концентрация определяющих объемную энергию компонентов промывочной жидкости (электролитов, твердой фазы, полимеров).
Коэффициент диффузии D зависит как от скорости циркуляции и промывочной жидкости, так и ее вязкости. Следовательно, растворяющую способность бурового раствора можно понизить не только за счет повышения концентрации компонентов промывочной жидкости, но и за счет повышения ее вязкости. Для многокомпонентной системы растворяющую способность бурового раствора можно выразить соотношением
![]() , (13.15)
, (13.15)
где Сх - концентрация насыщения раствора; Сi - концентрация i-го компонента в растворе; Di - коэффициент диффузии i-го компонента.
Кратко рассмотрим скорость растворения различных солей в различных растворах. Скорость растворения и растворяемость соли определяются ее химическим составом. Если растворяемая соль имеет более гидрофильные ионы, чем ионы электролита в растворе, то последние вытесняются ионами растворяемой соли. Причем растворяющая способность раствора электролита может быть выше, чем чистой воды. Известно, например, что трудно растворимый гипс в растворе поваренной соли растворяется в 2,5 раза сильнее, чем в воде, этому способствуют анионы хлора. Гидрофильность солей можно расположить в следующий ряд: МgCl2, СаСl2, NaCl, KC1.
 а
б
а
б
в
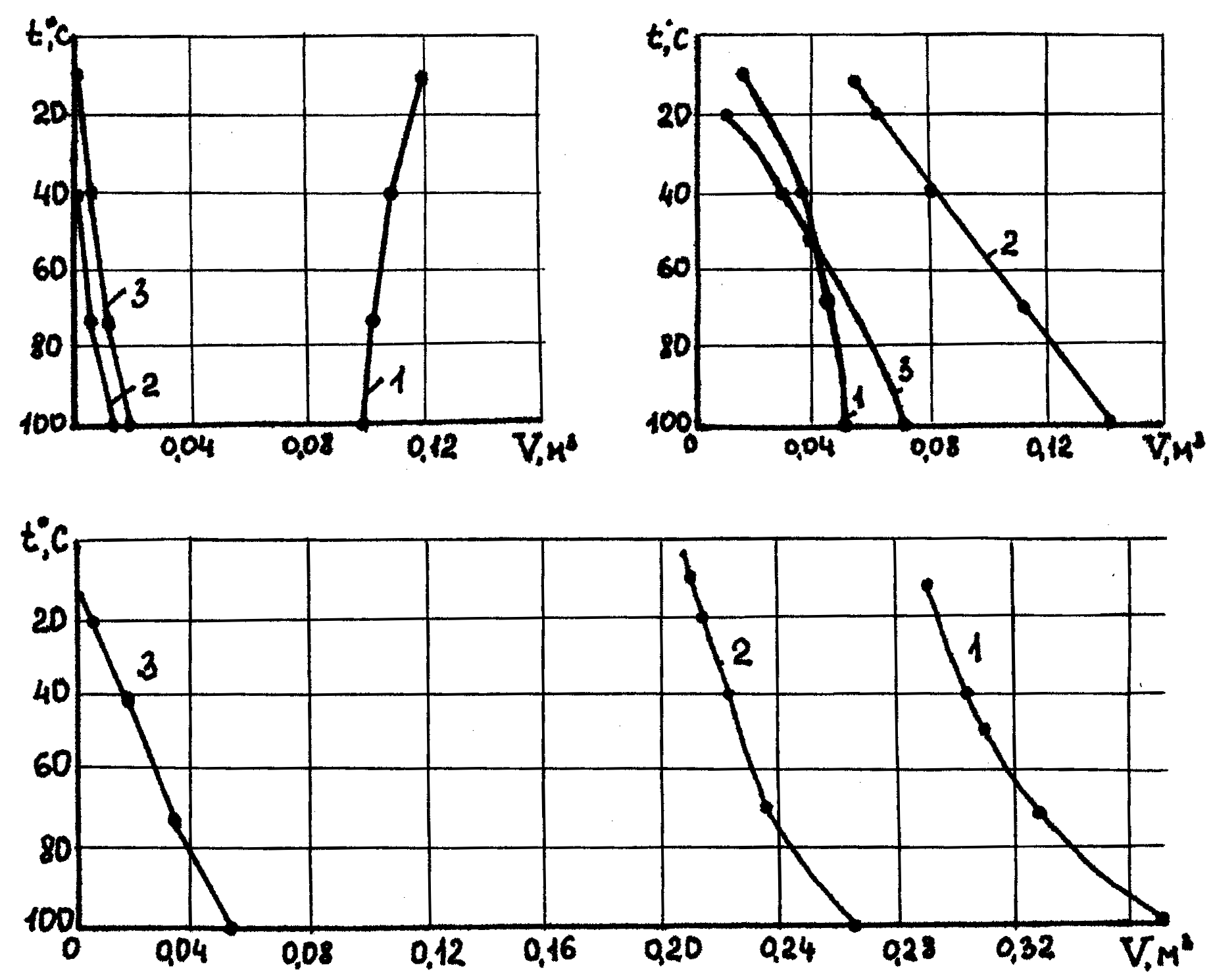
Рис 13.3. Графики условного объема каверн, которые могут образовываться в отложениях галита, сильвина и бишофита при длительном контактировании с растворами KC1 (1), NaCI(2) и MgCI2(З), насыщенными при 100С: а - галит, б - сильвин, в – бишофит.
Так, например, бишофит хорошо растворяется в растворе поваренной соли, еще лучше в растворе хлористого калия. Сильвин и галит легче растворяются в растворах солей одновалентных металлов, чем в солях двухвалентных металлов.
Достаточно четкие представления о влияниях электролита бурового раствора на растворимость перебуриваемых солей дают графики (рис.13.3), построенные по результатам пересчета данных Н.С. Курнакова и Н.А. Осокарева [16].
Скорость растворения поваренной соли, определенная по экспериментальным данным автора в соответствии с формулой (13.14),
![]()
приведена в табл.13.3.
Таблица 13.3
Скорость растворения галита в растворах электролитов
NaCl и MgCl2, м/c10-7
Электролит |
Концентрация соли, % |
|||||
0 |
5 |
10 |
15 |
27 |
35 |
|
NaCl MgCl2 |
4,7 4,7 |
3,9 3,9 |
3,1 3,3 |
2,2 2,7 |
0,14 1,4 |
- 0,19 |
Скорость растворения солей в структурированных растворах, очевидно, зависит от вязкости раствора, которая в свою очередь зависит от концентрации твердой фазы, скорости циркуляции раствора и ионной силы ионов соли
Для определения этой зависимости проведены лабораторные исследования.
В табл.13.4 показаны результаты исследований по определению скорости растворения галита в неподвижном, а в табл.13.5 - в постоянно перемешиваемом глинистом растворе.
Таблица 13.4
Скорость растворений галита в глинистом растворе, м/с10-7
(емкость сосуда 0,5л)
-
Время растворения, с
Концентрация глины, %
3%
5%
7%
612
1188
1800
3600
540
7200
64800
72000
2,5
2,5
2,4
1,6
1,5
1,4
0,3
0,3
2,5
2,4
2,4
1,6
1,5
1,3
0,2
0,2
2,1
2,1
2,1
1,3
1,2
1,1
0,2
0,2
Таблица 13.5
