
- •Назначение и свойства промывочной жидкости для бурения осложненных зон.
- •Часть 1. Теоретические основы структурирования промывочных жидкостей
- •Структура промывочных жидкостей
- •Гидрофобные (коагуляционные) структуры
- •Толщина диффузионного слоя с увеличением концентрации ионов и их заряда снижается в соответствии с уравнением
- •Гидрофильные структуры
- •1.2.1 Структура воды
- •1.2.2 Поверхностная энергия твердых тел.
- •Поверхностные натяжения твердых тел
- •1.2.3. Взаимодействие воды с поверхностью твердых тел.
- •2. Структура глинистого раствора.
- •2.1 Структурообразователи
- •2.2 Механизм гидрофильного структурообразования глинистых растворов
- •2.3. Объёмная электрическая энергия промывочной жидкости
- •Среднее значение
- •2.4. Приборы для определения прочности структуры промывочных жидкостей
- •3. Структурирование глинистых растворов
- •3.1. Способы структурирования
- •3.2. Структурирование промывочной жидкости за счет повышения концентрации дисперсной фазы
- •3.3. Структурирование буровых растворов путем диспергирования твердой фазы
- •Влияние числа импульсов генератора на свойства растворов
- •3.4. Влияние температуры на прочность структуры глинистых растворов
- •4. Роль электролитов в структурировании промывочных жидкостей.
- •4.1. Общие сведения об электролитах, применяемых при бурении скважин.
- •Зависимость рН растворов солей от их концентрации
- •Теплота растворения электролитов
- •4.2. Электролиты в роли структурообразователя
- •4.3. Активация твердой фазы электролитами.
- •4.4. Дезактивация дисперсной фазы электролитами
- •5. Роль полимеров в структурировании промывочных жидкостей.
- •5.1. Полимеры – структурообразователи.
- •5.1.2. Синтетические структурообразователи
- •5.2. Активность полимеров
- •Расчетные значения энергии поляризации
- •5.3. Другие функции полимеров.
- •5.4. Активация полимеров.
- •5.5. Активация дисперсионной среды полимерных растворов.
- •5.6. Активация твердой фазы полимерами
- •5.7. Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •5.8 Стабильность (седиментационная и агрегативная устойчивость) раствора.
- •5.9 Стабилизация буровых растворов полимерами.
- •Устойчивость реагентов к агрессии солей
- •6. Деструктурирование промывочных жидкостей
- •6.1. Искусственное деструктурирование (разжижение) промывочных жидкостей путем снижения концентрации твердой фазы
- •6.2. Деструктурирование промывочных жидкостей путём активации твёрдой фазы. Понизители вязкости.
- •6.3. Деструктурирование минерализованных промывочных жидкостей
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей
- •7.1.Вязкость ньютоновских жидкостей
- •Силу трения можно выразить формулой
- •Тогда касательное напряжение составит
- •Коэффициент кинематической вязкости будет
- •7.2. Вязкость структурированных жидкостей
- •7.2.1. Анализ существующих теорий
- •7.2.2. Влияние скорости течения, диаметра труб и концентрации твердой фазы на вязкость и коэффициент трения структурированных жидкостей
- •Влияние вязкости полимерного раствора и скорости
- •Зависимость показания раствора от концентрации кельцана
- •7.2.3. Влияние активации и дезактивации твёрдой фазы на коэффициент трения (вязкость) структурированных жидкостей.
- •7.3. Деструктурирование промывочных жидкостей при циркуляции.
- •7.3.1. Влияние длительности циркуляции структурированной жидкости на её вязкость
- •7.3.2. Влияние температуры на вязкость промывочных жидкостей.
- •7.4. Определение вязкости (касательных напряжений) промывочных жидкостей.
- •Значения вязкости различных буровых растворов
- •7.5. Влияние прочности структуры и вязкости промывочных жидкостей на процесс бурения
- •7.6. Тиксотропия промывочных жидкостей
- •Выводы:
- •7.7.Плотность промывочной жидкости.
- •Плотность аэрированной жидкости определяется по формуле
- •Часть II. Стабилизация неустойчивых стенок скважин. Задачами второй части исследований являются:
- •8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость горных пород стенок скважин.
- •9. Промывочные жидкости для бурения уплотненных глин.
- •9.1. Уплотненные глины
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глин.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •10. Промывочные жидкости для бурения неуплотненных глин
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин (общие понятия).
- •10.5. Исследование крепящих свойств полимерполисолевых растворов.
- •10.5.1. Теоретические рассуждения.
- •10.5.2. Экспериментальные исследования.
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород.
- •11.1. Микротрещиноватые глинистые породы. Осложнения при бурении
- •11.2. Влияние технологических параметров бурения на раскрытие трещин
- •11.3. Влияние гидродинамического давления на раскрытие трещин
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для кольматации трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •12.5. Применение пен при бурении трещиноватых пород
- •13. Промывочные жидкости для бурения соленосных отложений
- •13.1. Осложнения при бурении соленосных отложений
- •13.2. Растворение хемогенных горных пород Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.
- •Измерение массы и длины образцов соли при растворении в воде
- •13.3. Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.4. Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
- •Скорость растворения галита в перемешиваемом растворе, м/с10-7 (емкость 10л)
- •Из анализа результатов следует:
- •13.5. Промывочные жидкости, применяемые для бурения соленосных отложений
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •Продолжение таблицы 13.7
- •13.6. Анализ качества применяющихся промывочных жидкостей для бурения соленосных отложений
- •Скорость растворения галита в циркулирующих растворах
- •13.7. Силикатные растворы
- •Состав и свойства сульфатосиликатных и карбонатосиликатных растворов
- •13.8. Лигниноглинистые растворы
- •Заключение
- •Библиографический список
- •3. Структурирование глинистых растворов 42
- •4. Роль электролитов в структурировании промывочных жидкостей. 55
- •5. Роль полимеров в структурировании промывочных жидкостей. 78
- •6. Деструктурирование промывочных жидкостей 116
- •7. Структурная вязкость и коэффициент трения промывочных жидкостей 131
- •9. Промывочные жидкости для бурения 188
- •10. Промывочные жидкости для бурения неуплотненных глин 222
- •11. Промывочные жидкости для бурения микротрещиноватых глинистых пород. 264
- •12. Промывочные жидкости для бурения трещиноватых горных пород. 279
- •13. Промывочные жидкости для бурения соленосных отложений 304
Зависимость рН растворов солей от их концентрации
Концентрация соли, % |
pH |
Концентрация соли, % |
pH |
AlCl3 0,10 0,25 0,50 1,00 10,00 |
4,63 4,51 4,43 4,31 3,36 |
FeCl3 0,10 0,25 0,50 1,00 10,00 |
3,51 3,37 3,11 2,98 2,34 |
NaCl 0,10 0,25 0,50 1,00 10,00 26,40 |
7,26 7,26 7,20 7,24 7,46 7,76 |
CaCl2 0,10 0,25 0,50 1,00 10,00 |
6,65 6,66 6,76 7,08 7,46 |
Таблица 4.3
Произведения растворимости некоторых веществ при 250С
Соли |
Произведение растворимости |
Барит BaSO4 |
1,110-10 |
Ангидрит CaSO4 |
1,310-4 |
Кальцит CaCO3 |
510-9 |
Другим фактором, влияющим на интенсивность взаимодействия катионов с глинистыми частицами, является их гидрофильность.
Гидрофильность электролитов можно определить по теплоте их растворения (табл.4.4).
Таблица 4.4
Теплота растворения электролитов
Электролит |
Теплота растворения |
Электролит |
Теплота растворения |
HF |
60,7 |
H2SO4 |
76,7 |
HBr |
85,1 |
|
|
HCl |
74,8 |
|
|
FeCl3 |
132,4 |
B(OH)3 |
21,8 |
CaCl2 |
74,5 |
NaSO4 |
11,3 |
BaCl2 |
8,7 |
K2SO4 |
-24,7 |
NaCl |
-5,1 |
NaOH |
42,4 |
KCl |
-17,6 |
KOH |
54,7 |
Теплоты растворения электролитов обусловлены гидрофильностью его ионов. Так, сильные кислоты и щелочи легко диссоциируют в воде, их ионы активно взаимодействуют с молекулами воды, вследствие чего теплота их растворения достаточна высока.
Гидрофильность одновалентных металлов Na+ и К+ невысока, соли NaCI, KC1 растворяются в воде с поглощением тепла, поэтому они весьма подвижны и, благодаря этому способны проникать по порам неуплотненной глины вместе с раствором на значительные расстояния. Особенно это касается ионов калия.
С увеличением заряда гидрофильность и глинофильность катионов возрастает: теплота растворения CaС12 составляет 74,5 кДж / моль, а FеСl3 -132,4 кДж/моль.
Вследствие высокой гидрофильности ионов кальция, ее соли даже с двухвалентными анионами paстворяются в воде, особенно в присутствии в ней хлоридов, а в контакте глины с растворами хлоридов обменные катионы Са2+ переходят из глины в раствор. По исследованиям O.K. Ангелопуло, при пропитке раствором KC1 бентонитовых глин в жидкости, просочившейся через глину, была обнаружена высокая концентрация ионов Са2+ (ионов обменного комплекса).
Ионы Мg2+ более гидрофильны и более "глинофильны", поэтому в обменном комплексе МgС12 даже совместно с растворами KC1 ионы Мg2+ адсорбируются преимущественно в верхней части глинистых образцов.
С увеличением концентрации адсорбируемых глиной катионов понижаются поверхностный потенциал и гидрофильность глинистых частиц, а значит, понижается толщина пленок воды.
На рис.4.1. показана зависимость поверхностного потенциала частиц от концентрации электролита для одного- (1), двух- (2) и трехвалентных (3)катионов.
Из рисунка видно, что с увеличением валентности катионов для нейтрализации заряда на одну и ту же величину требуется значительно меньшая концентрация электролитов. Для трехвалентных катионов знак потенциала может даже изменяться на обратный.
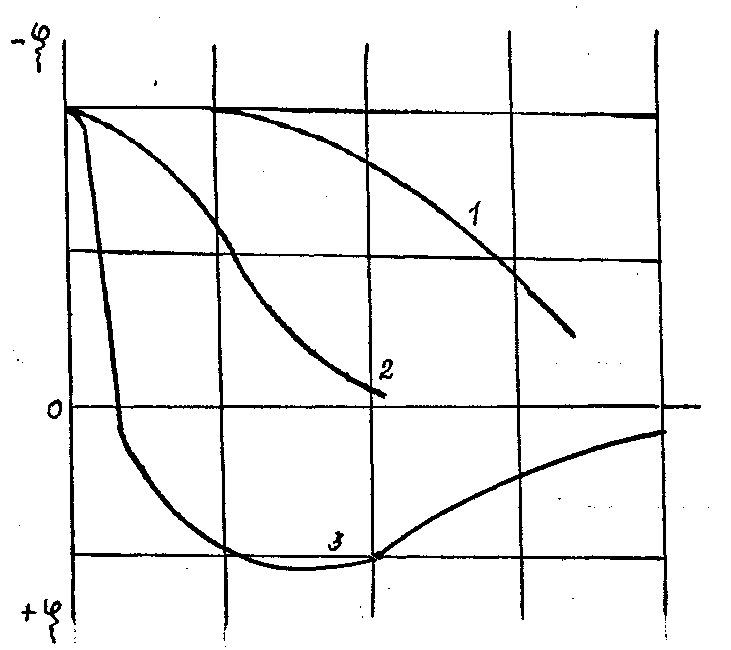
Рис.4.1.Зависимость электрокинетического потенциала частиц от концентрации электролита одно-(1), двух-(2) и трехзарядных (3) противоионов.
Важным фактором, влияющим на интенсивность взаимодействия катионов с глинистыми частицами, является наличие в растворе анионов и их активность.
Анионы раствора снижают подвижность и активность катионов, в результате чего интенсивность взаимодействия глинистых частиц с катионами раствора понижается, и чем выше активность анионов, тем ниже интенсивность взаимодействия.
