
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
1.3 Задачі для самостійного розв’язку
Задача № 1
Яку кількість 87% - ного карбіду кальцію необхідно для одержання 1 т льодяної оцтової кислоти за умови, що всі реакції перебігають з 98% - ним виходом.
Задача № 2
Розрахувати, скільки літрів газу (об’ємна доля СО2 –38%), знадобиться для перетворення у гідрокарбонат натрію 1 т кальцинованої соди Na2СО3, масова доля домішок в якій складає 1,2%
Задача № 3
Скільки газу (об’ємна доля, %: NН3 – 11,76 ; О2 – 17,65 ; N2 – 70,59) не обхідно ввести в контактний апарат для одержання 1000м3 NО, якщо окислення NН3 до NО перебігає з ступенем перетворення 95%, а залишок NН3 окислюється до вільного азоту.
Задача № 4
Визначити витрати 75% - ної сульфатної кислоти і 100% - ної солі NaCl для одержання 1 т сульфату натрію за реакцією :
2 NaCl + Н2SO4 = Na2SO4 + 2НСl ,
якщо ступінь перетворення NaCl у сульфат натрію складає 93% .
Задача № 5
Визначити кількість води, яка видаляється з випарних апаратів і плавильних котлів на 1 т готової каустичної соди , яка вміщує 95% NaOH , якщо на випарювання надходить 52% - ний розчин NaOH, а потім у плавильні котли – 78% - ний.
Задача № 6
Розрахувати витрати технічного жовтого фосфору (масова частка Р = 99,5%) на 1 т фосфорної кислоти, якщо втрати фосфору ( у перерахунку на Р2О5 ) у виробництві фосфорної кислоти складає 2,5% , а ступінь абсорбції Р2О5 – 99% . Рівняння реакцій :
2Р2 + 5О2 = 2Р2О5 ;
2Р2О5 + 6Н2О = 4Н3РО4
Тема 2
2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
Якщо
в процесі реагує суміш речовин, кількість
кожної з них звичайно виражена у
відсотках до всієї суміші або в кіломолях
на 1м![]() суміші.
1 Кмоль будь якого газу у однакових
умовах займає один й той же об’єм
: V=22,4м
( н.у.) Нормальні умови Р
суміші.
1 Кмоль будь якого газу у однакових
умовах займає один й той же об’єм
: V=22,4м
( н.у.) Нормальні умови Р![]() =101325Па
(0,1 МПа, 1атм.) і Т
=273,15К(0
С
=101325Па
(0,1 МПа, 1атм.) і Т
=273,15К(0
С![]() )
)
Густину газу можна розрахувати за формулою :
![]() =
=![]() , (2.1)
, (2.1)
де М- молекулярна маса, кмоль.
Якщо задані умови відрізняються від нормальних, користуються формулою, яка дозволяє визначити густину за даних умов(Р,Т) :
![]() =
=
![]() .
(2.2)
.
(2.2)
Молекулярну масу газової суміші розраховують за формулою:
М![]() =
=![]()
![]() ;
(2.3)
;
(2.3)
де і=1- номер компонента суміші;
М![]() - молекулярна маса і-того компонента;
- молекулярна маса і-того компонента;
- мольний (об’ємний) вміст і-того компонента , %.
Масові частки переводять у об’ємні або мольні за формулою:
=
![]()
![]() /
/![]() ; (2.4)
; (2.4)
де g - мосова частка і-того компонента ;
- загальна кількість кіломолей всіх компонентів суміші.
Перевід об’ємних часток до масових за формулою:
g
=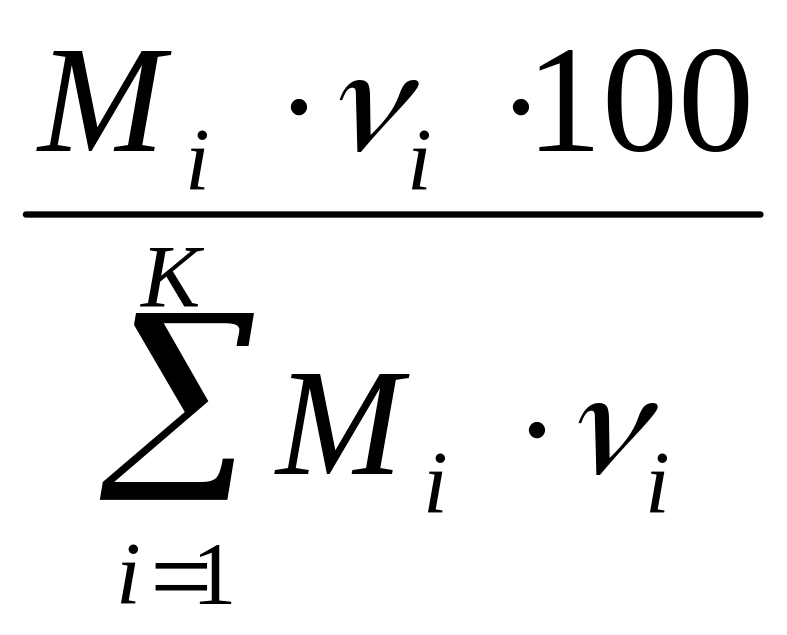 .
(2.5)
.
(2.5)
У технологічних розрахунках хімічних виробництв застосовують закон Бойля:
РV=const
, або P![]() V
=P
V
=P![]() V
, або
V
, або
![]() =
=![]() (2.6)
(2.6)
Закон
Гей –Люссака
=![]() ,
звідки
,
звідки
V=V![]()
![]() , або
, або![]() =
=![]() (2.7)
(2.7)
Рівняння стану ідеального газу Клайперона-Менделєєва
PV=![]() (2.8)
(2.8)
Рівняння стану реального газу:
Р=N(![]() )
,
(2.9)
)
,
(2.9)
де а,b- коефіцієнти, залежать від природнього газу;
Закон Дальтона
Р
=![]() , (2.10)
, (2.10)
де Р - парціальний тиск і-того компонента, з якого складається газова суміш ;
Р![]() -
загальний тиск газової суміші;
-
загальний тиск газової суміші;
- парціальний об’єм і-того газу в суміші;
М - молярна маса газу, кг/кмоль ;
N - кількість кіломолей;
R - універсальна газова стала, 8,314 Дж/моль К ;
m - маса газу, кг;
