
- •Визначення залежності швидкості хімічних реакцій від різних умов
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •4.1. Вплив температури на швидкість реакції.
- •4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
- •4.3. Вплив каталізатора на швидкість хімічної реакції,
- •4.4. Вплив інгібітору на швидкість хімічної реакції.
- •5. Вимоги до звіту
- •6. Техніка безпеки
- •7. Контрольні питання
- •8. Література
- •Вивчення моделі проточного трубчастого реактора
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади і посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Вивчення моделі реактору ідеального змішування
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2.Хімічні реактиви, прилади, посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання нафтопродуктів прямою перегонкою нафти
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •Визначення густини пікнометром
- •Визначення в 'язкості
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи.
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Дослідження корозії металів
- •1. Теоретичні основи
- •Показники корозії металів
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •Отримання їдкого натрію (NаOh) і хлору електрохімічним методом
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання сульфату амонію
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Послідовність виконання роботи
- •3.1 Визначення твердості води
- •3.2 Визначення хлоридів
- •3.3 Визначення масової концентрації двовалентного і тривалентного заліза
- •3.4 Визначення масової концентрації міді
- •3.5 Визначення масової концентрації хрому
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Одержання і дослідження конденсаційних смол (новолочна смола)
- •Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Очищення хімічних реагентів ( реактивів) методом прямої перегонки
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
МІНІСТЕРСТВО НАУКИ ТА ОСВІТИ УКРАЇНИ
ЧЕРКАСЬКИЙ ДЕРЖАВНИЙ ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ
МЕТОДИЧНІ ВКАЗІВКИ
до виконання лабораторних робіт з курсу
"ЗАГАЛЬНА ХІМІЧНА ТЕХНОЛОГІЯ"
для студентів напряму підготовки 6.051301 «Хімічна технологія»
всіх форм навчання
Затверджено
на засіданні кафедри ХТНР
Протокол № 6 від 16.02. 2010 р.
Черкаси 2010
Методичні вказівки до виконання лабораторних робіт з курсу "Загальна хімічна технологія" для студентів всіх форм навчання напрямку підготовки 6.051301 „Хімічна технологія”/ Укл. Галенко М.В., Семененко Т.І., Столяренко Г.С. - Черкаси: ЧДТУ, 2010. - 76 с.
Укладачі: Столяренко Г.С, д.т.н., професор
Галенко М.В.
Семененко Т.І.
Рецензент Солодовник Т.В., к.х.н.
ПРОГРАМА НАВЧАЛЬНОЇ ДИСЦИПЛІНИ
Основна мета курсу – вивчення загальних, найбільш важливих принципових основ виробничих процесів. В програму курсу входить розглядання на конкретних прикладах порядку дослідження хіміко-технологічних процесів, підхід до визначення оптимальних фізико-хімічних умов виробництва.
Раціональний вибір хімічних апаратів, складання технологічних схем хімічних процесів та оцінка їх основних матеріальних та енергетичних пошуків, зв'язок хімічної технології з охороною навколишнього середовища. Використання нових технологій в області промислового синтезу.
3 вивченням загальної хімічної технології студенти повинні:
отримати знання і навики в теоретичних питаннях хімічної технології;
зрозуміти суть фізико-хімічних процесів, які відбуваються в апаратах технологічної схеми;
навчитися робити економiчну оцінку сировинної бази та продуктів хімічних виробництв;
знаходити перспективи розвитку галузі в світлі науково - технологічного процесу з використанням прийомів
маркетінгу.
Для студентів денної форми навчання вивчення дисципліни передбачено у V, VI семестрі з виконанням розрахунково – графічної роботи, практичних робіт і складання заліків та іспитів.
Для студентів заочної форми навчання вивчення дисципліни передбачено у VII семестрі з виконанням контрольної роботи, практичних занять, складання заліку і іспиту.
Далі наведено розподіл годин для студентів денної та заочної форми навчання і структуру модулів і залікового кредиту.
Таблиця 1.1 – Розподіл годин з дисципліни за формами і видами навчання
Форма навчання |
Курс |
Семестр |
Кредити ECTS |
Аудиторні заняття (год.) |
Самостійна робота (год.) |
КР, РГР, КП, семестр |
Заліки (семестр) |
Іспит (семестр) |
Всього годин в семестрі |
|||
Всього |
Лекції |
Практич. заняття |
Лабор. заняття |
|||||||||
Денна |
3 |
5 |
3,75 |
90 |
36 |
18 |
36 |
45 |
5 |
5 |
5 |
135 |
|
6 |
4,75 |
119 |
34 |
34 |
51 |
52 |
6 |
6 |
6 |
171 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Заочна |
4 |
7 |
8,5 |
60 |
20 |
20 |
20 |
246 |
7 |
7 |
7 |
306 |
Таблиця 1.2 – Структура модулів дисципліни
Форма навчання |
Курс |
Семестр |
Номер модуля |
Назва модуля |
кількість годин |
Навчальні тижні |
Номери тем модуля, відповідно робочої програми |
Разом кількість годин за семестр |
Денна |
3 |
6 |
1 |
Хімічні процеси та реактри |
67 |
1-9 |
1-8 |
135 |
2 |
Гетерогенні процеси та теплові режими реакто-рів. Загальні принципи розробки ХТС |
68 |
10-18 |
9-14 |
||||
7 |
3 |
Технології виробництва кислот, мінеральних солей, добрив |
85 |
1-12 |
15-17 |
171 |
||
4 |
Технології органічного синтезу |
86 |
13-17 |
18,19 |
Таблиця 1.3 - Структура залікового кредиту навчальної дисципліни
„Загальна хімічна технологія”, 6 і 7 семестри
Семестр |
Кредитний модуль |
Загальний обсяг, годин |
Аудиторних занять, годин |
Самостійна робота, годин |
Контрольний захід |
VI |
Модуль 1 |
67 |
45 |
22 |
ВК; ЛМ; ІКР ПМК |
|
Модуль 2 |
68 |
45 |
23 |
ЛМ; ІКР; ТК; ПМК |
VII |
Модуль 3 |
85 |
59 |
26 |
ВК; ТК; ЛМ; ПКР; ПМК |
|
Модуль 4 |
86 |
60 |
26 |
ТК; ЛМ; ПКР; ПМК |
|
Разом: |
306 |
209 |
97 |
|
Примітка: ВК – вхідний контроль; ТК – тестовий контроль; ЛМ – лабораторний модуль; ІКР – індивідуальна контрольна робота: ПКР – поточна контрольна робота; ПМК – підсумковий модульний контроль
Таблиця 1.4 – Назви тем лабораторних робіт, їх зміст та об`єм
№ пп |
Назва тем лабораторних занять |
ОБ`ЄМ В ГОДИНАХ |
|
Хімічні процеси та реактри |
|
1 |
Техніка безпеки при роботі в хімічній лабораторії |
2 |
2 |
Визначення залежності швидкості хімічних реакцій від різних умов. |
6 |
3 |
Вивчення моделі проточного трубчастого реактора. |
5 |
4 |
Вивчення моделі реактору ідеального змішування |
5 |
|
Разом |
18 |
|
Гетерогенні процеси та теплові режими реакторів. Загальні принципи розробки ХТС |
|
4 |
Визначення фізичних характеристик твердих сипучих хімічних реагентів |
6 |
5 |
Одержання нафтопродуктів прямою перегонкою нафти |
6 |
6 |
Технічний аналіз нафтопродуктів |
6 |
|
Разом |
18 |
|
Всього годин за VI семестр: |
36 |
|
Технології виробництва кислот, мінеральних солей, добрив |
|
7 |
Дослідження корозії металів |
6 |
8 |
Отримання їдкого натрію (NaOH) і хлору електрохімічним методом |
6 |
9 |
Одержання сульфату амонію. |
6 |
10 |
Застосування води в хімічній технології |
7 |
|
Разом |
25 |
|
Технології органічного синтезу |
|
11 |
Одержання полісульфідних каучуків або тіоколів |
7 |
12 |
Одержаним і дослідження конденсаційних смол |
7 |
13 |
Електролітичне нікелювання і мідніння |
6 |
14 |
Очищення хімічних реагентів (реактивів) методом прямої перегонки |
6 |
|
Разом |
26 |
|
Всього годин за VII семестр: |
51 |
|
Разом годин: |
87 |
ЛАБОРАТОРНА РОБОТА №1
Визначення залежності швидкості хімічних реакцій від різних умов
Мета роботи: практичне визначення залежності швидкості хімічних реакцій від різних умов.
1. Теоретичні основи
Швидкість технологічних процесів - це результуюча величина швидкостей прямої, зворотної та сторонньої реакцій, а також конвекції і дифузії вихідних речовин у зону реакції і продуктів реакції з цієї зони.
Якщо швидкість реакції менша за швидкість дифузійних процесів, підвід реагуючих речовин і відвід продуктів, то процес протікає в кінетичній області і для його прискорення слід підвищувати температуру, концентрацію реагуючих речовин із можливим використанням каталізаторів. В кінетичній області протікає більшість позитивних процесів. Якщо швидкість реакції набагато більша за дифузійні процеси, то загальна швидкість визначається дифузією, оскільки процес відбувається у дифузійній області. Такий процес прискорюється перш за все перемішуванням реагуючих речовин та регулюванням тиску. Використання каталізаторів не прискорює дифузію.
Основні рівняння швидкості хімічного процесу:
1. Для гомогенних процесів швидкість процесу визначається підвищенням концентрації продуктів реакції Сп за часом:
![]() (1.1)
(1.1)
де k - константа швидкості процесу;
С - рушійна сила, яка представлена виразом добутку діючих концентрацій вихідних речовин.
2. Для гетерогенних процесів, що проходять у дифузійній області при відомій поверхні F зіткнення фаз:
![]() (1.2)
(1.2)
де Gп - кількість продукту, одержана за годину;
k - константа швидкості процесу, що також називається коефіцієнтом масопередачі.
3. Для гомогенних і гетерогенних процесів у кінетичній дифузійній областях швидкість процесу визначається:
![]() (1.3)
(1.3)
де V - реагуючий об'єм.
Константа швидкості процесу k - складна величина, яка залежить від хімічних і фізичних властивостей реагуючих речовин, швидкостей потоків, реагуючих мас, перемішування компонентів і конструкції реакційних апаратів.
Формули для розрахунків k надто різні. В більшості випадків використовують експериментальні значення, що розраховуються за дослідними даними кінетичних рівнянь:
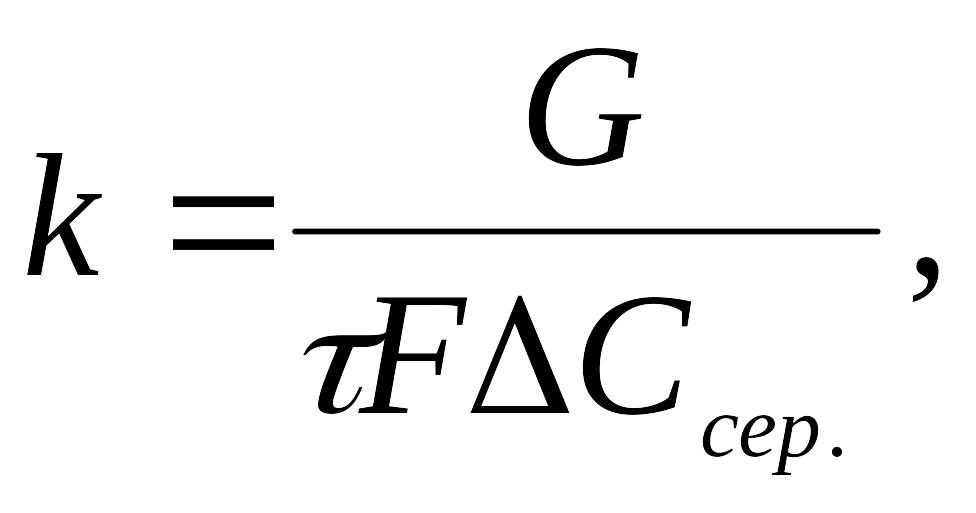 (1.4)
(1.4)
де Ссер - середня логарифмічна рушійна сила процесу.
Залежність константи швидкості реакції від температури виражається рівнянням Арреніуса:
![]() (1.5)
(1.5)
де kо - передекспоненціальна постійна величина рівняння Арреніуса;
Ε - енергія активації;
R - універсальна газова постійна;
Τ - термодинамічна температура.
Для газових реакцій з урахуванням впливу температури і тиску рівняння швидкості процесу має вигляд:
![]() (1.6)
(1.6)
де Cсер. - середня рушійна сила процесу під атмосферним тиском;
Ρ - безрозмірний тиск в реакторі;
n - порядок реакції.
Середню рушійну силу процесу можна знайти за рівнянням:
![]() (1.7)
(1.7)
Каталізатори збільшують швидкість хімічних реакцій, не впливають на стехіометричне співвідношення реагуючих речовин. Суть прискореної дії каталізаторів грунтується на протіканні реакції за потрібним механізмом з участю каталізаторів.
Наприклад, синтез може відбуватися без каталізатора за рівнянням реакції:
А + В = АВ;
- з енергією активації Е. У присутності каталізатора відбуваються дві послідовні реакції:
А + [К] = А [К]
В + А [К] = АВ + [К];
- з меншим значенням енергії активації Ε1 і E2.
