
- •Визначення залежності швидкості хімічних реакцій від різних умов
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •4.1. Вплив температури на швидкість реакції.
- •4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
- •4.3. Вплив каталізатора на швидкість хімічної реакції,
- •4.4. Вплив інгібітору на швидкість хімічної реакції.
- •5. Вимоги до звіту
- •6. Техніка безпеки
- •7. Контрольні питання
- •8. Література
- •Вивчення моделі проточного трубчастого реактора
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади і посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Вивчення моделі реактору ідеального змішування
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2.Хімічні реактиви, прилади, посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання нафтопродуктів прямою перегонкою нафти
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •Визначення густини пікнометром
- •Визначення в 'язкості
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи.
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Дослідження корозії металів
- •1. Теоретичні основи
- •Показники корозії металів
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •Отримання їдкого натрію (NаOh) і хлору електрохімічним методом
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання сульфату амонію
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Послідовність виконання роботи
- •3.1 Визначення твердості води
- •3.2 Визначення хлоридів
- •3.3 Визначення масової концентрації двовалентного і тривалентного заліза
- •3.4 Визначення масової концентрації міді
- •3.5 Визначення масової концентрації хрому
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Одержання і дослідження конденсаційних смол (новолочна смола)
- •Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Очищення хімічних реагентів ( реактивів) методом прямої перегонки
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
2. Хімічні реактиви, прилади та посуд
Реактиви:
сірчана кислота H2SO4, розбавлена 1:5 і 1:10;
соляна кислота НС1, розбавлена 1:1 і 1:3;
оцтова кислота CH3COOH, розбавлена 1:5;
цинк у гранулах і у вигляді пластинок;
перекис водню Н2О2, 3% розчин;
двоокис марганцю MgO2, порошок;
уротропін або формалін.
Прилади:
прилад для визначення залежності швидкості реакції від різних умов.
3. Опис лабораторної установки
Прилад дає можливість виявити вплив на швидкість хімічної реакції таких факторів:
- природи реагуючих речовин;
- концентрації реагуючих речовин;
- температури;
- поверхні зіткнення реагуючих речовин (ступеня подрібнення твердого реагенту);
- каталізатора;
- інгібітора.
Прилад, зображений на рисунку 1.1, складається з таких частин: дерев'яної панелі-підставки, двох демонстраційних пробірок, двох манометричних трубок, двох скляних трубок з пробками, двох гумових трубок, які з'єднують між собою прямі й зігнуті манометричні трубки. На дерев'яній панелі-підставці закріплені дві пробірки місткістю 50 мл, заткнуті гумовими пробками з отворами, в які вставлені скляні трубки. Вільні кінці цих трубок з'єднані за допомогою гумових трубок з манометричними. Між манометричними трубками на панелі розміщена шкала з позначками для спостерігання за рівнем рідини в трубках.
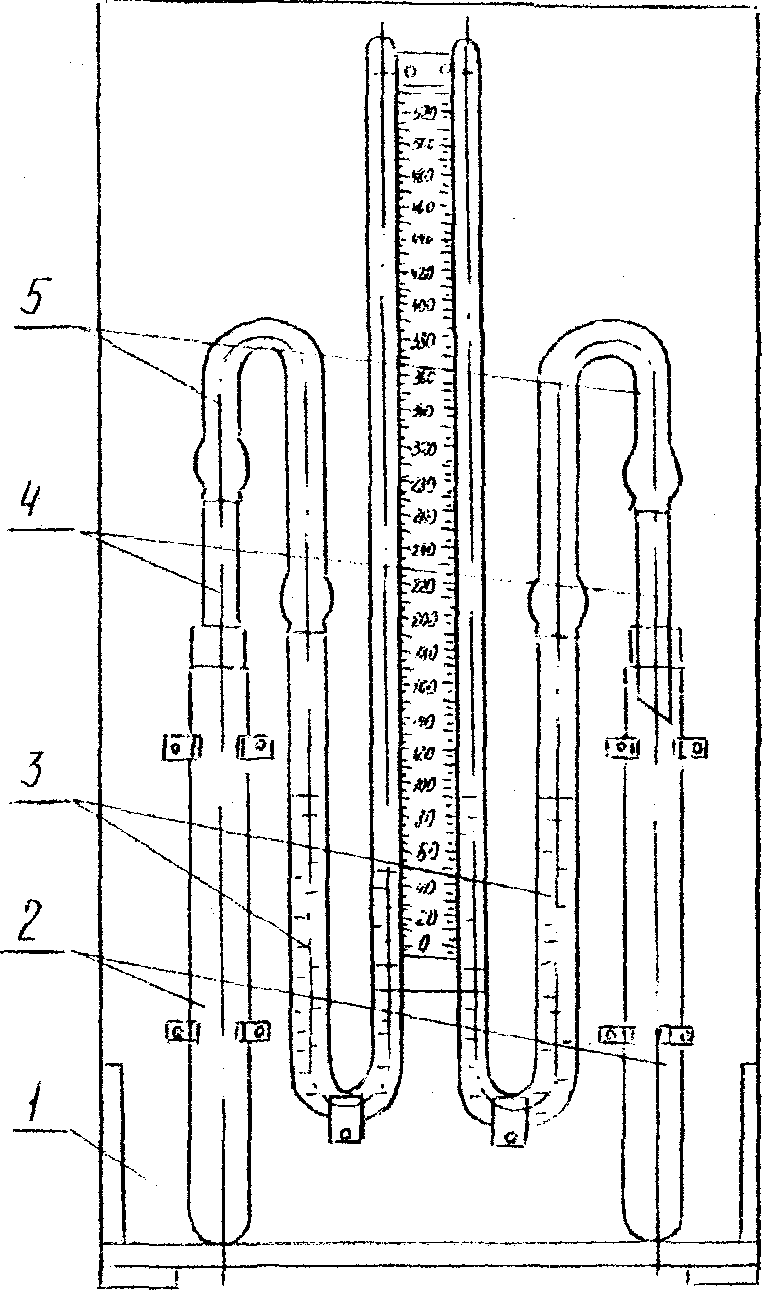
1 - дерев'яна панель-підставка; 2 – демонстраційні пробірки;
3 – манометричні трубки; 4 - скляні трубки з пробками;
5 - гумові трубки.
Рисунок 1.1 - Прилад для визначення залежності швидкості хімічних реакцій від різних умов
4. Послідовність виконання роботи
4.1. Вплив температури на швидкість реакції.
В одну пробірку наливають 10 мл розчину сірчаної кислоти кімнатної температури, а в другу - такий же об'єм кислоти, яка нагріта до 50° С. Кислота в обох випадках розбавлена (1 ;5).
Опускають одночасно в дві пробірки одну-дві гранули цинку. За різницею рівнів забарвленої рідини в манометричних трубках роблять висновок про швидкість хімічних реакцій.
4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
У дві пробірки наливають по 10 мл розчину розбавленої сірчаної кислоти (1:5). В одну з пробірок опускають одну гранулу цинку, а в другу - пластинку. В одній з пробірок спостерігається більш швидке збільшення рівня рідини.
4.3. Вплив каталізатора на швидкість хімічної реакції,
У дві пробірки наливають по 10 мл 3%-го розчину перекису водню і опускають по гранулі цинку. В одну з пробірок вносять на кінці скальпеля двоокис марганцю. Спостерігають швидке збільшення рівня рідини в манометричній трубці з каталізатором.
Аби довести, що каталізатор в результаті реакції не змінився, зливають рідину з пробірки, в якій знаходився каталізатор, промивають дистильованою водою і наливають новий об'єм (10 мл) перекису водню. Спостерігають той же ефект.
Крім двоокису марганцю можна використовувати як каталізатор окис міді, окис заліза та двоокис кремнію.
4.4. Вплив інгібітору на швидкість хімічної реакції.
У дві пробірки наливають по 10 мл сірчаної кислоти (1:5). Одночасно опускають в них по дві-три гранули цинку. Спостерігають рух стовпців забарвленої рідини в обох манометричних трубках.
У одну з пробірок додають невелику кількість подрібненого уротропіну. Через 1-2 хв спостерігають, що рух стовпця рідини в цій манометричній трубці різко сповільнився.
Як інгібітор можна використовувати формалін (в одну пробірку додати 1 мл формаліну, а в другу - такий же об'єм дистильованої води, щоб концентрація кислот в обох пробірках була однаковою).
