
- •Визначення залежності швидкості хімічних реакцій від різних умов
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •4.1. Вплив температури на швидкість реакції.
- •4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
- •4.3. Вплив каталізатора на швидкість хімічної реакції,
- •4.4. Вплив інгібітору на швидкість хімічної реакції.
- •5. Вимоги до звіту
- •6. Техніка безпеки
- •7. Контрольні питання
- •8. Література
- •Вивчення моделі проточного трубчастого реактора
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади і посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Вивчення моделі реактору ідеального змішування
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2.Хімічні реактиви, прилади, посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання нафтопродуктів прямою перегонкою нафти
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •Визначення густини пікнометром
- •Визначення в 'язкості
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи.
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Дослідження корозії металів
- •1. Теоретичні основи
- •Показники корозії металів
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •Отримання їдкого натрію (NаOh) і хлору електрохімічним методом
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання сульфату амонію
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Послідовність виконання роботи
- •3.1 Визначення твердості води
- •3.2 Визначення хлоридів
- •3.3 Визначення масової концентрації двовалентного і тривалентного заліза
- •3.4 Визначення масової концентрації міді
- •3.5 Визначення масової концентрації хрому
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Одержання і дослідження конденсаційних смол (новолочна смола)
- •Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Очищення хімічних реагентів ( реактивів) методом прямої перегонки
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
6. Вимоги до звіту
1. Звіт повинен містити короткі теоретичні відомості, опис лабораторної установки та порядок виконання роботи, результати замірів, розрахунки.
2. За розрахунковими даними будують графіки залежностей Х NaOH від Η, τ та Са від Η, τ.
3. Результати зводять в таблицю 2.1:
Таблиця 2.1
Відстань від входу в реактор (від точки змішування реагентів до точки заміру) |
Об'єм частини реактора від входу в реактор до точки заміру, л |
Час перебуван-ня реагенту в реакторі, с |
Концентрація розчинів, моль/л, С |
Ступінь перетворення, X |
||
NaОН |
СНзСООС2Н5 |
NaОН |
СНзСООС2Н5 |
|||
|
|
|
|
|
|
|
7. Техніка безпеки
1. Роботу необхідно виконувати при ввімкненій витяжній вентиляції.
2. Працювати на установці треба уважно, виконувати тільки доручену роботу.
3. Робота з лугом кваліфікується як робота з їдкими речовинами, тому слід дотримуватися відповідних правил безпеки. Якщо розчин їдкого натру потрапив на шкіру, необхідно змити його великою кількістю води, 3%-ним розчином борної кислоти і знову водою. Якщо розчин лугу потрапить в очі, необхідно їх промити великою кількістю води та звернутися до лікаря.
8. Контрольні питання
1. Що називається РІВ?
2. Що являє собою гідродинамічний режим роботи РІВ? Які режими витікання в'язкої рідини ви знаєте?
3. Зміни концентрації, ступеня перетворення і швидкості реакції вздовж РІВ.
4. Характеристичне рівняння РІВ.
5. Приклади трубчастих реакторів витіснення, які використовуються у хімічній промисловості.
9. Література
1. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
2. Мухленов И.П. Практикум по общей химической технологии. - М: Высшая школа, 1979. - 421 с.
3. Кутепов О.М., Бондарева Т.И., Беренгартен М.Г. Обшая химическая технология. Учебник для вузов. - 2-е изд. испр. и доп. - М: Вьісшая школа, 1990. - 520 с.
ЛАБОРАТОРНА РОБОТА 3
Вивчення моделі реактору ідеального змішування
Мета роботи: вивчення характеристик реактору ідеального змішування (періодичного).
1. Теоретичні основи
Основний елемент хіміко - технологічної системи (ХТС) є хімічний реактор. Це апарат в якому відбувається хімічний процес, який поєднує хімічну реакцію з масо- і теплопередачею.
Основні вимоги до хімічних реакторів:
1. Максимальна продуктивність та інтенсивність роботи;
2. Високий вихід продукту і найбільша селективність процесу;
3. Мінімальні енергетичні затрати на перемішування і транспортування реагентів через реактор. Використання теплоти екзотермічних реакцій, а також теплоти для підігрівання реагентів та ін.;
4. Легкість в експлуатації реактору і безпечність роботи;
5. Низька вартість виготовлення і ремонту реактору;
6. Стійкість роботи реакторів при значних змінах основних параметрів реактору ( С, Т, Р, Ак, ω).
Всім цим вимогам відповідає реактор ідеального змішування періодичної дії. В реактор періодичної дії одночасно завантажують відповідну кількість реактивів, які будуть знаходитись в реакторі, доки не буде досягнута бажана ступінь перетворення. Після цього реактор розвантажують.
Рівняння, яке характеризує реактор періодичної дії ідеального змішування
![]() (3.1)
(3.1)
де τ – час перебування реагентів в реакторі, с
![]() -
початкова концентрація основного
вихідного компоненту, моль/л
-
початкова концентрація основного
вихідного компоненту, моль/л
ХА – ступінь перетворення
UA - швидкість реакції, (моль/с, м3/с)
На рисунку 3.1 та 3.2 відображена зміна концентрацій вихідного реагенту в реакторі ідеального змішування від часу та в просторі реактору.
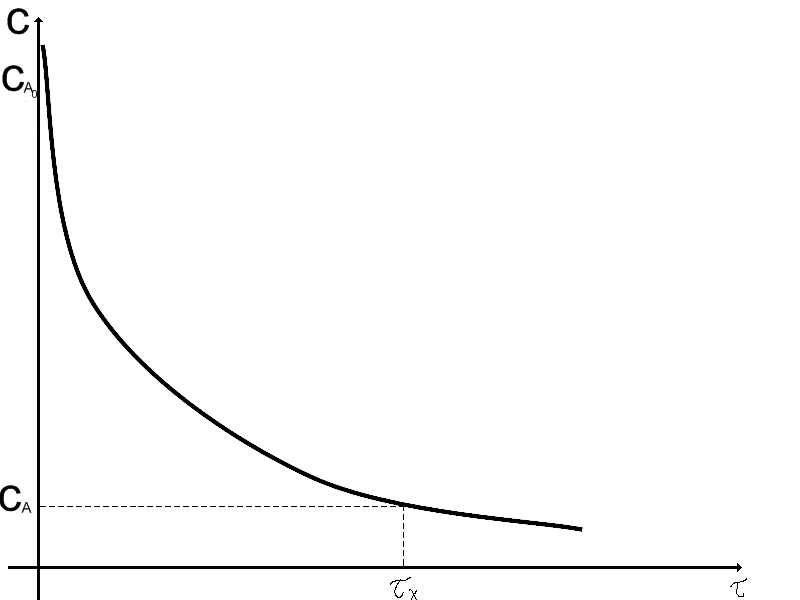
Рисунок 3.1 - Зміна концентрації реагентів від часу
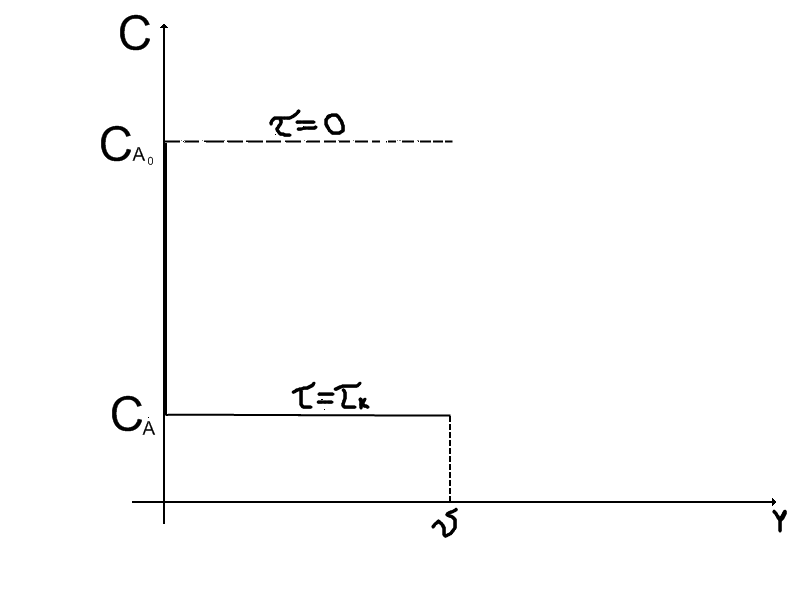
Рисунок 3.2 - Зміна концентрації реагентів в просторі реактору
Рівняння матеріального балансу реактору ідеального змішування
![]() (3.2)
(3.2)
де
![]() -
реакційний об’єм, м3
-
реакційний об’єм, м3
СА![]() –
концентрація основного вихідного
реагенту, моль/л
–
концентрація основного вихідного
реагенту, моль/л
XА– ступінь перетворення
![]() -
час перебування реагентів в реакторі,
с
-
час перебування реагентів в реакторі,
с
Ступінь перетворення реагентів в реакторі визначається за формулою:
ХА=(СА -СА)/СА (3.3)
де СА - початкова концентрація вихідного реагенту, моль/л
СА- кінцева концентрація вихідного реагенту, моль/л
В даній роботі проводяться дослідження реактору ідеального змішування на прикладі взаємодії розчинів 0,1н етилацетату та 0,1н лугу .
Концентрація вихідного реагенту NaOH по ходу протікання перемішування визначається за формулою:
![]() (3.4)
(3.4)
де СNaOH – концетрація реагенту, моль/л
VHCl – об`єм HCl на титрування,мл
TNaOH – титр NaOH
К=1
Vал – аліквота, мл.
![]() ,
(3.5)
,
(3.5)
де CHCl – концентрація HCl ,моль/л
MNaOH – молекулярна маса NaOH ,г
