
- •Визначення залежності швидкості хімічних реакцій від різних умов
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •4.1. Вплив температури на швидкість реакції.
- •4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
- •4.3. Вплив каталізатора на швидкість хімічної реакції,
- •4.4. Вплив інгібітору на швидкість хімічної реакції.
- •5. Вимоги до звіту
- •6. Техніка безпеки
- •7. Контрольні питання
- •8. Література
- •Вивчення моделі проточного трубчастого реактора
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади і посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Вивчення моделі реактору ідеального змішування
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2.Хімічні реактиви, прилади, посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання нафтопродуктів прямою перегонкою нафти
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •Визначення густини пікнометром
- •Визначення в 'язкості
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи.
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Дослідження корозії металів
- •1. Теоретичні основи
- •Показники корозії металів
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •Отримання їдкого натрію (NаOh) і хлору електрохімічним методом
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання сульфату амонію
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Послідовність виконання роботи
- •3.1 Визначення твердості води
- •3.2 Визначення хлоридів
- •3.3 Визначення масової концентрації двовалентного і тривалентного заліза
- •3.4 Визначення масової концентрації міді
- •3.5 Визначення масової концентрації хрому
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Одержання і дослідження конденсаційних смол (новолочна смола)
- •Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Очищення хімічних реагентів ( реактивів) методом прямої перегонки
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
5. Вимоги до звіту
У звіті коротко викладають теоретичні основи залежності хімічних реакцій від різних факторів, наводять схему установки, її опис, послідовність виконання роботи. Крім того, повинні бути наведені всі вихідні дані, одержані результати їх обробки, аналіз та висновки.
6. Техніка безпеки
1. У даній роботі виділяється водень, тому треба слідкувати, щоб поруч не було відкритого вогню.
2. Опускати гранули цинку треба по стінках, щоб не розбити дно пробірки.
3. Необхідно дотримуватися обережності при роботі з кислотами.
4. Щоб уникнути викиду рідини з манометричної трубки, слід додержуватися тієї кількості реактивів, які рекомендовані в методиці виконання роботи.
5. Після закінчення роботи з приладом пробірки слід вимити. Зберігати прилад необхідно в чистому вигляді.
7. Контрольні питання
1. Залежність швидкості хімічних реакцій від температури. Рівняння Арреніуса.
2. Залежність швидкості хімічної реакції від тиску і концентрації.
3. Змінювання енергії активації в присутності каталізатора.
8. Література
1. Загальна хімічна технологія: Підручник / В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В. Савчук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2005. – 552 с.
2. Мухленов И.П. Общая химическая технология. - М: Высшая школа, 1984.-256 с.
3. Кутепов О.М., Бондарева Т.И., "Беренгартен М.Г. Общая химическая технология. Учебник для вузов. - 2-е изд. испр. и доп. - М: Высшая школа, 1990. - 520 с.
ЛАБОРАТОРНА РОБОТА №2
Вивчення моделі проточного трубчастого реактора
Мета роботи: вивчення характеристик проточного трубчастого реактора.
1. Теоретичні основи
У реакторі ідеального витіснення (РІВ) всі частинки рухаються в заданому напрямку, не змішуючись, повністю витісняючи, подібно до поршня, частинки, які знаходяться попереду потоку (поршневий рух потоку).
Часовою характеристикою РІВ служить рівняння:
![]() ,
(2.1)
,
(2.1)
а також
![]() ,
(2.2)
,
(2.2)
тому що Dе →0,
де τ' – час перебування у реакторі будь-якого елементарного об'єму;
τсер – середній час перебування;
Dе – ефективний коефіцієнт дифузії;
VC – витрати реакційної суміші;
V - реакційний об'єм.
З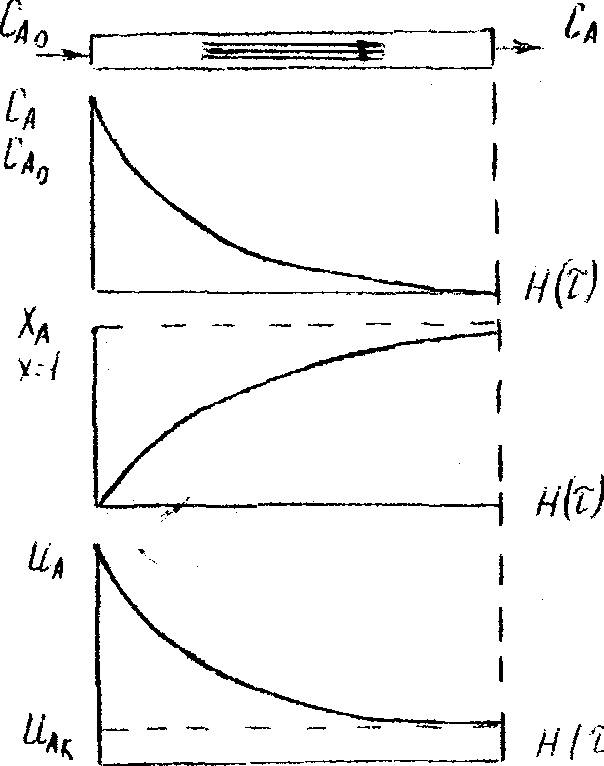 міни
концентрації реагентів уздовж реактора
в залежності від часу
міни
концентрації реагентів уздовж реактора
в залежності від часу
Зміни ступеня перетворення реагентів уздовж реактора в залежності від часу
Зміни швидкості реакції вздовж реактора в залежності від часу
Рисунок 2.1 - Епюра поршневого руху середовища
Матеріальний баланс (математична модель реактора) ідеального витіснення для стаціонарного режиму записується у вигляді рівняння:
![]() ,
(2.3)
,
(2.3)
де са - концентрація основного вихідного компонента А, моль/л;
ω - лінійна швидкість потоку, м/с;
Н – висота (довжина) реактора, м;
UA – швидкість реакції, моль (м3/с)
З рівняння витікає умова стаціонарності процесу. Швидкість надходження речовини А дорівнює швидкості цієї речовини за хімічною реакцією.
Для розрахунку РІВ використовують рівняння, виведене на підставі матеріального балансу реактора:
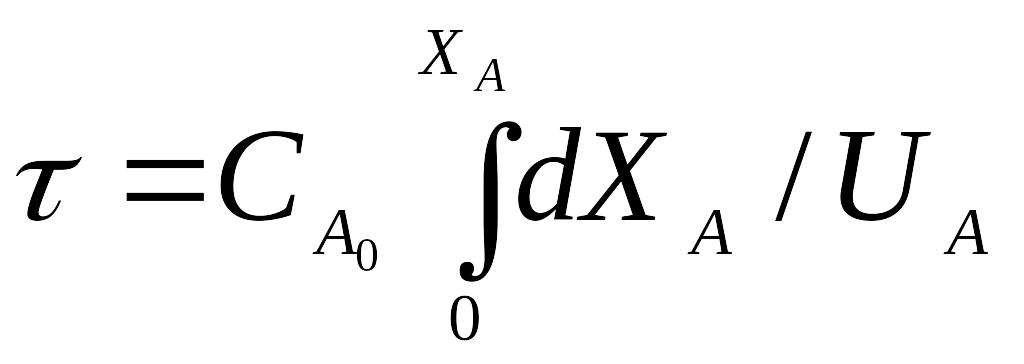 ,
(2.4)
,
(2.4)
де τ – час перебування основного компонента А, с;
са - початкова концентрація компонента А, моль/л;
Х – ступінь перетворення.
У режимі, близькому до ідеального витіснення, працюють поточні трубчасті реактори, в яких відношення довжини реактора до його діаметра:
L /D > 10.
У реальному реакторі може відбуватися зворотне осьове і радіальне перемішування. Дифузійна модель трубчастого реактора, яка враховує осьове (поздовжнє) перемішування, має вигляд:
![]() .
(2.5)
.
(2.5)
Відхилення режиму руху реакційної маси у реальному реакторі від ідеального реактора залежить від коефіцієнта поздовжнього перемішування D, швидкості потоку ω та довжини реактора L. Визначити це відхилення можна, порівнюючи об'єми ідеального і реального реакторів (або час перебування реакційної маси в тому чи іншому реакторі) для досягнення однакового ступеня перетворення реагентів.
У даній роботі проводиться дослідження реактора витіснення на прикладі реакцій другого порядку - омилення етилацетату лугом,
CH3COOH + NaOH ←→ CH3COONa + C2H5OH (2.6)
(за вказівкою викладача може статися заміна реагентів).
