
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
6.3 Задачі для самостійного вирішення
Задача1.
Константа швидкості окислення діоксиду сірки на платиновому каталізаторі при 938 До рівна 7,36 с-1. Підрахувати передекспоненційний множник К0 в рівнянні Арреніуса, якщо енергія активації реакції на даному каталізаторі рівна 63 кДж/моль.
Задача 2.
Підрахувати константу швидкості омилення уксусноетилового ефіру:
СН3СООС2Н5 + NaOH = СН3СООNa + С2Н5OH, якщо:
а) це одностадійна реакція;
б) початкова концентрація ефіру і лугу – по 16 кмоль/м3;
в) через 5 мін в результаті реакції концентрація кожного з них знизилася до 10,24 кмоль/м3.
Задача3.
Перекис водню (пероксид водню), початкова концентрація якої рівна 25,4 кмоль/м3, розкладається у присутності каталізатора. Через 15 мін концентрація її в розчині склала 9,83 кмоль/м3, а через 30 мін – 3,01 кмоль/м3. Визначити порядок реакції.
Задача 4.
Початкова речовина А через 1 з від початку реакції розклалося на половину. Підрахувати, яка частина його залишиться до кінця другої секунди, якщо встановлено, що реакція протікає по мономолекулярному механізму.
Задача 5.
Дослідження поведінки радіоактивного препарату показало, що за 20 днів активність його зменшилася на 8,5 %. Визначити константу швидкості розпаду препарату, період напіврозпаду і підрахувати, через який проміжок часу він розкластися на 95%.
Задача 6.
Речовини А і В вступають в хімічну взаємодію один з одним. Визначити порядок реакції по речовині А, якщо через 10 мін воно прореагувало на 46,7 %, а через 30 мін – на 77%. У початковий момент( = 0) перетворення речовини А вже складало 19,8 %.
Задача7.
При
дослідженні при 298 К реакції лактонізації
![]() - оксибутанової кислоти б
- оксибутанової кислоти б ула
одержана наступна залежність концентрації
кислоти від часу:
ула
одержана наступна залежність концентрації
кислоти від часу:
•10-3 0 1,2 3,0 4,8 9,0 15 18
СА, г/дм3 18,5 16,2 13,4 11,3 8,3 6,3 5,8
Рівноважна концентрація речовини А рівна 5 г/дм3 СВ0 = 0. Визначити К1 і К2 і константу рівноваги Кс.
Задача 8.
Визначити передекспоненційний множник в рівнянні Арреніуса і енергію активації окислення діоксиду сірки на ванадієвому каталізаторі, якщо константа процесу швидкості 1,03•10-5 с-1 Па-1 при 723 К і 1,94•10-5 с-1 Па-1 при 773 К.
Задача 9.
При 308 К швидкість хімічної реакції в 8,5 рази менше ніж при 363 К. Визначити енергію активації процесу.
Задача 10.
Перетворення речовини А в речовину В (n = 1) при 333 К пройшло за 10 хв на 75 %. Обчислити константу швидкості реакції.
Задача 11.
При взаємодії 0,56 моль гідроксиду натрію з 0,31 моль уксусноетилового ефіру кількість цих речовин в реакційній суміші змінюються таким чином:
Час ,с 0 393 670 1000
Гидроксид натрію, міль 0,56 0,49 0,45 0,41
Уксусноетіловий ефір 0,31 0,23 0,19 0,16
Визначити порядок реакції і константу швидкості цієї реакції.
Задача 12.
Підрахувати, в скільки разів зросте швидкість хімічної реакції при проведенні її у присутності каталізатора, якщо енергія активації некаталітичної реакції складає 420 кДж/моль, каталітичної – 60 кДж/моль. Температура процесу в обох випадках 693К.
Задача 13.
Визначити збільшення швидкості прямої реакції окислення діоксиду сірки на ванадієвому каталізаторі при підвищенні температури від 693 до 703 К. Енергия активації каталітичної реакції дорівнює 60 кДж/моль.
Задача 14.
Довести, що для простої оборотної екзотермічної реакції А=В функціональна залежність швидкості реакції від температури має максимум.
Задача 15.
Визначити,
як зміниться селективність реакції
![]()
по цільовому продукту D при збільшенні температури від 700 до 900 К, якщо енергія активації процесу отримання продукту D складає 240 кДж/моль, а продукту R – 216 кДж/моль.
Задача 16.
Константа швидкості розкладання речовини А у водному розчині при 283 К рівна 1,1•10-4 с-1, а при 333 К - 5,5•10-2 с-1. Підрахувати енергію активації цієї реакції.
Задача17.
Реакція другого порядку між речовинами А и В через 10хв завершується на 25%. Через який час ця реакція завершиться на 50%, якщо початкові речовини взяті в стехіометричному співвідношенні?
Задача18.
Швидкість реакції синтезу аміаку описується рівнянням Темкина-Пижева: WrNH3 = K1PN2(P3H2/ P2NH3)0.5- K2(P2NH3 / P3H2)0,5
Визначити:
1) вид залежності
 ;
;
2) відношення Н2 до N2, при якому швидкість реакції, що протікає далеко від рівноваги, буде максимальною.
Задача19.
Протікає послідовна реакція .Визначити момент, коли В досягає максимальної концентрації, якщо К2 = 2К1 = 7,18 •10-3 с-1.
Задача20.
Кінетичне рівняння реакції синтезу метанолу записується у вигляді:
![]()
Визначити: 1) вид залежності ; 2) відношення Н2 до СО, при якому швидкість реакції, що протікає далеко від рівноваги, буде максимальною.
Задача21.
Газофазна
реакція першого порядку
![]() проходить в реакторі періодичної дії
(V = const) за адіабатичних умов. СА
= 3,3•10-2
кмоль/м3.
Продукт реакції в початковій суміші
відсутній. Початкова температура газу
реакції в початковій суміші відсутня.
Початкова температура газу Т0
= 347 К. При адіабатичних умовах:
проходить в реакторі періодичної дії
(V = const) за адіабатичних умов. СА
= 3,3•10-2
кмоль/м3.
Продукт реакції в початковій суміші
відсутній. Початкова температура газу
реакції в початковій суміші відсутня.
Початкова температура газу Т0
= 347 К. При адіабатичних умовах:

де: СR – концентрація продукту R, кмоль/м3.
Константа швидкості розпаду (вс-1) задана у вигляді апроксиомних рівнянь:
![]()
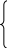 0,158(Т-330)+
0,11 при 347 До ?Т?350 До
0,158(Т-330)+
0,11 при 347 До ?Т?350 До
К(Т) = 0,306(Т-330) – 2,83 при 350 До?Т?362,5 До
0,55(Т-330) – 10,8 при 362,5 До?Т?366,7 До
Дати (у вигляді таблиці) залежність концентрації СR від тривалості процесу(до СR = 3•10-2 кмоль/м3).
Задача22.
Для розкладання іодида водню(реакція другого порядку) константа швидкості(м3/кмоль•с) дорівнює 3,516•10-7, при 556 К і 39,54•10-3 при 781 К.
Визначити енергію активації реакції і обчислити період напіврозпаду іодида водню(при 373 К і початкової концентрації 1 моль/м3).
Задача23.
Газова суміш складається з оксиду азоту (II) і повітря. Знайти концентрацію кисню в газовій суміші, при якій оксид азоту окислюватиметься з максимальною швидкістю. Температура газу менше 423К, тобто процес практично необоротній.
Задача24.
Визначити енергію активації реакції, якщо швидкість її при 873 К більше, ніж при 673 К в 9 разів.
Задача24.
Швидкість
реакції
![]() описується рівнянням першого порядку
по кожному реагенту. Через 20 хв прореагувало
20% речовини А. Яка частина речовини А
залишиться через 40 хв від початку
реакції?
описується рівнянням першого порядку
по кожному реагенту. Через 20 хв прореагувало
20% речовини А. Яка частина речовини А
залишиться через 40 хв від початку
реакції?
Тема 7
