
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
Визначення складу рівноважної суміші для процесів, що супроводжується декількома реакціями, полягає в розв’язанні системи рівнянь, складених за допомогою закону діючих мас для кожного із рівнянь базових реакцій. Базові реакції – це реакції, за допомогою констант рівноваги яких можна виразити константи рівноваги всіх реакцій, що протікають в системі.
Приклад 5.3
При конверсії метану водяним паром в трубчатій печі (І ступінь конверсії) протікають наступні реакції:
![]() (5.4)
(5.4)
![]() (5.5)
(5.5)
(5.6)
![]() (5.7)
(5.7)
Температура
процесу 1100 К, тиск 3,0 МПа. Вихідна суміш,
що подається на конверсію, об’ємна
частка, %:![]() -
19;
- 78;
- 2;
-
19;
- 78;
- 2;
![]() - 1.
- 1.
Розв’язок
Визначимо базові реакції, що описують стан системи. Із виразів для констант рівноваги
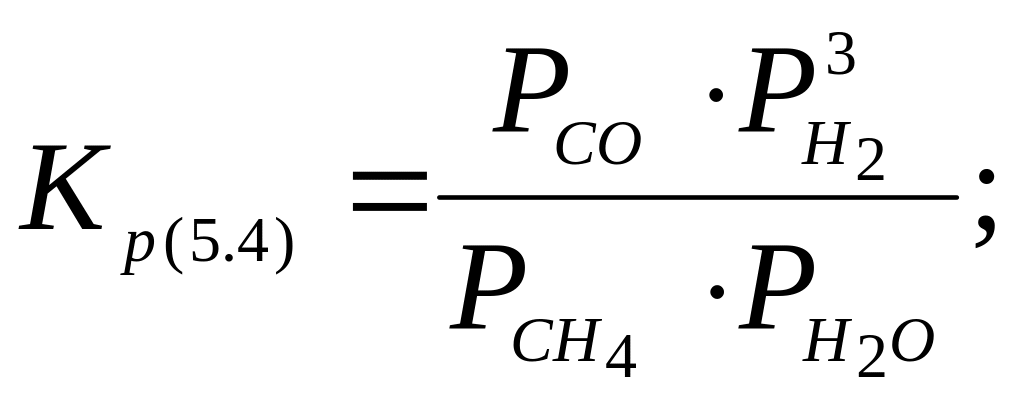
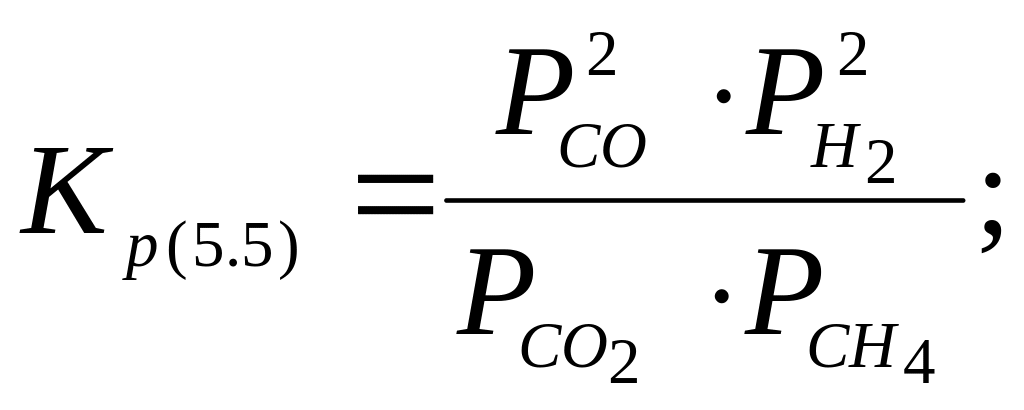
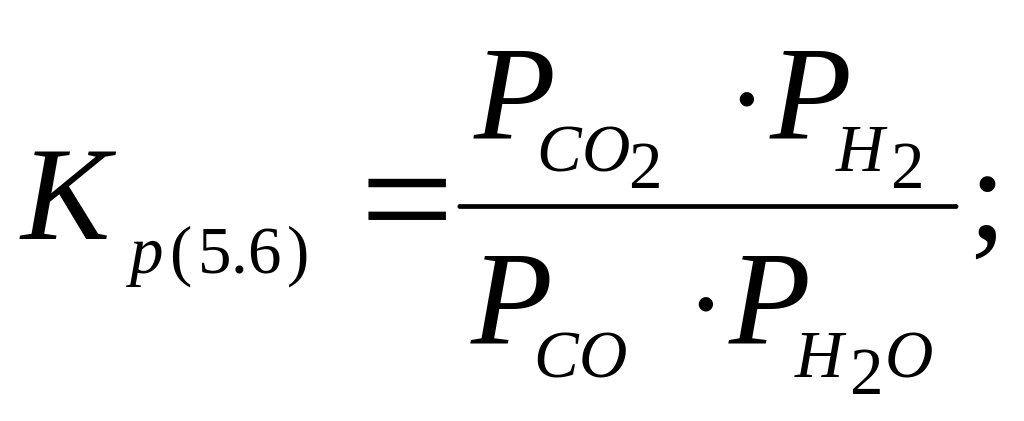
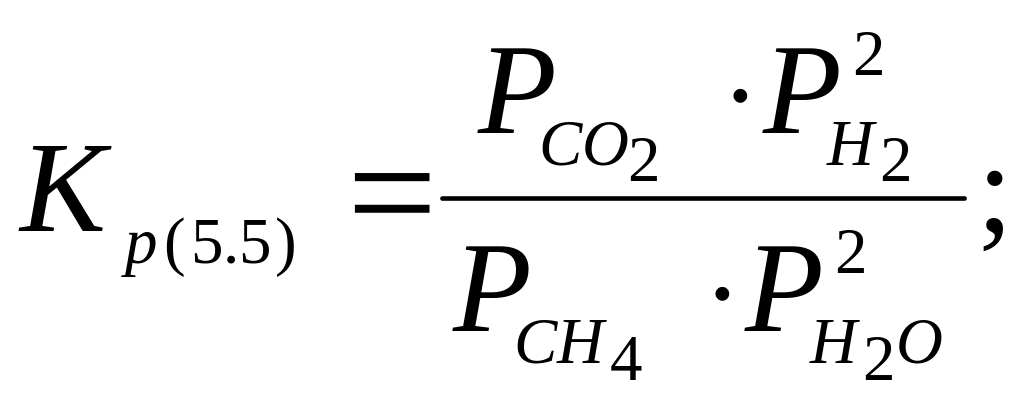
видно,
що
![]()
![]() тобто
рівняння реакцій (5.4) і (5.6) характеризують
стан системи.
тобто
рівняння реакцій (5.4) і (5.6) характеризують
стан системи.
Згідно
літературним даним, температурна
залежність констант рівноваги
![]() і
і
![]() представлена рівняннями:
представлена рівняннями:
![]() ;
;
![]() Константи
рівноваги при температурі 1100 К
=2,7·102;
=0,78.
складемо баланс кількості молей в стані
рівноваги.
Константи
рівноваги при температурі 1100 К
=2,7·102;
=0,78.
складемо баланс кількості молей в стані
рівноваги.
Таблиця 5.4 - Дані для розрахунку рівноважного складу
Статті розрахунку |
Компоненти, моль |
|||||
|
|
|
|
|
інерти |
|
Склад вихідної суміші |
19 |
78 |
2 |
0 |
0 |
1 |
Утворилось продуктів за реакцією (5.4) |
- |
- |
3z |
z |
0 |
- |
Витратилось речовин за реакцією (5.4) |
- z |
- z |
- |
- |
- |
- |
Утворилось продуктів за реакцією (5.6) |
- |
- |
у |
- |
у |
- |
Витратилось речовин за реакцією (5.6) |
- |
-у |
- |
-у |
- |
- |
Склад рівноважної суміші |
19- z |
78- z-у |
2+3 z+у |
z-у |
у |
1 |
Сума молей в стані рівноваги |
19 – z + 78 – z – у + 2 + 3z + у + z – у + у + 1=100 + 2z |
|||||
Для реакцій (5.4) і (5.6):
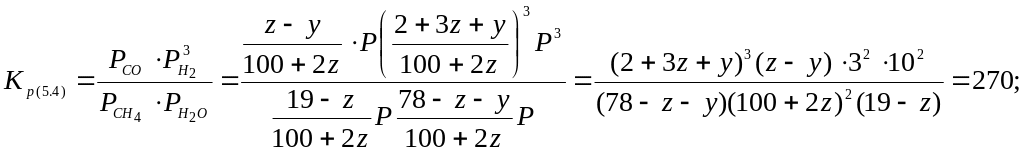
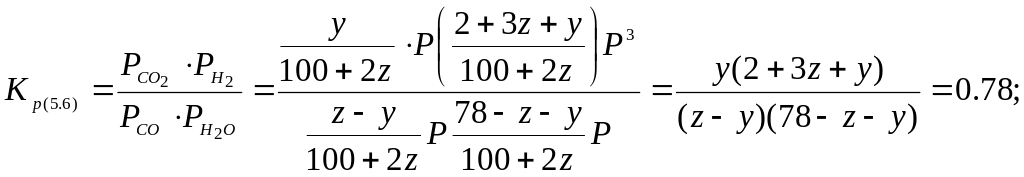
Отримали систему двох рівнянь з двома невідомими, яку розв’язуємо графічним методом або методом ітерації. Розв’язком системи рівнянь являється: z = 12,1; у = 7,5.
Склад
рівноважної суміші (в молях):
![]() =
19 – 12,1 = 6,9;
=
19 – 12,1 = 6,9;
![]() =78-12,1-7,5=58,4;
=2+3·12,1+7,5=45,8;
=78-12,1-7,5=58,4;
=2+3·12,1+7,5=45,8;
![]() =12,1-7,5=4,6;
=7,5;
інерти = 1; всього: 100 + 2·12,1 = 124,2.
=12,1-7,5=4,6;
=7,5;
інерти = 1; всього: 100 + 2·12,1 = 124,2.
5.3 Задачі для самостійного розв’язання
Задача 1.
Константа
рівноваги процесу окислення оксиду
сірки (ІV)
![]() описується
рівнянням
описується
рівнянням
![]()
Визначити склад рівноважної суміші і рівноважну степінь перетворення оксиду сірки (ІV). Склад вихідної суміші і температури процесу приведені в таблиці 5.5.
Таблиця 5.5 - Вихідні дані для розрахунків
Номер варіанту |
Вихідна суміш, об’ємні частки, % |
Температура, К |
|||
SO2 |
O2 |
N2 |
SO3 |
||
1 |
7,5 |
10,5 |
82 |
0 |
710 |
2 |
7,5 |
10,5 |
82 |
5,0 |
770 |
3 |
2,5 |
8,0 |
84,5 |
5,0 |
760 |
4 |
0,7 |
7,0 |
85,5 |
6,8 |
710 |
5 |
0,2 |
6,8 |
85,7 |
7,3 |
700 |
Задача 2.
Розрахувати вихід бутадієну (дивінілу) в реакції
![]()
при Т = 600 К і 0,05 МПа. Вихідна суміш спирту і ацетальдегіду еквімолекулярна. Константу рівноваги розрахувати за рівнянням Шварцмана-Тьомкіна.
Задача 3. Залежність константи рівноваги від температури реакції дегідрування вторинного бутилового спирту має вигляд:
![]() .
.
Визначити склад рівноважної суміші, який отримається в результаті реакції
![]()
при Т = 600 К і Р = 0,2 МПа. Вихідна суміш: 2 моль вторинного бутилового спирту і 1 моль водню.
Задачі 4,5
Отримання оцтовоетилового ефіру здійснюється в газовій фазі із оцтової кислоти і етилового спирту за реакцією
![]()
Константа рівноваги реакції Кр = 15,0.
Задача 4.
Показати, чи збільшиться степінь перетворення оцтової кислоти при збільшенні тиску від 0,1 до 5 МПа, якщо співвідношення вихідних речовин є еквімолярним.
Задача 5.
Показати, чи можна збільшити степінь перетворення більш дорожчої оцтової кислоти під тиском в системі 0,1 МПа шляхом зміни співвідношення реагентів у вихідній суміші.
Задачі 6 – 8
Дегідрування етилбензолу в стирол протікає в газовій фазі за реакцією
![]() .
.
Константу
рівноваги реакції розрахувати за
![]() .
.
Задача 6.
Показати, яким чином впливає загальний тиск в системі на процес дегідрування при температурі 850 К.
Який тиск ви оберете для проведення процесів: 0,1 МПа чи 10 МПа?
Задача 7.
Для збільшення степені перетворення етилбензолу, згідно раціоналізаторській пропозиції, процес необхідно вести в парах води, що являються інертним розчинником, при 10-кратному розчиненні. Температура процесу пропонується незмінною – 850 К. Доведіть ефективність рацпропозиції за допомогою розрахунків порівняння з процесом без розчинення етилбензолу.
Задача 8.
Доведіть розрахунковим шляхом, чи можна збільшити рівноважну степінь перетворення етилбензолу при зміні температури процесу на ± 150 К.
Задачі 9 – 11
Гідрування
бензолу в циклогексан описується
рівнянням оборотної реакції
![]() .
Залежність константи рівноваги реакції
характеризується рівнянням
.
Залежність константи рівноваги реакції
характеризується рівнянням
![]()
Процес гідрування проводять при температурі 525 К.
Задача 9.
Довести
розрахунковим шляхом, чи буде впливати
тиск на рівноважну степінь перетворення,
якщо вихідна суміш (об’ємна частка, %):
![]() =30,
=68,
=30,
=68,
![]() =2.
=2.
Задача 10.
Показати кількісну зміну рівноважної степені перетворення бензолу при збільшенні концентрації водню в суміші до 80 % (об’ємна частка при тому ж складі (див. задачу 9) циклогексану у вихідній суміші (об’ємна частка – 2 %) і тиску 1,0 МПа.
Задача 11.
Довести розрахунковим шляхом, чи раціонально збільшувати температуру процесу для збільшення степені перетворення бензолу при тискові 1,0 МПа. Склад вихідної суміші приведений в задачі 9.
Задачі 12, 13
Отримання формальдегіду здійснюється в промисловості в процесі сумісного окислення і дегідрування метанолу згідно рівнянням реакції:
![]()
![]()
![]()
Температура процесу 800 К, тиск 0,1 МПа. Константи рівноваги розрахувати за значеннями реакцій. Об’ємна частка метанолу у вихідній метанольно-повітряній суміші – 45 %.
Задача 12.
Визначити рівноважну степінь перетворення метанолу.
Задача 13.
Визначити рівноважну концентрацію формальдегіду в реакційній суміші.
Задачі 14 – 17
Один із найбільш крупнотоннажних продуктів органічного синтезу – етиловий спирт отримують в процесі прямої гідратації етилену в паровій фазі за реакцією
![]() .
.
Процес здійснюють в присутності каталізатора при 560 К і тискові 8МПа. Константу рівноваги розраховують за реакції.
Задача 14.
Довести розрахунковим шляхом, чи зміниться рівноважна степінь перетворення при збільшенні концентрації водяної пари у вихідній суміші від еквімолекулярного до двократного надлишку.
Задача 15.
Визначити концентрацію спирту-сирцю після конденсації реакційної суміші при заданих умовах процесу і трьохкратному надлишку парів води.
Задача 16.
Побудувати залежність рівноважної степені перетворення етилену від тиску в інтервалі 2…10 МПа при температурі 560 К і двократному надлишку пари. Пояснити отримані дані з використанням принципу Ле-Шательє.
Задача 17.
Побудувати залежність рівноважної степені перетворення етилену від температури в інтервалі 525…625 К при тискові 8 МПа і двократному надлишку водяної пари. Пояснити отримані результати з використанням принципу Ле-Шательє.
Задача 18.
Визначити співвідношення пара-повітря в продув очній суміші при безперервній газифікації кам’яного вугілля. Процес газифікації супроводжується реакціями:
![]() (5.8)
(5.8)
(5.9)
Газ
на виході із газогенератора має
температуру 1073 К і в об’ємних частках,
%:
-
48;
- 32;
-
8;
-
7;
-
5. Температурна залежність
![]() описується рівнянням
описується рівнянням
![]()
Рівняння
для
![]() наведено
в прикладі 5.3.
наведено
в прикладі 5.3.
Задача 19.
Синтез
НС1 здійснюють із елементів при температурі
2570 К. визначити, при якому надлишку
водню у вихідній суміші степінь
перетворення хлору досягає 99,99 %. Скільки
НС1 (об’ємна частка, %) буде в рівноважній
суміші? Константу рівноваги процесу
визначити при заданій температурі за
температурною залежністю
реакції
![]() .
.
Задачі 20 – 21
Для синтезу використовують вихідну суміш з еквімолярним співвідношенням водню і азоту.
Константа рівноваги реакції описується рівнянням
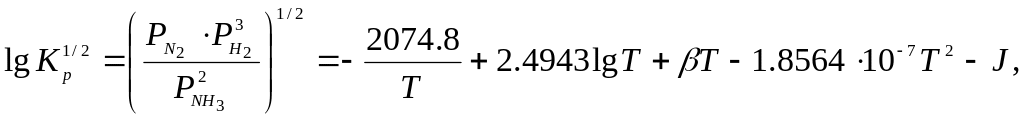
де
коефіцієнти
![]() і
і
![]() залежать від тиску.
залежать від тиску.
Р, Мпа |
|
|
1,0 |
0 |
1,993 |
3,0 |
3,4 · 10-5 |
2,021 |
5,0 |
1,26 · 10-4 |
2,090 |
10,0 |
1,26 · 10-4 |
2,113 |
30,0 |
1,26 · 10-4 |
2,206 |
60,0 |
1,086 · 10-3 |
3,059 |
Задача 20.
Побудувати залежність концентрації аміаку в рівноважній суміші в інтервалі тисків 1…60 МПа при температурі 753 К, якщо об’ємна частка інертних домішок у вихідній суміші рівна 10 %. Пояснити отримані результати з використанням принципу Ле-Шательє.
Задача 21. Довести, що збільшення температури негативно впливає на процес синтезу аміаку. Чому? Чим пояснюється проведення синтезу аміаку при температурі 720 К?
