
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
Залежність швидкості реакції від температури характеризують величиною температурного коефіцієнта а(Т), який визначають як зростання швидкості при збільшенні температури на 100:
![]() (6.33)
(6.33)
Проте найбільшого розповсюдження одержав вираз температурної залежності швидкості реакції у вигляді рівняння Арреніуса. Воно визначає залежність константи швидкості від температури у вигляді:
![]() (6.34)
(6.34)
Енергія активації може бути визначена, якщо відома константа швидкості простої реакції при декількох температурах. Дійсно, якщо К1 і К2-константы швидкості реакції при температурах (К) Т1 і Т2, то
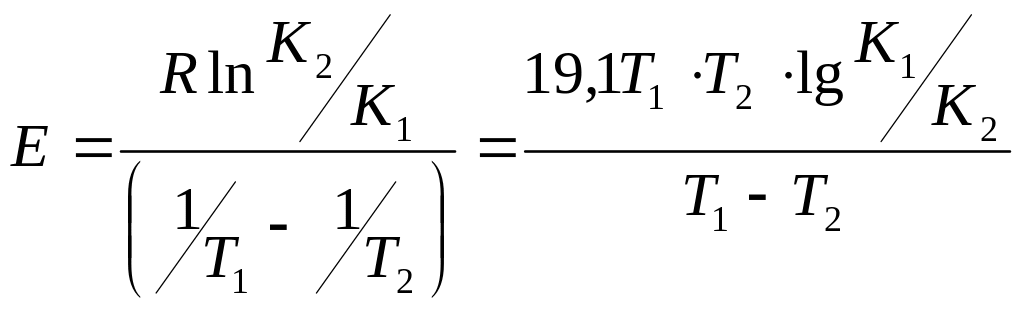 (6.35)
(6.35)
У разі складних, багатостадійних реакцій параметр Е не має простого фізичного значення і є деякою функцією енергій активації окремих стадій або взагалі емпіричною величиною.
Якщо відомі значення константи швидкості при температурі Т і енергії активації реакції, то передекспоненціальний множник К0 визначається наступним рівнянням:
![]() (6.36)
(6.36)
Приклад 6.3.
При 777 К протікає реакція термічного розпаду діоксана в газовій фазі:
![]()
При
двох різних початкових тисках діоксана:
1,06•105Па і 0,533•105Па зафіксовані початкові
швидкості процесу
![]() =94,4Па/с1
і
=94,4Па/с1
і
![]() =32,6Па/с1
і час напівперетворень:
=32,6Па/с1
і час напівперетворень:
![]() =834с,
=834с,
![]() =1140с.
Встановити порядок реакції.
=1140с.
Встановити порядок реакції.
Розв`язок.
Оскільки в дослідах з різною початковою концентрацією діоксана τ0,5 не є постійним, то рівняння кінетики – не першого порядку (див.п.6.2.1.1.). для розрахунку n можна скористатися формулами (6.29) і (6.30):
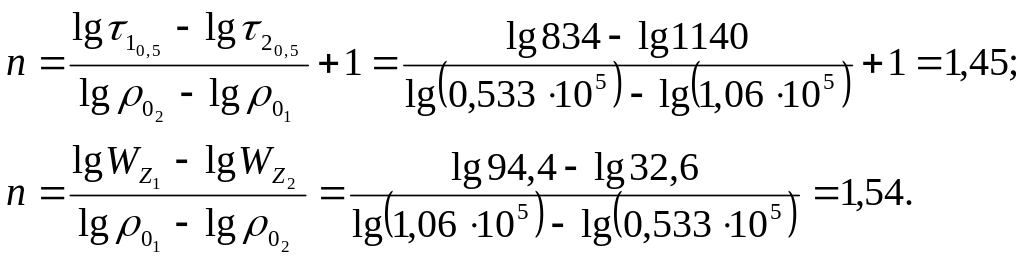
Таким чином, обидва методи дали значення n близько 1,5.
Приклад 6.4.
При дослідженні реакції взаємодії трифенолметилхлорида з метанолом
CH3OH+(C6H5)3CCl = (C6H5)3COCH3+HCl
у безводному бензолі ( у присутності піридину) при 298К, початковій концентрації трифенолметилхлорида 0,106 кмоль/м3 і початковій концентрації метанолу 0,054кмоль/м3 були одержані наступні дані:
Час τ•10-4, з |
1,008, |
1,044, |
2,508, |
2,556 |
2,664, |
6,90, |
9,06 |
Кількість (C6H5)3CCl, що прореагувало до моменту часу τ, з розрахунку на одиницю об'єму Сх, кмоль/м3 |
0,0091, |
0,011, |
0,0131, |
0,0189 |
0,0207, |
0,0318, |
0,0345 |
Визначити константу швидкості реакції.
Рішення.
Припустимо, що дана реакція - другого порядку.
Тоді рівняння швидкості можна записати таким чином:
![]() ,
,
де СА, СВ – поточні концентрації відповідно метанолу і трифенолметилхлорида.

для лівої частини застосовуємо метод інтеграції раціональних функцій:

Звідси
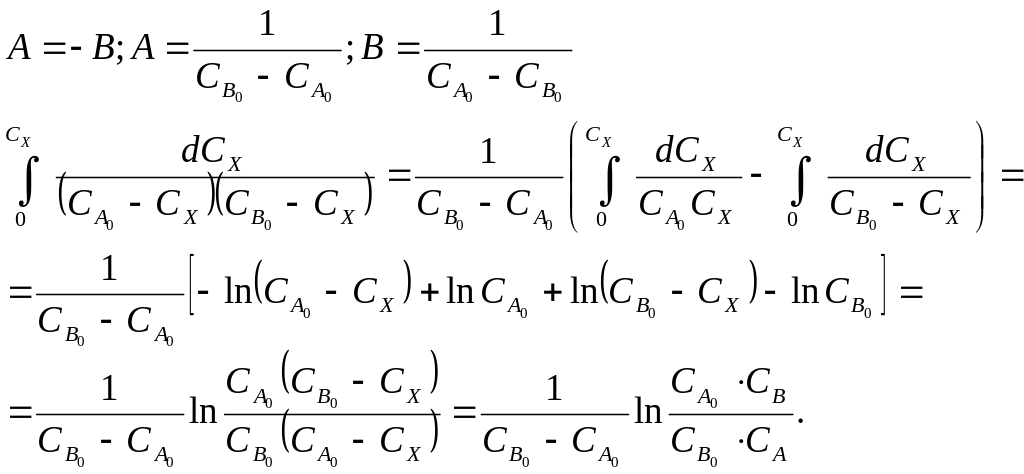
Таким чином, інтегральна форма кінетичного рівняння матиме вигляд:
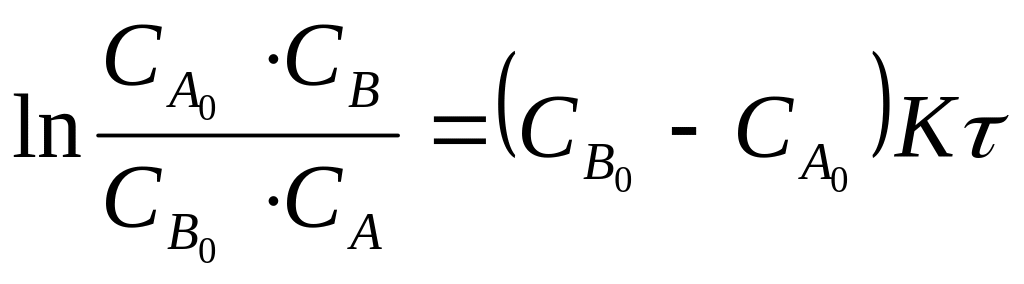
По цьому рівнянню розраховуємо константу швидкості реакції До:
τ•10-4, з |
1,008 |
1,044 |
2,508 |
2,556 |
2,664 |
6,90 |
9,06 |
К•10-4, (кмоль•м-3) -1•с-1 |
1,857 |
2,179 |
1,693 |
1,759 |
1,927 |
1,482 |
1,325 |
Величини розрахованої До значно відрізняються один від одного, тому припускаємо, що дана реакція має перший порядок по трифенолметилхлориду і другий по метанолу.
Інтегральна форма кінетичного рівняння матиме вигляд (висновок аналогічний попередньому):

По цьому рівнянню розраховуємо константу швидкості К:
τ•10-4, з |
1,044 |
2,556 |
2,664 |
6,90 |
9,06 |
К•103, (кмоль • •м-3)-2с-1- |
4,54 |
4,48 |
4,59 |
4,54 |
4,42 |
На підставі цих даних К=4,514•10-3(кмоль•м-3)-2•с-1.
Кінетичне
рівняння реакції має вигляд:
![]() .
.
Приклад 6.5.
У скільки разів збільшиться швидкість розчинення заліза в 5%-ний хлороводневій кислоті при підвищенні температури з 291 до 305 До, якщо температурний коефіцієнт швидкості розчинення а(Т)=2,8?
Рішення.
Збільшення швидкості реакції визначатиметься відношенням констант швидкостей при даних температурах. З рівняння (4.33) маємо:
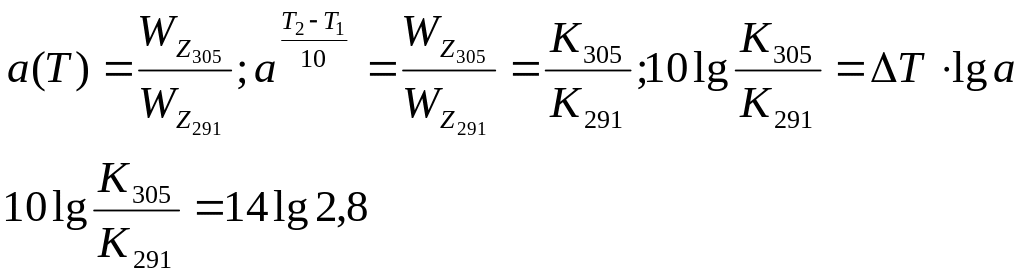
Звідки
![]() =4,22.
=4,22.
Отже, швидкість реакції збільшиться в 4,22 рази.
