
- •1. Органическая химия: определение, задачи
- •2. Классификация органических сединений
- •3. Теория строения Бутлерова
- •4. Взаимное влияние атомов в молекуле и её природа
- •5. Эффекты сопряжения и сверхсопряжения
- •6. Предельные углеводороды
- •7. Химические свойства предельных углеводородов
- •1.Радикальное галогенирование
- •2. Нитрование
- •3.Сульфирование, сульфоокисление, сульфохлорирование
- •4.Окисление
- •5.Крекинг углеводородов при высоких температурах
- •8. Этиленовые углеводороды
- •9. Общая характеристика алкенов
- •10. Ацетиленовые углеводороды
- •11. Химические свойства ацетиленовых углеводородов
- •2.Галогенирование
- •3.Гидрогалогенирование
- •9. Полимеризация
- •12.Типы диеновых углеводородов
- •1.Гидрирование
- •2.Галогенирование
- •13. Алициклические углеводороды
- •14. Современные представления об устойчивости циклов
- •15. Ароматические углеводороды
- •16. Строение бензола
- •17. Химические свойства ароматических углеводородов
- •1.Реакции присоединения
- •2.Реакции окисления
- •3.Реакции замещения
- •18. Механизм электрофильного замещения в ряду бензола
- •19. Правила ориентации в ряду бензола
- •20. Галогенопроизводные углеводородов
- •21. Химические свойства галогенопроизводных
- •2.Реакции замещения
- •3.Реакции по бензольному кольцу
- •22. Нитросоединения
- •23. Амины
- •24. Спирты и фенолы
- •25. Карбонильные соединения
- •26. Общие и отличительные свойства альдегидов и кетонов
- •27. Карбоновые кислоты
- •28. Химические свойства карбоновых кислот
- •29. Гетероциклические соединения
- •30. Липиды
- •31. Простые липиды
- •32. Углеводы
- •33. Моносахариды
- •34. Дисахариды
- •35. Высокомолекулярные полисахариды
- •36.Аминокислоты
- •37. Пептиды
- •38. Белки
- •39. Способы получения оксикислот
- •40. Способы получения оксокислот
- •Способы получения
- •Химические особенности
14. Современные представления об устойчивости циклов
Для циклоалканов помимо структурной и стереоизомерии (цис-, транс- и оптической) существенное значение имеет также поворотная изомерия. Устойчивость конформеров алициклических соединений определяют четыре фактора:
1. Напряжение, обусловленное искажением валентных углов – угловое напряжение (напряжение Байера).
2. Торсионное напряжение, связанное с отклонением от наиболее выгодной «заторможенной» конформации (см. главу 2).
3. Напряжение, связанное с отталкиванием сближенных атомов.
4. Напряжение, обусловленное изменением межатомных расстояний.
Первые общие теоретические соображения, касающиеся относительной устойчивости различных циклов, были высказаны Байером в 1885 году на основе представления Вант-Гоффа о тетраэдрической модели атома углерода. Байер исходил из двух предположений: во-первых, о том, что циклические структуры должны быть плоскими, а во-вторых, что отклонение валентных углов от угла 109о28′ является мерой напряженности цикла.
Например, для треугольника:
![]()
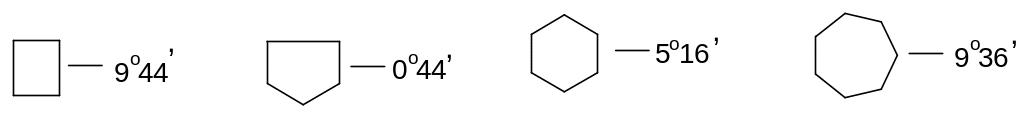 Мера
напряженности цикла обуславливает
легкость или трудность образования
цикла и его относительную устойчивость.
Таким образом, по Байеру, наиболее
устойчивым должен быть пятичленный
цикл, а следующим по устойчивости
шестичленный. Высшие циклы должны быть
малоустойчивы. В дальнейшем оказалось,
что этот вывод неверен, так как было
доказано, что плоское строение характерно
в чистом виде только для циклопропана.
Это наиболее напряженная циклическая
система.
Мера
напряженности цикла обуславливает
легкость или трудность образования
цикла и его относительную устойчивость.
Таким образом, по Байеру, наиболее
устойчивым должен быть пятичленный
цикл, а следующим по устойчивости
шестичленный. Высшие циклы должны быть
малоустойчивы. В дальнейшем оказалось,
что этот вывод неверен, так как было
доказано, что плоское строение характерно
в чистом виде только для циклопропана.
Это наиболее напряженная циклическая
система.
В молекуле циклогексана сохраняются обычные валентные углы, так как он существует в пространственных конформациях «кресла» или «ванны». Конформация «кресла» на 20,9 кДж/моль менее напряжена. Эта разница в напряжении обусловлена торсионным напряжением:

15. Ароматические углеводороды
Ароматические углеводороды составляют многочисленный класс циклических углеводородов с делокализованными π-электронами. Эта делокализация обусловлена сопряжением двойных связей. Простейшие из них содержат одно бензольное кольцо (С6Н6), которое принято обозначать правильным шестиугольником с чередующимися простыми и двойными связями или шестиугольником с внутренней окружностью, символизирующей делокализацию π-электронов.
Эта группировка атомов оказывает влияние на физические и химические свойства ароматических соединений, т.е. определяет так называемый «ароматический характер».
В химическом отношении ароматические соединения проявляют ряд особенностей, которые принято называть термином «ароматические свойства»:
1. Легкость образования ароматических колец в самых различных реакциях;
2. Устойчивость к действию окислителей не смотря на наличие трех двойных связей;
3. Трудность протекания реакций присоединения по кратным связям;
4. Легкость замещения водорода различными группами в реакциях электрофильного замещения;
5. Характерными свойствами обладают и некоторые заместители в ароматических соединениях:
а) кислые свойства ароматического гидроксила;
б) ослабленная основность аминогруппы;
в) малая подвижность галогена в ядре;
г) способность к реакциям азосочетания.
Простейшим представителем ароматических соединений является бензол. Ближайший гомолог бензола – толуол, также не имеет изомеров. Следующий гомолог имеет четыре изомера
Изомерия ароматических углеводородов гомологического ряда бензола связана:
1) с изомерией положения радикалов;
2) с изомерией радикалов.

бензол толуол о-ксилол м-ксилол п-ксилол этилбензол
Два радикала могут занимать в ядре три положения, носящие название орто (1,2)-, мета (1,3)-, и пара (1,4)-.
Из более сложных углеводородов тривиальные названия сохранили:

кумол цимол
изопропилбензол 1-метил-4-изопропилбензол
Для ароматических соединений используется и систематическая номенклатура (ИЮПАК). По этой номенклатуре все соединения рассматриваются как производные бензола и цифрами указываются положения заместителей.
Способы получения
Ароматические углеводороды ряда бензола содержатся в некоторых сортах нефти. Помимо этого, так как ядро бензола энергетически очень «выгодная» система, соединения ароматического ряда образуются при многих процессах. Так, например, при каталитическом и термическом крекинге нефти они образуются в заметных количествах. При переработке каменного угля в кокс в каменноугольной смоле содержание ароматических соединений достигает нескольких десятков процентов (бензол, толуол, ксилолы, фенол, нафталин, антрацен).
В лабораторной практике и в промышленности для синтеза аренов применимы следующие способы:
1. Ароматизация парафинов на оксиде хрома

2. Ацетилен и его гомологи при температуре красного каления, а в присутствии катализаторов и при более низкой температуре образуют ароматические углеводороды

Мезитилен
3. Дегидрирование циклоалканов, содержащих шестичленное кольцо
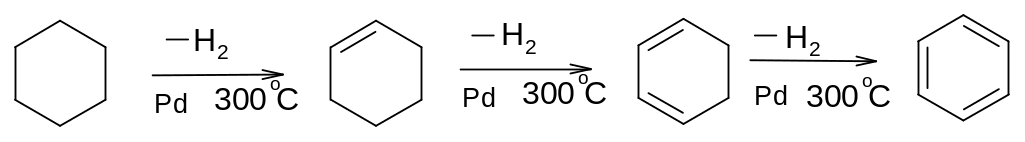
циклогексан циклогексен циклогексадиен бензол
4. Сплавление солей бензойной кислоты со щелочами

5. Гомологи бензола можно получить:
а) из галогенопроизводных реакцией Вюрца-Фиттига
 хлорбензол
хлорметан толуол
дифенил этан
хлорбензол
хлорметан толуол
дифенил этан
б) реакцией Фриделя-Крафтса

В качестве катализатора в реакции Фриделя-Крафтса используют безводные хлориды тяжелых металлов и алюминия, а также фтористый водород.
в) восстановлением ароматических кетонов амальгамированным цинком в соляной кислоте:

хлористый ацетил ацетофенон этилбензол
