
- •1. Органическая химия: определение, задачи
- •2. Классификация органических сединений
- •3. Теория строения Бутлерова
- •4. Взаимное влияние атомов в молекуле и её природа
- •5. Эффекты сопряжения и сверхсопряжения
- •6. Предельные углеводороды
- •7. Химические свойства предельных углеводородов
- •1.Радикальное галогенирование
- •2. Нитрование
- •3.Сульфирование, сульфоокисление, сульфохлорирование
- •4.Окисление
- •5.Крекинг углеводородов при высоких температурах
- •8. Этиленовые углеводороды
- •9. Общая характеристика алкенов
- •10. Ацетиленовые углеводороды
- •11. Химические свойства ацетиленовых углеводородов
- •2.Галогенирование
- •3.Гидрогалогенирование
- •9. Полимеризация
- •12.Типы диеновых углеводородов
- •1.Гидрирование
- •2.Галогенирование
- •13. Алициклические углеводороды
- •14. Современные представления об устойчивости циклов
- •15. Ароматические углеводороды
- •16. Строение бензола
- •17. Химические свойства ароматических углеводородов
- •1.Реакции присоединения
- •2.Реакции окисления
- •3.Реакции замещения
- •18. Механизм электрофильного замещения в ряду бензола
- •19. Правила ориентации в ряду бензола
- •20. Галогенопроизводные углеводородов
- •21. Химические свойства галогенопроизводных
- •2.Реакции замещения
- •3.Реакции по бензольному кольцу
- •22. Нитросоединения
- •23. Амины
- •24. Спирты и фенолы
- •25. Карбонильные соединения
- •26. Общие и отличительные свойства альдегидов и кетонов
- •27. Карбоновые кислоты
- •28. Химические свойства карбоновых кислот
- •29. Гетероциклические соединения
- •30. Липиды
- •31. Простые липиды
- •32. Углеводы
- •33. Моносахариды
- •34. Дисахариды
- •35. Высокомолекулярные полисахариды
- •36.Аминокислоты
- •37. Пептиды
- •38. Белки
- •39. Способы получения оксикислот
- •40. Способы получения оксокислот
- •Способы получения
- •Химические особенности
1.Гидрирование
Каталитически возбужденный водород присоединяется в 1,2- и 1,4-положения:

2.Галогенирование
Галогены также способны присоединяться к сопряженным системам в 1,2- и 1,4-положения:

Как и в случае этиленовых углеводородов, присоединение может проходить как по ионному, так и по радикальному механизму.
При ионном механизме присоединения первоначально возникающий π-комплекс (I) быстро превращается в сопряженный карбониевый ион с положительным зарядом на втором и четвертом углеродных атомах. Этот ион можно изобразить или двумя граничными формулами (II) или одной формулой (III). Этот карбкатион присоединяет анион галогена с образованием продуктов 1,2- и 1,4-присоединения:

3.Гидрогалогенирование
В реакциях присоединения галогеноводородов действуют те же закономерности:

4.Гипогалогенирование
Гипогалогенитные кислоты и их эфиры присоединяются преимущественно в 1,2-положение:

5.Димеризация
При нагревании молекулы диеновых углеводородов способны присоединяться друг к другу таким образом, что одна из них реагирует в 1,2-, а другая в 1,4- положениях. Одновременно в небольших количествах образуется продукт, когда обе молекулы реагируют в 1,4-положениие:
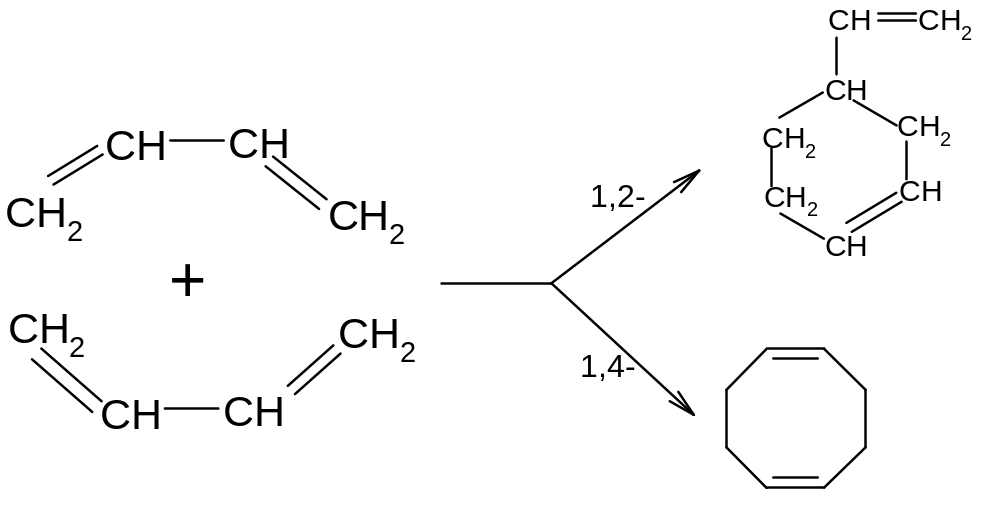
6.Диеновый синтез
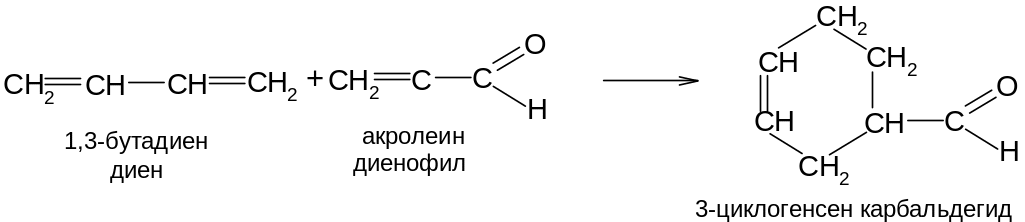
Диеновые углеводороды особенно легко димеризуются с молекулами, имеющими активированную двойную связь. Реакции этого типа называются диеновым синтезом или реакциями Дильса-Альдера:
7.Полимеризация
Важной особенностью диеновых углеводородов с сопряженными связями является их способность полимеризоваться в каучукоподобные продукты.
Промышленный интерес представляет цепная полимеризация диеновых углеводородов под влиянием катализаторов или инициаторов. В качестве катализаторов используются щелочные металлы, металлоорганические соединения, в качестве инициаторов – органические и неорганические пероксиды.
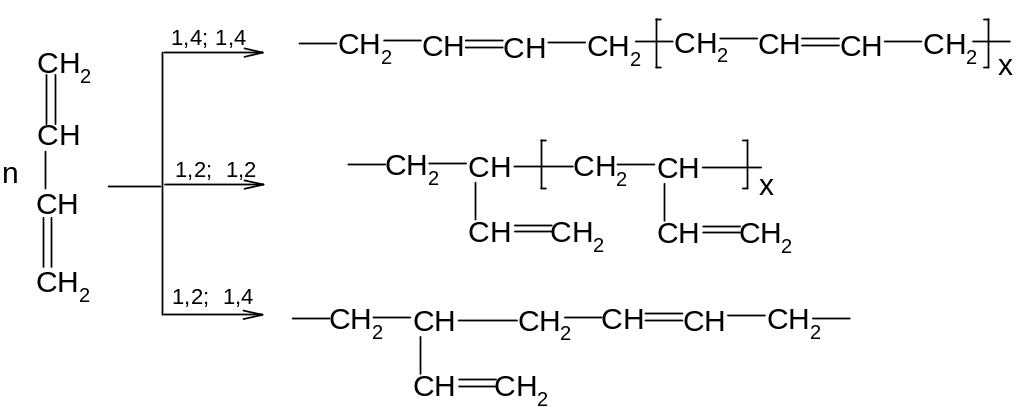
При полимеризации отдельные молекулы мономеров могут соединяться друг с другом в 1,2-, в 1,4-положения или одна молекула реагирует в 1,2-, а другая – в 1,4- положение:
Скорость полимеризации зависит от строения диенов и условий полимеризации. Заместители в середине молекулы облегчают, а на конце молекулы затрудняют полимеризацию. Изопрен полимеризуется быстрее, а пиперилен медленнее, чем дивинил.
Наиболее ценные продукты получаются при стереорегулярной (пространственно упорядоченной) полимеризации в 1.4-положение с образованием цис-конфигурации каждого остатка:
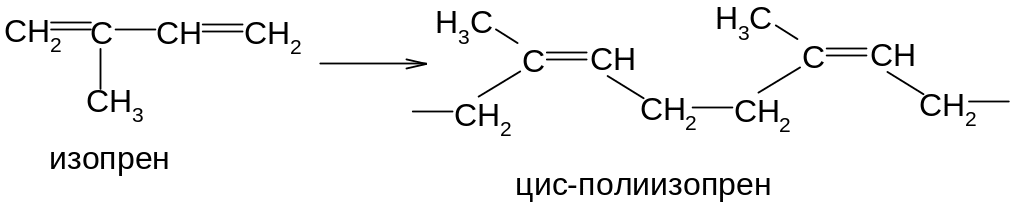
По химическому составу и строению натуральный каучук представляет собой стереорегулярный цис-полимер изопрена.
Строение каучука и других полимеров диеновых углеводородов было доказано методом озонирования (по Гарриесу). Получение при озонолизе левулинового альдегида подтверждает упорядоченное 1,4-строение.

Различные виды синтетического и натурального каучука широко применяются в промышленности. Пионером в организации крупного промышленного производства синтетического каучука был Советский Союз.
13. Алициклические углеводороды
К алициклическому ряду относятся карбоциклические соединения, не обладающие ароматическим характером, в частности не содержащие бензольных колец.
Простейшими соединениями алициклического ряда являются циклоалканы. Их называют также циклопарафинами, полиметиленовыми углеводородами или нафтенами.
Наряду с циклоалканами существуют циклоалкены, циклоалкины.
Изомерия. Номенклатура
Строение алициклов разнообразно:

моноциклический спирановый мостиковая бициклический
алкан углеводород структура алкан
В дальнейшее уделим внимание только моноциклическим алканам.
Для моноциклических алканов характерна структурная изомерия следующих видов.
1. По величине кольца:

циклогексан метилциклопентан этилциклобутан
Для обозначения алициклов чаще используют сокращенные формулы, в которых не записываются символы углеродов и связанных с ними водородов, входящих в состав кольца:
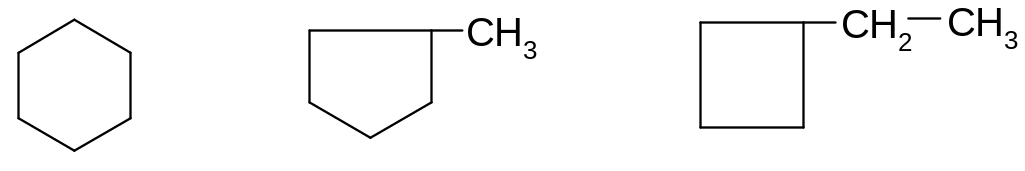
2. По положению заместителей в кольце:

1,2-диметилциклогексан 1,4-диметилциклогексан
3. По строению заместителей:

пропилциклопропан изопропилциклопропан
При наличии двух заместителей в кольце помимо структурной изомерии возможна стереоизомерия, как геометрическая, так и оптическая.
Циклоалканы с одним кольцом называют путем добавления приставки цикло к названию соответствующего алкана. Нумерация всегда начинается с углерода, содержащего старший заместитель (функциональную группу) и ведется таким образом, чтобы сумма цифр, показывающая положения заместителей, была минимальной.
Существует много алициклических соединений, молекулы которых содержат несколько конденсированных циклов. Для таких соединений удобна следующая номенклатура. В названии учитывают все атомы углерода, входящие в циклы, а в скобках показывают число атомов углерода, находящихся между общими углеродными атомами. Нумерацию производят от разветвления по наиболее длинной цепи:

бициклононан (4,3,0) бициклогексан (2,2,0)
Способы получения
Циклоалканы могут быть получены либо из соединений жирного ряда, либо из производных с соответствующим циклом. Циклопрарафины с пятью и шестью членами в цикле могут быть выделены из соответствующих фракций некоторых нефтей.
Кроме того, способы получения алициклических соединений можно разделить на общие, применяемые для получения соединений с различной величиной цикла, и специальные, область применения которых ограничена только одним типом цикла.
Из многочисленных общих способов получения циклоалканов рассмотрим только три:
1. Дегалогенирование дигалогенопроизводных под действием цинка (разновидность реакции Вюрца):

1,4-дихлорбутан циклобутан
Этим методом обычно получают трех-, четырех- или пятичленные циклы.
2. Взаимодействие дигалогенопроизводных с натрий-малоновым эфиром. Этим методом получают соединения с 3 – 6 членными циклами:

3. Пиролиз солей двухосновных кислот, начиная с шести атомов углерода в цепи. Этот метод применим для получения соединений с 5,6 и более членами в цикле:

