
- •Основные свойства теплового излучения
- •Спектры люминесценции
- •[Править]Принцип Франка — Кондона
- •[Править]Правило Стокса — Ломмеля
- •[Править]Постоянство спектра люминесценции
- •[Править]Правило зеркальной симметрии Левшина
- •[Править]Выход люминесценции
- •[Править]Тушение люминесценции
- •[Править]Первый закон
- •[Править]Второй закон
- •Внешний фотоэффект
- •[Править]Законы внешнего фотоэффекта
- •Внутренний фотоэффект
- •[Править]Вентильный фотоэффект
- •[Править]Фотовольтаический эффект
- •[Править]Ядерный фотоэффект
- •Вопрос 11 Опыт Франка — Герца
- •Элементарная боровская теория водородного атома
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14 Соотношение неопределенностей
- •Формулировка [править]Общий случай
- •[Править]Случай трёхмерного пространства
- •[Править]Стационарное уравнение Шрёдингера
- •[Править]Получение уравнения Шрёдингера предельным переходом [источник не указан 32 дня]
- •Физический смысл волновой функции
- •[Править]Волновая функция в различных представлениях
- •[Править]Принцип суперпозиции квантовых состояний
- •[Править]Условия регулярности волновой функции
- •[Править]Нормированность волновой функции
- •[Править]Матричная и векторная формулировки
- •[Править]Философский смысл волновой функции
- •Вопрос 16
- •[Править]Операторы рождения и уничтожения
- •[Править]Ангармонический осциллятор
- •[Править]Многочастичный квантовый осциллятор
- •[Править]Переходы под влиянием внешней силы
- •Вопрос 17 Атом водорода в квантовой механике
- •Физический смысл
- •Вопрос 18
- •Физический смысл
- •Свойства спина
- •История
- •[Править]Спин и магнитный момент
- •[Править]Спин и статистика
- •[Править]Обобщение спина
- •[Править]Спин классических систем
- •§2. Собственный магнитный момент электрона
- •Результирующий механический момент многоэлектронного атома.
- •Вопрос 19
- •[Править]Строение атомов и принцип Паули
- •Хунда правило
- •История открытия
- •[Править]Структура периодической системы
- •[Править]Значение периодической системы
- •Вопрос 20
- •Природа эффекта [править]в классическом представлении
- •[Править]в квантовом представлении
- •[Править]Нормальный эффект Зеемана
- •[Править]Аномальный эффект Зеемана
- •Применение теории идеального газа [править]Физический смысл температуры газа
- •[Править]Распределение Больцмана
- •[Править]Адиабатический процесс
- •[Править]Квантовый идеальный газ
- •[Править]Ферми-газ
- •[Править]Бозе-газ
- •Молекулярно-кинетическое толкование температуры и давления. Закон Дальтона.
- •Физические случайные величины.
- •Распределение по вектору импульса
- •Границы применимости
- •[Править]Условия классического рассмотрения
- •Барометрическая формула
- •Влияние температуры на вязкость газов
- •Первый закон термодинамики
- •Теплоёмкость идеального газа
- •Применение первого закона термодинамики к изопроцессам
- •Второй Закон Термодинамики
- •3.8. Термодинамическая энтропия
Влияние температуры на вязкость газов
В отличие от жидкостей, вязкость газов увеличивается с увеличением температуры (у жидкостей она уменьшается при увеличении температуры).
Формула Сазерленда может быть использована для определения вязкости идеального газа в зависимости от температуры:[1]
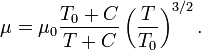
где:
μ = динамическая вязкость в (Па·с) при заданной температуре T,
μ0 = контрольная вязкость в (Па·с) при некоторой контрольной температуре T0,
T = заданная температура в Кельвинах,
T0 = контрольная температура в Кельвинах,
C = постоянная Сазерленда для того газа, вязкость которого требуется определить.
Эту формулу можно применять для температур в диапазоне 0 < T < 555 K и при давлениях менее 3,45 МПа с ошибкой менее 10%, обусловленной зависимостью вязкости от давления.
Постоянная Сазерленда и контрольные вязкости газов при различных температурах приведены в таблице ниже
-
Газ
C
[K]
T0
[K]
μ0
[мкПа с]
Воздух
120
291.15
18.27
Азот
111
300.55
17.81
Кислород
127
292.25
20.18
Углекислый газ
240
293.15
14.8
Угарный газ
118
288.15
17.2
Водород
72
293.85
8.76
Аммиак
370
293.15
9.82
Оксид серы(IV)
416
293.65
12.54
Гелий
79.4 [2]
273
19 [3]
См. также [1] (англ.).
Вопрос № 21
Газы в состоянии технического ваккума
Технический вакуум
На практике сильно разреженный газ называют техническим вакуумом. В макроскопических объёмах идеальный вакуум недостижим на практике, поскольку при конечной температуре все материалы обладают ненулевой плотностью насыщенных паров. Кроме того, многие материалы (в том числе толстые металлические, стеклянные и иные стенки сосудов) пропускают газы. В микроскопических объёмах, однако, достижение идеального вакуума в принципе возможно.
Мерой
степени разрежения вакуума служит длина
свободного пробега молекул газа ![]() ,
связанной с ихвзаимными столкновениями
в газе, и характерного линейного
размера
,
связанной с ихвзаимными столкновениями
в газе, и характерного линейного
размера ![]() сосуда,
в котором находится газ.
сосуда,
в котором находится газ.
Строго
говоря, техническим вакуумом называют
газ в сосуде или трубопроводе с давлением
ниже, чем в окружающей атмосфере. Согласно
другому определению, когда молекулы
или атомы газа перестают сталкиваться
друг с другом, и газодинамические
свойства сменяются вязкостными (при
давлении около1 торр)
говорят о достижении низкого
вакуума (![]() )
(1016 молекул на 1
см³). Обычно между атмосферным воздухом
и высоковакуумным насосом стоит так
называемый форвакуумный насос, создавая
предварительное разрежение, поэтому
низкий вакуум часто называют форвакуум.
При дальнейшем понижении давления в
камере увеличивается средняя длина
свободного пробега λ молекул
газа. При
)
(1016 молекул на 1
см³). Обычно между атмосферным воздухом
и высоковакуумным насосом стоит так
называемый форвакуумный насос, создавая
предварительное разрежение, поэтому
низкий вакуум часто называют форвакуум.
При дальнейшем понижении давления в
камере увеличивается средняя длина
свободного пробега λ молекул
газа. При ![]() молекулы
газа гораздо чаще сталкиваются со
стенками, чем друг с другом. В этом случае
говорят о высоком
вакууме (10−5 торр)
(1011 молекул на 1
см³). Сверхвысокий
вакуум соответствует
давлению 10−9 торр и
ниже. В сверхвысоком вакууме, например,
обычно проводятся эксперименты с
использованием сканирующего
туннельного микроскопа.
Для сравнения, давление в космосе на
несколько порядков ниже, в дальнем же
космосе и вовсе может достигать 10−16 торр и
ниже (1 молекула на 1
см³).
молекулы
газа гораздо чаще сталкиваются со
стенками, чем друг с другом. В этом случае
говорят о высоком
вакууме (10−5 торр)
(1011 молекул на 1
см³). Сверхвысокий
вакуум соответствует
давлению 10−9 торр и
ниже. В сверхвысоком вакууме, например,
обычно проводятся эксперименты с
использованием сканирующего
туннельного микроскопа.
Для сравнения, давление в космосе на
несколько порядков ниже, в дальнем же
космосе и вовсе может достигать 10−16 торр и
ниже (1 молекула на 1
см³).
Высокий вакуум в микроскопических порах некоторых кристаллов достигается уже при атмосферном давлении, поскольку диаметр поры гораздо меньше длины свободного пробега молекулы.
Аппараты, используемые для достижения и поддержания вакуума, называютсявакуумными насосами. Для поглощения газов и создания необходимой степени вакуума используются геттеры. Более широкий термин вакуумная техника включает также приборы для измерения и контроля вакуума, манипулирования предметами и проведения технологических операций в вакуумной камере и т. д. Высоковакуумные насосы являются сложными техническими приборами. Основные типы высоковакуумных насосов — это диффузионные насосы, основанные на увлечении молекул остаточных газов потоком рабочего газа, геттерные, ионизационные насосы, основанные на внедрении молекул газа в геттеры (например титан) и криосорбционные насосы (в основном для создания форвакуума).
Стоит отметить, что даже в идеальном вакууме при конечной температуре всегда имеется некоторое тепловое излучение (газ фотонов). Таким образом, тело, помещённое в идеальный вакуум, рано или поздно придёт в тепловое равновесие со стенками вакуумной камеры за счёт обмена тепловыми фотонами.
Вакуум является лучшим термоизолятором; перенос тепловой энергии в нём происходит лишь за счёт теплового излучения,конвекция и теплопроводность исключены. Это свойство используется для теплоизоляции в термосах (сосудах Дьюара), состоящих из ёмкости с двойными стенками, пространство между которыми вакуумированно.
Вакуум широко применяется в электровакуумных приборах — радиолампах (например, магнетронах микроволновых печей),электронно-лучевых трубках и т. п.
[править]Физический вакуум
Основная статья: Физический вакуум
Под физическим вакуумом в квантовой физике понимают низшее (основное) энергетическое состояние квантованного поля, обладающее нулевыми импульсом, моментом импульса и другими квантовыми числами. При этом такое состояние вовсе не обязательно соответствует пустоте: поле в низшем состоянии может быть, например, полем квазичастиц в твёрдом теле или даже в ядре атома, где плотность чрезвычайно высока. Физическим вакуумом называют также полностью лишённое веществапространство, заполненное полем в таком состоянии. Такое состояние не является абсолютной пустотой. Квантовая теория поляутверждает, что, в согласии с принципом неопределённости, в физическом вакууме постоянно рождаются и исчезаютвиртуальные частицы: происходят так называемые нулевые колебания полей. В некоторых конкретных теориях поля вакуум может обладать нетривиальными топологическими свойствами. В теории могут существовать несколько различных вакуумов, различающихся плотностью энергии или другими физическими параметрами (в зависимости от применяемых гипотез и теорий). Вырождение вакуума при спонтанном нарушении симметрии приводит к существованию непрерывного спектра вакуумных состояний, отличающихся друг от друга числом голдстоуновских бозонов. Локальные минимумы энергии при разных значениях какого-либо поля, отличающиеся по энергии от глобального минимума, носят название ложных вакуумов; такие состояния метастабильны и стремятся распасться с выделением энергии, перейдя в истинный вакуум или в один из нижележащих ложных вакуумов.
Некоторые из этих предсказаний теории поля уже были успешно подтверждены экспериментом. Так, эффект Казимира[1] илэмбовский сдвиг атомных уровней объясняется нулевыми колебаниями электромагнитного поля в физическом вакууме. На некоторых других представлениях о вакууме базируются современные физические теории. Например, существование нескольких вакуумных состояний (упомянутых выше ложных вакуумов) является одной из главных основ инфляционной теории Большого взрыва.
Вопрос №22
Внутренняя энергия идеального газа. Работа термодинамической системы.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
![]()
Так
как в одном киломоле содержится ![]() молекул,
то внутренняя энергия одного киломоля
газа будет
молекул,
то внутренняя энергия одного киломоля
газа будет
![]() Учитывая,
что
Учитывая,
что ![]() ,
получим
,
получим
![]()
Для
любой массы m газа, т.е. для любого числа
киломолей ![]() внутренняя
энергия
внутренняя
энергия
|
(10.12) |
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю. Математически это записывается в виде тождества
![]()
работа термодинамической системы
Механическая работа определяется как:
![]() ,
,
где ![]() — сила,
а
— сила,
а ![]() —
элементарное (бесконечно малое)
перемещение.
—
элементарное (бесконечно малое)
перемещение.
Элементарная работа термодинамической системы над внешней средой может быть вычислена так:
![]() ,
,
где ![]() —
нормаль элементарной (бесконечно малой)
площадки,
— давление и
—
нормаль элементарной (бесконечно малой)
площадки,
— давление и ![]() —
бесконечно малое приращение объёма.
—
бесконечно малое приращение объёма.
Работа
в термодинамическом процессе ![]() ,
таким образом, выражается так:
,
таким образом, выражается так:
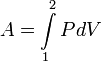 .
.
Величина
работы зависит от пути, по которому
термодинамическая система переходит
из состояния ![]() в
состояние
в
состояние ![]() ,
и не является функцией
состояния системы.
Такие величины называют функциями
процесса.
,
и не является функцией
состояния системы.
Такие величины называют функциями
процесса.
Несмотря на то, что до сих пор и в физической химии используется обозначение работы A, в соответствии с рекомендациями ИЮПАК работу в химической термодинамике следует обозначать как W[1]. Впрочем, авторы могут использовать какие угодно обозначения, если только дадут им расшифровку.[2]
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единица измерения: Джоуль Дж
[править]Определение
Рассмотрим
систему, состоящую из двух тел ![]() и
и ![]() .
Предположим, что тело
заключено
почти полностью в жёсткую адиабатическую
оболочку, так что оно не способно
совершатьмакроскопическую
работу,
а обмениваться теплом (то есть энергией)
посредством микроскопических процессов
может лишь с телом
.
Предположим, что тело
также
заключено в адиабатическую оболочку
почти полностью, так что для него возможен
теплообмен лишь с
,
но не будем предполагать, что оболочка
жёсткая. Количеством
теплоты,
сообщённой телу
в
некотором процессе, будем называть
величину
.
Предположим, что тело
заключено
почти полностью в жёсткую адиабатическую
оболочку, так что оно не способно
совершатьмакроскопическую
работу,
а обмениваться теплом (то есть энергией)
посредством микроскопических процессов
может лишь с телом
.
Предположим, что тело
также
заключено в адиабатическую оболочку
почти полностью, так что для него возможен
теплообмен лишь с
,
но не будем предполагать, что оболочка
жёсткая. Количеством
теплоты,
сообщённой телу
в
некотором процессе, будем называть
величину ![]() ,
где
,
где ![]() —
изменение внутренней
энергии тела
.
Согласно закону
сохранения энергии,
—
изменение внутренней
энергии тела
.
Согласно закону
сохранения энергии,
![]()
где ![]() —
макроскопическая работа внешних сил
над телом
.
Если учесть, что
—
макроскопическая работа внешних сил
над телом
.
Если учесть, что
![]()
где ![]() —
работа, совершённая телом
,
то закону сохранения энергии можно
придать форму первого
начала термодинамики:
—
работа, совершённая телом
,
то закону сохранения энергии можно
придать форму первого
начала термодинамики:
![]()
Из
первого начала термодинамики следует
корректность введённого определения
количества теплоты, то есть независимость
соответствующей величины от выбора
пробного тела
и
способа теплообмена между телами.
Заметим, что для определения количества
теплоты необходимо пробное тело, в
противном случае первое начало теряет
смысл содержательного закона и
превращается в определение количества
теплоты (весьма бесполезное в таком
виде). При определении количества теплоты
независимо от
и ![]() первое
начало становится содержательным
законом, допускающим экспериментальную
проверку.
первое
начало становится содержательным
законом, допускающим экспериментальную
проверку.
Отметим, что, как и совершённая работа, количество переданной теплоты зависит от конкретного процесса, совершённого над телом.
Вопрос № 23
закон равнораспределения энергии по степеням свободы молекул
так, средняя энергия приходящаяся на одну степень свободы:
|
|
|
(4.4.1) |
У одноатомной молекулы i = 3, тогда для одноатомных молекул
|
|
|
(4.4.2) |
для двухатомных молекул
|
|
|
(4.4.3) |
для трёхатомных молекул
|
|
|
(4.4.4) |
Таким образом, на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы, приходится
|
|
|
(4.4.5) |
Это и есть закон Больцмана о равномерном распределении средней кинетической энергии по степеням свободы.
Если
система находится в состоянии
термодинамического равновесия, при
температуре Т,
то средняя кинетическая энергия
равномерно распределена между всеми
степенями свободы. На каждую
поступательную iп и
вращательную iвр степени
свободы приходится энергия 1/2
kT.
Для колебательной iкол,
степени свободы она равна kT.
Таким образом число степеней свободы i
= iп +
iвр +
2iкол
Закон о равномерном распределении
энергии по степеням свободы перестает
быть справедливым при квантовом описании
системы частиц, когда каждому квантовому
состоянию системы с i-степенями
свободы соответствует ячейка объемом hi в
фазовом пространстве “координаты –
импульсы” тождественных (неразличимых
между собой) частиц, где h –
постоянная Планка (М. Планк (1858-1947) –
немецкий физик–теоретик).
При этом энергии вращения и колебания
молекул принимают дискретные значения
или говорят, что они квантуются. Энергия
колебания молекулы (как квантового
гармонического осциллятора
равна
Eкол =
(1/2+n)
hv,
где v –
собственная частота колебаний; n =
0,1,2,… - квантовое число.
Энергия Eкол при n =
0, равная E0 =
1/2 hv,
называется нулевой колебательной
энергией (энергией
нулевых колебаний).
Разность энергий ΔEкол между
соседними уровнями энергии равна hv.
Энергия вращательного движения молекулы
зависит от её вида. Для двухатомной
молекулы с жесткой связью эта энергия
имеет вид Евр = ![]() Где I –
момент инерции молекулы вокруг оси,
проходящей через центр инерции
молекулы; l =
0,1,2,… - вращательное квантовое число.
Расстояние между соседними уровнями
энергии вращения ΔEвр приблизительно
в тысячу раз меньше ΔEкол
Для двухатомных молекул:
Где I –
момент инерции молекулы вокруг оси,
проходящей через центр инерции
молекулы; l =
0,1,2,… - вращательное квантовое число.
Расстояние между соседними уровнями
энергии вращения ΔEвр приблизительно
в тысячу раз меньше ΔEкол
Для двухатомных молекул:
|
|
|
|
для трехатомных молекул:
|
|
|
|
В общем случае для молярной массы газа
|
|
|
(4.4.6) |
|
|
|
(4.4.7) |
Для произвольного количества газов:
|
|
|
(4.4.8) |
|
|
|
(4.4.9) |
Из теории также следует, что СV не зависит от температуры (рис. 4.4).
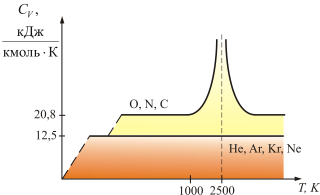 Рис.
4.4
Рис.
4.4
Для
одноатомных газов это выполняется в
очень широких пределах, а для двухатомных
газов только в интервале от 100 до 1000 К.
Отличие связано с проявлением квантовых
законов. При низких температурах
вращательное движение как бы «вымерзает»
и двухатомные молекулы движутся
поступательно, как одноатомные; равны
их теплоёмкости.
При увеличении температуры, когда Т >
1000 К, начинают сказываться колебания атомов
молекулы вдоль оси z (атомы
в молекуле связаны не жёстко, а как бы
на пружине). Одна колебательная степень
свободы несет ![]() энергии,
так как при этом есть и кинетическая, и
потенциальная энергия, то есть появляется
шестая степень свободы – колебательная.
При температуре равной 2500 К, молекулы
диссоциируют. На диссоциацию молекул
тратится энергия раз в десять превышающая
среднюю энергию поступательного
движения. Это объясняет сравнительно
низкую температуру пламени. Кроме того,
атом – сложная система, и при высоких
температурах начинает сказываться
движение электронов внутри него.ъ
энергии,
так как при этом есть и кинетическая, и
потенциальная энергия, то есть появляется
шестая степень свободы – колебательная.
При температуре равной 2500 К, молекулы
диссоциируют. На диссоциацию молекул
тратится энергия раз в десять превышающая
среднюю энергию поступательного
движения. Это объясняет сравнительно
низкую температуру пламени. Кроме того,
атом – сложная система, и при высоких
температурах начинает сказываться
движение электронов внутри него.ъ
Вопрос № 24
