
- •Основные свойства теплового излучения
- •Спектры люминесценции
- •[Править]Принцип Франка — Кондона
- •[Править]Правило Стокса — Ломмеля
- •[Править]Постоянство спектра люминесценции
- •[Править]Правило зеркальной симметрии Левшина
- •[Править]Выход люминесценции
- •[Править]Тушение люминесценции
- •[Править]Первый закон
- •[Править]Второй закон
- •Внешний фотоэффект
- •[Править]Законы внешнего фотоэффекта
- •Внутренний фотоэффект
- •[Править]Вентильный фотоэффект
- •[Править]Фотовольтаический эффект
- •[Править]Ядерный фотоэффект
- •Вопрос 11 Опыт Франка — Герца
- •Элементарная боровская теория водородного атома
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14 Соотношение неопределенностей
- •Формулировка [править]Общий случай
- •[Править]Случай трёхмерного пространства
- •[Править]Стационарное уравнение Шрёдингера
- •[Править]Получение уравнения Шрёдингера предельным переходом [источник не указан 32 дня]
- •Физический смысл волновой функции
- •[Править]Волновая функция в различных представлениях
- •[Править]Принцип суперпозиции квантовых состояний
- •[Править]Условия регулярности волновой функции
- •[Править]Нормированность волновой функции
- •[Править]Матричная и векторная формулировки
- •[Править]Философский смысл волновой функции
- •Вопрос 16
- •[Править]Операторы рождения и уничтожения
- •[Править]Ангармонический осциллятор
- •[Править]Многочастичный квантовый осциллятор
- •[Править]Переходы под влиянием внешней силы
- •Вопрос 17 Атом водорода в квантовой механике
- •Физический смысл
- •Вопрос 18
- •Физический смысл
- •Свойства спина
- •История
- •[Править]Спин и магнитный момент
- •[Править]Спин и статистика
- •[Править]Обобщение спина
- •[Править]Спин классических систем
- •§2. Собственный магнитный момент электрона
- •Результирующий механический момент многоэлектронного атома.
- •Вопрос 19
- •[Править]Строение атомов и принцип Паули
- •Хунда правило
- •История открытия
- •[Править]Структура периодической системы
- •[Править]Значение периодической системы
- •Вопрос 20
- •Природа эффекта [править]в классическом представлении
- •[Править]в квантовом представлении
- •[Править]Нормальный эффект Зеемана
- •[Править]Аномальный эффект Зеемана
- •Применение теории идеального газа [править]Физический смысл температуры газа
- •[Править]Распределение Больцмана
- •[Править]Адиабатический процесс
- •[Править]Квантовый идеальный газ
- •[Править]Ферми-газ
- •[Править]Бозе-газ
- •Молекулярно-кинетическое толкование температуры и давления. Закон Дальтона.
- •Физические случайные величины.
- •Распределение по вектору импульса
- •Границы применимости
- •[Править]Условия классического рассмотрения
- •Барометрическая формула
- •Влияние температуры на вязкость газов
- •Первый закон термодинамики
- •Теплоёмкость идеального газа
- •Применение первого закона термодинамики к изопроцессам
- •Второй Закон Термодинамики
- •3.8. Термодинамическая энтропия
Вопрос 19
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Принцип был сформулирован для электронов Вольфгангом Паули в 1925 г. в процессе работы над квантомеханической интерпретацией аномального эффекта Зеемана и в дальнейшем распространён на все частицы с полуцелым спином. Полное обобщённое доказательство принципа было сделано им в 1940 г. в рамках релятивистской квантовой механики: волновая функциясистемы фермионов является антисимметричной относительно их перестановок, поведение систем таких частиц описываетсястатистикой Ферми — Дирака.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
В
статистической физике принцип Паули
иногда формулируется в терминах чисел
заполнения:
в системе одинаковых частиц, описываемых
антисимметричной волновой функцией,
числа заполнения могут принимать лишь
два значения ![]()
[Править]Строение атомов и принцип Паули
Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количествоэлектронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией (при этом не стоит забывать, что электроны неразличимы, и нельзя сказать, в каком именно квантовом состоянии находится данный электрон). Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1S орбитали (самой низкой по энергии), при этом у них отличаются собственные моменты импульса и третий электрон не может занимать 1S орбиталь, так как будет нарушен запрет Паули. Поэтому, третий электрон занимает 2S орбиталь (следующая, низшая по энергии, орбиталь после 1S).
Хунда правило
Перевод
ХУНДА ПРАВИЛО
-
правило для нахождения самых глубоких
уровней энергии, соответствующих
определённой э л е к т р о н н о й к о н ф
и г у р а ц и и атома при н о р м а л ь-н о
й с в я з и спиновых и орбитальных моментов
образующих эти конфигурации электронов,
когда уровни энергии характеризуются квантовыми
числами S, L (см. Атом, Атомные
спектры). В
случае нормальной связи моментов
(см. Связь
векторная )при
заданном квантовом числе S полного
спинового момента атома и при заданном
квантовом числе полного орбитального
момента атома L получается
с п е к т р а л ь н ы й т е р м ![]() с
мультиплет-ностью
с
мультиплет-ностью ![]() =2S+1-совокупность
уровней энергии с квантовыми
числами J полного
момента атома: J=L
+ S, L + S-1,
... , |L - S|. Расположение
мультиплетных термов
=2S+1-совокупность
уровней энергии с квантовыми
числами J полного
момента атома: J=L
+ S, L + S-1,
... , |L - S|. Расположение
мультиплетных термов ![]() определяется
электростатич. взаимодействиями
электронов (много большими при нормальной
связи, чем магн. взаимодействия) и, как
следует из эксперим. данных и подтверждается
мн. квантовомеханич. расчётами, термы,
соответствующие определённой конфигурации,
лежат, как правило, тем глубже, чем
больше S, а
при данном S имеют
тенденцию лежать тем глубже, чем больше L.
определяется
электростатич. взаимодействиями
электронов (много большими при нормальной
связи, чем магн. взаимодействия) и, как
следует из эксперим. данных и подтверждается
мн. квантовомеханич. расчётами, термы,
соответствующие определённой конфигурации,
лежат, как правило, тем глубже, чем
больше S, а
при данном S имеют
тенденцию лежать тем глубже, чем больше L.
Согласно X. п., эмпирически установленному в 1925 Ф. Хундом (F. Hund), самый глубокий терм, соответствующий рассматриваемой электронной конфигурации, обладает наибольшим возможным значением S и наибольшим возможным для данного S значением L. Это правило всегда выполняется для н о р м а л ь н ы х э л е к т р о н н ы х к о н ф и г у р а ц и й, соответствующих наиб. прочной связи всех электронов и состоящих из эквивалентных электронов, и полностью подтверждается квантовомеханич. расчётами. Напр., для конфигурации р2 получаются (при учёте Паули принципа )термы 1S, 1D,3 Р, а для конфигурации d2- термы 1S, 1D,1G, 3P,3F; в первом случае самый глубокий терм, согласно X. п., 3 Р, во втором - 3F.
Для
данного терма ![]() уровни
с различными J обладают
разл. энергией-имеет место м у л ь т и п
л е т н о е р а сщ е п л е н и е терма
(при S<=L на
уровни
с различными J обладают
разл. энергией-имеет место м у л ь т и п
л е т н о е р а сщ е п л е н и е терма
(при S<=L на ![]() =2S+1
составляющих и при S>L на
2L+1
составляющих), обусловленное
магн. спин-орбитальным
взаимодействием. Расположение
уровней определяется приближённым п р
а в и л о м и н т е р в ал о в, согласно
к-рому расстояние между соседними
уровнями с квантовыми числами J и J+1
пропорционально бoльшему квантовому
числу; напр., для
уровней 3 Р0, 3P1,3 Р2. терма 3 Р расстояние 3 Р2 -3 Р1 вдвое
больше расстояния 3 Р1 -3 Р0. При
этом в случае конфигураций, состоящих
из эквивалентных электронов, для
оболочек, заполненных меньше чем
наполовину (напр., р2,
d4,
f5),
получаются н о р м а л ь н ы е мультиплетные
термы, для к-рых уровни лежат тем глубже,
чем меньше J, а
для оболочек, заполненных больше чем
наполовину, получаются о б р ащ ё н н ы
е мультиплетные термы, для к-рых уровни
лежат тем глубже, чем больше J. Так,
для нормального терма 3 Р конфигурации р2 самый
глубокий уровень 3 Р0, а
для обращённого терма дополнит.
конфигурации р4-3 Р2.
=2S+1
составляющих и при S>L на
2L+1
составляющих), обусловленное
магн. спин-орбитальным
взаимодействием. Расположение
уровней определяется приближённым п р
а в и л о м и н т е р в ал о в, согласно
к-рому расстояние между соседними
уровнями с квантовыми числами J и J+1
пропорционально бoльшему квантовому
числу; напр., для
уровней 3 Р0, 3P1,3 Р2. терма 3 Р расстояние 3 Р2 -3 Р1 вдвое
больше расстояния 3 Р1 -3 Р0. При
этом в случае конфигураций, состоящих
из эквивалентных электронов, для
оболочек, заполненных меньше чем
наполовину (напр., р2,
d4,
f5),
получаются н о р м а л ь н ы е мультиплетные
термы, для к-рых уровни лежат тем глубже,
чем меньше J, а
для оболочек, заполненных больше чем
наполовину, получаются о б р ащ ё н н ы
е мультиплетные термы, для к-рых уровни
лежат тем глубже, чем больше J. Так,
для нормального терма 3 Р конфигурации р2 самый
глубокий уровень 3 Р0, а
для обращённого терма дополнит.
конфигурации р4-3 Р2.
X. п.
в сочетании с правилом нахождения наиб.
глубокого уровня энергии для нормальных
и обращённых мультиплетных термов (это
правило иногда ошибочно наз. вторым X.
п.) позволяет определить для нормальной
конфигурации атома самый глубокий
(основной) уровень энергии в тех случаях,
когда в атоме частично заполнена наиб.
слабо связанными электронами одна
оболочка типа пр6,
nd10 или nf14 (при
наличии в атоме лишь полностью
укомплектованных электронных оболочек
осн. уровнем атома является уровень 1S0,
а при наличии одного внеш. электрона ns
- уровень 2Sl/2). Ниже
приведены самые глубокие уровни
энергии![]() для
конфигурации эквивалентных электронов:
для
конфигурации эквивалентных электронов:
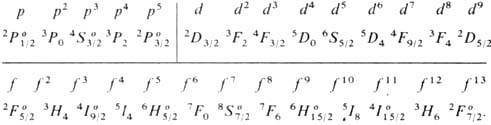
Отметим, что особенно глубоко (по сравнению с уровнями меньшей мультиплетности) лежат уровни 4S3/2, 6S5/2 и 8S7/2 для оболочек p6, d10 и f14, заполненных как раз наполовину, т. е. для конфигураций р3, d5 и f7.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
