
- •2.4. Основное уравнение молекулярно-кинетической теории газов
- •2.5. Постоянная Больцмана
- •3.1. Длина свободного пробега молекул
- •3.2. Скорость газовых молекул
- •3.3. Распределение Максвелла
- •4.1. Предмет термодинамики. Постулаты термодинамики
- •4.2. Температурные шкалы. Абсолютная температура
- •4.3. Температура в молекулярно-кинетической теории
- •4.4. Внутренняя энергия. Работа. Теплота
- •4.5. Первое начало термодинамики.Понятие теплоемкости
- •4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
- •4.7. Первое начало термодинамики как принцип эквивалентности теплоты и работы
- •Экспериментальная установка Джоуля
- •4.8. Невозможность вечного двигателя первого рода
- •4.9. Принципы работы тепловых машин
- •4.10. Цикл карно. Кпд тепловых двигателей
- •Циклы тепловых двигателей
- •4.11. Обратимые и необратимые процессы
- •4.12. Второй закон термодинамики
- •4.13. Теорема карно
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.15. Статистический смысл второго начала термодинамики
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.17. Энтропия и беспорядок
2.5. Постоянная Больцмана
Умножим правую и левую формулы (2.5) на объем одного моля газа V0.
|
|
Произведение n0V0 – число молекул в одном моле газа. А это число и есть число Авогадро, следовательно,
|
|
В соответствии с уравнением Клапейрона-Менделеева для одного моля
|
|
следовательно,
|
|
![]()

Больцман Людвиг (1844-1906) Австрийский физик. Провел важнейшие исследования в области кинетической теории газов, вывел закон распределения молекул газа по скоростям, обобщив распределения Максвелла на случай, когда на газ действуют внешние силы (статистика Больцмана). Формула равновесного больцмановского распределения послужила основой классической статистической физики. Вывел основное кинетическое уравнение газов
Отсюда средняя кинетическая энергия молекулы
|
|
Обозначим частное от деления двух констант N и R через k, тогда
|
|
k есть новая постоянная величина – постоянная Больцмана – одна из фундаментальных физических констант. Ее величина
|
|
Среднюю кинетическую энергию можно представить так:
|
(2.6) |
Таким образом, средняя кинетическая энергия молекулы зависит только от температуры.
При выводе основного уравнения молекулярно-кинетической теории рассматривалась одноатомная молекула, следовательно, полученная формула учитывает кинетическую энергию, относящуюся к поступательному движению. Если рассматривать двухатомную молекулу, которая может еще вращаться вокруг центра масс, то надо учитывать и энергию вращательного движения. Это обстоятельство будет учитываться при рассмотрении вопроса о теплоемкости газов.
Если абсолютная температура Т = 0,
то энергия
![]() поступательного
движения молекул в соответствии с
формулой (2.6) тоже должна становится
равной нулю, т.е. движение прекращается.
Этот вывод, однако, неправилен. Дело в
том, что абсолютный нуль температуры
практически не может быть достигнут.
Но и при температурах, близких к
абсолютному нулю, сохраняется движение
внутри атомов и молекул.
поступательного
движения молекул в соответствии с
формулой (2.6) тоже должна становится
равной нулю, т.е. движение прекращается.
Этот вывод, однако, неправилен. Дело в
том, что абсолютный нуль температуры
практически не может быть достигнут.
Но и при температурах, близких к
абсолютному нулю, сохраняется движение
внутри атомов и молекул.
3.1. Длина свободного пробега молекул
В единице объема любого газа при нормальных условиях, то есть при давлении в 1 атм, что соответствует ~105 Па, и температуре 0º С, что соответствует 273 К, находится определенное число молекул. Это число легко подсчитать.
Из основного уравнения молекулярно-кинетической теории следует, что
|
|
где n0 есть искомое число, k – постоянная Больцмана, надежно определенная экспериментально.
Итак,
|
|
Для большей наглядности найдем число частиц, приходящихся не в 1 м3, а в 1 см3. Тогда получим:
|
|
Это означает, что в каждом см3 находится трудно вообразимое число. Если бы в 1 см3 находился бы миллион молекул, то это было бы 106 молекул.
|
За единицу времени молекула заденет все те молекулы, центры которых лежат внутри цилиндра радиуса R = 2r и длины l, равной численно скорости молекулы v. Число молекул z, которые попадают внутрь такого цилиндра, равно
|
|
где n0
– число молекул в единице объема. Число
z и есть число столкновений в единицу
времени. Если учесть движение всех
молекул, то более точный расчет показывает,
что z в
![]() раз
больше:
раз
больше:
|
|
Оценим число соударений, испытываемых молекулой газа в единицу времени. Величина n0 известна:
|
|
Радиусы молекул определены экспериментально и по порядку величины равны
r ≈ 10-10 м. |
|
Средняя скорость vср ≈ 500 м/с. Таким образом,
|
|
то есть молекула в одну секунду претерпевает миллиарды соударений.
Среднюю длину свободного пробега получим, поделив путь, проходимый за единицу времени, на число столкновений в единицу времени. Так как путь, проходимый в единицу времени, численно равен скорости vcр, то
|
|
Из этой формулы видно, что с уменьшением давления длина свободного пробега λ увеличивается. Это происходит из-за того, что n0 прямо пропорционально давлению газа.
Подсчет средней длины свободного пробега дает для нормальных условий
λ = 7 · 10-8 м. |
|
Это очень маленькая величина.
Для нормальных условий работы электровакуумных приборов (телевизионные трубки, кинескопы и т.п.) необходимо создание высокого вакуума. Высокий вакуум – это не удаление всех молекул из сосуда. Это такое уменьшение давления, когда λ становится по порядку величины равной характерным размерам сосуда.

 Рис.
3.1
Рис.
3.1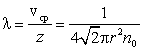 .
.