
- •2.4. Основное уравнение молекулярно-кинетической теории газов
- •2.5. Постоянная Больцмана
- •3.1. Длина свободного пробега молекул
- •3.2. Скорость газовых молекул
- •3.3. Распределение Максвелла
- •4.1. Предмет термодинамики. Постулаты термодинамики
- •4.2. Температурные шкалы. Абсолютная температура
- •4.3. Температура в молекулярно-кинетической теории
- •4.4. Внутренняя энергия. Работа. Теплота
- •4.5. Первое начало термодинамики.Понятие теплоемкости
- •4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
- •4.7. Первое начало термодинамики как принцип эквивалентности теплоты и работы
- •Экспериментальная установка Джоуля
- •4.8. Невозможность вечного двигателя первого рода
- •4.9. Принципы работы тепловых машин
- •4.10. Цикл карно. Кпд тепловых двигателей
- •Циклы тепловых двигателей
- •4.11. Обратимые и необратимые процессы
- •4.12. Второй закон термодинамики
- •4.13. Теорема карно
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.15. Статистический смысл второго начала термодинамики
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.17. Энтропия и беспорядок
4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
Рассмотрим термодинамическую систему, представляющую собой один моль идеального газа, которая изменяет свое состояние в условиях различных изопроцессов.
1. Изохорический процесс (V = const). Работа в этом процессе, как следует из (4.16), равна нулю. Процесс сводится к теплообмену системы с окружающей средой. Первый закон термодинамики при этом условии принимает вид:
Q = ΔU. |
(4.18) |
Как следует из (4.22), количество теплоты, полученное системой, если она представляет собой один моль идеального газа, равно
|
(4.26) |
Поскольку CV > 0 для всех веществ, то знаки Q и ΔТ совпадают. При Q > 0 (энергия подводится к системе) температура системы повышается, т.е. ΔТ > 0, при Q < 0 система охлаждается, т.е. ΔТ < 0.
Если в состав системы входит ν молей идеального газа, то равенство (4.26) представляется в виде:
|
(4.27) |
где m – масса газа, μ – его молекулярная масса.
2. Изобарический процесс (Р = const). На основании определения теплоемкости (4.20) количество теплоты Q, подведенное к системе в изобарном процессе, для одного моля идеального газа равно:
|
(4.28) |
Поскольку для любой системы CP > 0, то при Q > 0 (система получает энергию извне) ΔТ > 0 и Т2 > T1, система нагревается. При Q < 0 (система отдает энергию окружающей среде) ΔТ < 0, Т2 < T1, система охлаждается. Уравнение (4.28) для ν молей идеального газа записывается в виде:
|
(4.29) |
Найдем работу, которую совершает система в изобарическом процессе, переходя из состояния 1 в состояние 2. Начальное и конечное состояния системы описываются уравнениями
PV1 = RT1, PV2 = RT2, |
(4.28) |
из которых следует
|
(4.30) |
Обобщение равенства (4.30) для случая молей в системе приводит к результату:
|
(4.31) |
3. Изотермический процесс. При изотермическом процессе температура системы не изменяется (ΔТ = 0), а, следовательно, ее внутренняя энергия, являясь для идеального газа только функцией температуры, остается постоянной, то есть ее изменение ΔU = 0. Это значит, что сообщаемое системе количество теплоты идет на совершение работы.
|
|
|
Давление моля идеального газа, как следует из уравнения состояния, равно
|
|
и выражение для работы принимает вид:
|
(4.32) |
Очевидно, что чем меньшие интервалы изменения объема ΔVi выбираются для вычисления работы, тем точнее будет получено ее значение. Предельный переход в соотношении (4.32) приводит к выражению:
|
(4.33) |
где V1 и V2 – объемы, занимаемые системой соответственно в начальном и конечном состояниях. Обобщая формулу (4.33) на случай системы, содержащей ν молей газа, получаем равенство:
|
(4.34) |
Пользуясь уравнением изотермического процесса (PV = const), равенство (4.34) можно представить через другие параметры состояния системы:
|
(4.35) |
где Р1 и Р2 – давление газа в начальном и конечном состояниях.
4. Адиабатический процесс. Адиабатический процесс – процесс, идущий без теплообмена с окружающей средой. Это значит, что система должна быть теплоизолирована, либо процесс должен протекать так быстро, что за время процесса не происходит теплообмена системы с окружающей средой. Условие адиабатичности процесса означает, что Q = 0.
Уравнение первого закона термодинамики для адиабатического процесса принимает вид:
|
(4.36) |
Из последнего соотношения следует, что А = – ΔU и для одного моля идеального газа равно
|
(4.37) |
Из (4.37) очевидно, что если адиабатически изолированная система подвергается сжатию (внешние силы совершают над системой работу, поэтому работа отрицательна), то ΔU > 0. Это означает, что адиабатическое сжатие идеального газа приводит к повышению его температуры. Напротив, адиабатическое расширение идеального газа (работа совершается самой системой, поэтому она положительна) может происходить только за счет уменьшения его внутренней энергии (ΔU < 0), поэтому температура газа при его адиабатическом расширении должна понижаться.
Все рассмотренные выше процессы могут быть представлены одним уравнением – уравнением политропического процесса. Политропический процесс – это процесс, идущий с постоянной теплоемкостью. Уравнение политропического процесса имеет вид
|
|
где
![]() –
показатель политропы.
–
показатель политропы.
Уравнения всех рассмотренных процессов, их графики, значения теплоемкости и показатели политропы, а также значения всех величин, входящих в выражение первого закона термодинамики, представлены в таблице 4.1.

Джоуль Прескотт (1818-1889) – английский физик. Экспериментально обосновал закон сохранения энергии, определил механический эквивалент тепла. Совместно с У. Томсоном открыл эффект, носящий их имя.

Майер Юлиус Роберт (1814-1878) – немецкий естествоиспытатель, врач. Первым сформулировал закон сохранения энергии (эквивалентность механической работы и теплоты) и рассчитал механический эквивалент теплоты (1842). Идеи и приоритет Майера долго не признавались, что привело его к тяжелой болезни.

 Рис.
4.9
Рис.
4.9
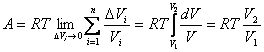 ,
,