
- •Часть 2
- •240901 «Биотехнология», 240706 «Автоматизированное производство химических предприятий» по курсу «Основные процессы и аппараты химических технологий» и для студентов специальностей
- •260601 «Машины и аппараты пищевых производств»,
- •260204 «Технология бродильных производств и виноделие» по курсу «Процессы и аппараты пищевых производств»
- •Содержание
- •Предисловие
- •Модуль 5. Гидромеханические процессы
- •5.1 Классификация гидромеханических процессов
- •5.2 Неоднородные системы и их свойства
- •5.2.1 Классификация неоднородных систем
- •5.2.2 Свойства неоднородных систем
- •5.2.3 Разделение неоднородных систем
- •5.3 Осаждение
- •5.4 Осаждение в гравитационном поле
- •5.4.1 Классификация отстойников
- •5.4.2 Расчет отстойников
- •5.5 Фильтрование
- •5.5.1 Кинетика процесса фильтрования
- •5.5.2 Расчет процесса фильтрования
- •5.5.3 Классификация фильтров
- •5.6 Разделение газовых неоднородных систем
- •5 Рисунок 5.15 – Схема Пылеосадительной камеры .6.1 Очистка газов в поле сил
- •5.6.2 Очистка газов в центробежном поле
- •5.6.3 Расчет циклона
- •5.6.4 Осаждение в электрическом поле
- •5.6.5 Мокрая очистка газов
- •5.6.6 Расчет аппаратов мокрой очистки газов
- •5.7 Выбор аппарата для разделения неоднородных систем
- •5.7.1 Аппараты для очистки газов
- •5.7.2 Аппараты для разделения суспензий
- •5.8 Образование неоднородных систем
- •5.8.1 Перемешивание
- •5.8.2 Псевдоожижение
- •Вопросы для самоконтроля
- •Модуль 6. Тепловые процессы
- •6.1 Промышленные способы подвода и отвода тепла
- •6.1.1 Греющие теплоносители
- •6.1.2 Хладоагенты
- •6.1.3 Водооборотные циклы химических производств
- •6.2 Теплообменные аппараты
- •6.2.1 Классификация теплообменных аппаратов
- •6.2.2 Кожухотрубчатые теплообменные аппараты
- •6.2.3 Змеевиковые теплообменные аппараты
- •6.2.4 Теплообменники с оребренными трубами
- •6.2.5 Методика теплового расчета
- •Б) уточненный или проверочный расчет, необходимость которого возникает, например, если в результате проектировочного расчета был выбран нормализованный аппарат со значительным запасом поверхности:
- •6.3 Выпаривание
- •6.3.1 Виды выпаривания
- •6.3.2 Материальный и тепловой баланс выпарного аппарата
- •6.3.3 Температура кипения раствора и температурные потери
- •6.3.4 Выпаривание в многокорпусных установках
- •Принципиальная схема противоточной двухкорпусной выпарной установки изображена на рисунке 6.11.
- •6.3.4.3 Комбинированная схема выпаривания
- •6.3.4.4 Материальный баланс многокорпусной выпарной установки
- •6.3.4.5 Тепловой баланс многокорпусной выпарной установки
- •6.3.5 Выпаривание с тепловым насосом
- •6.3.6 Классификация выпарных аппаратов
- •6.3.7 Выпарные аппараты с естественной циркуляцией
- •6.3.8 Выпарные аппараты с принудительной циркуляцией
- •6.3.9 Расчет выпарного аппарата
- •6.3.10 Выбор числа корпусов
- •6.3.11 Вспомогательное оборудование выпарной установки
- •Вопросы для самоконтроля
- •Модуль 7. Массообменные процессы в системах со свободной границей раздела фаз
- •7.1 Абсорбция
- •При выборе абсорбента к нему предъявляется ряд требований:
- •7.1.1 Физическая сущность процесса абсорбции
- •7.1.2 Равновесие при физической абсорбции
- •7.1.3 Материальный баланс абсорбции
- •7.1.4 Кинетика процесса абсорбции
- •7.1.5 Промышленные схемы абсорбции
- •7.1.6 Конструкции абсорберов
- •7.1.7 Насадочные аппараты
- •7.1.8 Тарельчатые аппараты
- •7.1.9 Расчет абсорберов
- •7.2 Перегонка и ректификация
- •7.2.1 Физическая сущность процесса
- •7 Рисунок 7.13 – Физическая сущность перегонки .2.2 Равновесие в системе «жидкость – пар»
- •7 Рисунок 7.14 – Диаграммы равновесия в системе «Жидкость жидкость» .2.3 Ректификация
- •7.2.4 Описание схемы процесса непрерывной ректификации
- •7.2.5 Расчет ректификационной установки непрерывного
- •7.2.6 Тепловой расчет колонны
- •7.2.7 Специальные методы ректификации
- •7.3 Жидкостная экстракция
- •7.3.1 Принципиальная схема процесса
- •7.3.2 Выбор экстрагента
- •7.3.3 Равновесие в системе «жидкость жидкость»
- •7.3.4 Кинетика экстракции
- •7.3.5 Принципиальные схемы экстракции
- •7.3.6 Классификация экстракторов
- •7.3.7 Расчет экстракторов
- •7.3.8 Способы повышения интенсивности процесса
- •Вопросы для самоконтроля
- •Модуль 8. Массообменные процессы с участием твердой фазы
- •8.1 Сушка
- •8.1.1 Принципиальная схема процесса
- •8.1.2 Выбор сушильного агента
- •8.1.3 Основные свойства влажного воздуха
- •IX для влажного воздуха
- •8.1.4 Равновесие процесса сушки
- •8.1.5 Материальный баланс сушки
- •8.1.6 Тепловой баланс конвективных сушилок
- •8.1.7 Схемы процессов сушки
- •8.1.8 Кинетика процесса сушки
- •8.1.9 Расчет сушилок
- •8.2 Кристаллизация
- •8.2.1 Принципиальная схема кристаллизации
- •8.2.2 Равновесие процесса кристаллизации
- •8.2.3 Материальный баланс кристаллизации
- •8.2.4 Тепловой баланс кристаллизации
- •8.2.5 Кинетика процесса
- •8.2.6 Конструкции аппаратов
- •8.3 Адсорбция
- •8.3.1 Принципиальная схема адсорбции
- •8.3.2 Равновесие процесса адсорбции
- •8.3.3 Кинетика адсорбции
- •8.3.4 Классификация адсорберов
- •1 Цилиндрический корпус; 2 решетка; 3,4 штуцеры
- •8.3.5 Расчет адсорберов
- •8.4 Мембранные процессы
- •8.4.1 Физическая сущность процесса
- •8.4.2 Классификация мембран
- •8.4.3 Расчет мембранных процессов
- •Вопросы для самоконтроля
- •Приложение а
- •Основные термины и определения
- •Список рекомендуемой литературы Общий
- •К модулю № 5
- •К модулю № 6
- •К модулю № 7
- •К модулю № 8
- •Часть 2
8.1.9 Расчет сушилок
Для проектирования сушильной установки должны быть заданы:
1) конструкция сушилки;
2) вид сырого материала, подвергающегося сушке и сушильного агента;
3) производительность;
4) режим сушки (температура сушки, кривая сушки, скорость сушильного агента и др.);
5) начальная и конечная влажность материала.
Необходимо определить: основные физические параметры высушиваемого материала и сушильного агента, количество испаряемой влаги, расход воздуха на сушку, расход тепла, размеры сушилки.
Для определения
поверхности сушилки вводится понятие
напряжения
сушилки по влаге – А.
Напряжение сушилки по влаге может быть
объемное
![]() и поверхностное
и поверхностное
![]() .
.
В этом случае необходимо определить скорость, время, в зависимости от типа сушилки напряжение по влаге или (Аs, или Av), поверхность или объем сушилки.
8.2 Кристаллизация
Кристаллизация – процесс выделения твердой фазы из растворов, расплавов и паров.
Применяется с целью выделения твердой фазы, разделения веществ, очистки веществ и выращивания монокристаллов.
Кристаллизация состоит из двух основных стадий – образования зародышей кристаллов и роста кристаллов. Обе стадии протекают одновременно.
Если wобр > wрост, то получается большое количество мелких кристаллов, если wобр < wрост, то образуются кристаллы больших размеров.
Начало кристаллизации осуществляется в центрах кристаллизации, в качестве которых могут выступать механические примеси, шероховатость стенок.
Условие протекания процесса – пересыщение раствора, т.е. действительная концентрация раствора вещества должна быть выше равновесной.
Величина предельного пересыщения зависит от свойств растворенного вещества и растворителя, температуры раствора, скорости охлаждения, наличия примесей, механического воздействия.
8.2.1 Принципиальная схема кристаллизации
Принципиальная схема кристаллизации показана на рисунке 8.16.


Рисунок 8.16 – Принципиальная схема кристаллизации
8.2.2 Равновесие процесса кристаллизации
Кристаллизация – это процесс, обратный растворению. Зависи-мость между давлением и температурой при фазовом переходе в условиях кристаллизации определяется уравнением Клайпейрона Клазиуса:
![]() ,
(8.25)
,
(8.25)
где q – теплота кристаллизации;
V1 – удельный объем вещества в жидком состоянии;
V2 – удельный объем вещества в твердом состоянии.
В
действительности
![]() вследствие
увеличения плотности. Следовательно,
вследствие
увеличения плотности. Следовательно,
![]() ,
то есть
давление,
при котором совершается фазовый переход,
увеличивается с увеличением температуры.
,
то есть
давление,
при котором совершается фазовый переход,
увеличивается с увеличением температуры.
На рисунке 8.17 представлена диаграмма состояний «газ жидкость твердое тело».
Т
Рисунок
8.17
– Диаграмма состояний «пар
жидкость
твердое
тело»

Линия ОА является кривой сублимации и отражает условия пере-хода твердого тела в пар, минуя жидкое состояние.
Линия АК является кривой перехода жидкости в газообразное состояние. При температуре выше критической отсутсвует различие между газом и жидкостью.
Линия АВ отражает условия перехода жидкости в твердое состояние; продолжается безгранично в вверх.
Условия равновесия удобно иллюстрировать с помощью фазовых диаграмм в координатах «Сt» (рисунок 8.18).
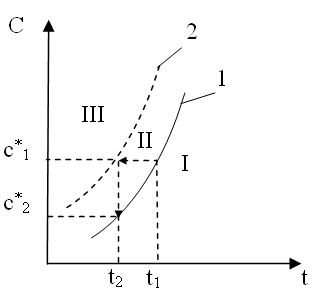
Рисунок 8.18 – Зависимость равновесной концентрации (1)
и пересыщения (2) от температуры
Кривая 1 соответствует условиям растворимости вещества в зависимости от температуры; кривая 2 – условиям пересыщения. На диаграмме выделено три области:
I – зона до насыщенного раствора; пунктирной линией обозначено устойчивое состояние перенасыщенного раствора;
II – метастабильная зона (происходит рост кристаллов);
III – лабильная зона (зона неустойчивого состояния раствора, где из раствора мгновенно выпадают кристаллы).
Существует два метода создания перенасыщения:
1) изогидрический (количество растворителя не изменяется); эффективен для солей со значительной зависимостью растворимости от давления;
2) изотермический (испаряют растворитель, при постоянной температуре); растворимость не зависит от температуры.
