
- •Химико-технологические системы
- •Содержание
- •Введение
- •1. Химико-технологические процессы и химико-технологические системы
- •1. Термины и определения
- •2. Технологические критерии эффективности химико-технологических систем
- •1. 2. 1. Степень превращения
- •1. 2. 2. Выход продукта
- •1. 2. 4. Производительность и интенсивность
- •1. 2. 5. Избирательность
- •1. 3. Структуры химико-технологических систем
- •1. 3. 1. Хтс с последовательной технологической связью
- •1. 3. 2. Параллельная технологическая связь
- •1. 3. 3. Последовательно-обводная технологическая связь (байпас)
- •1. 3. 4. Обратная (рециркуляционная) технологическая связь
- •1. 3. 5. Перекрестная технологическая связь
- •1. 4. Системный декомпозиционный анализ химико-технологических систем
- •4. 1. Молекулярно-кинетический уровень
- •1. 4. 2. Макрокинетический уровень
- •1. 4. 3. Аппаратный уровень
- •1. 4. 4. Уровень химико-технологической системы
- •1. 4. 4. 1. Синтез химико-технологической системы
- •1. 4. 4. 2. Анализ химико-технологической системы в целом
- •1. 4. 4. 3. Оптимизация химико-технологической системы
- •2. Химическая термодинамика
- •2. 1. Основные понятия и определения
- •2. 2. Первое начало термодинамики
- •2. 2. 1. Работа расширения идеального газа
- •2. 2. 2. Теплота процесса в различных условиях
- •2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
- •2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
- •2. 3. Второе начало термодинамики
- •2. 3. 1. Термодинамически обратимые и необратимые процессы.
- •2. 3. 2. Математическое выражение второго начала термодинамики. Энтропия.
- •2. 3. 2. 1. Энтропия и термодинамическая вероятность
- •2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
- •2. 3. 2. 3. Изменение энтропии при нагревании
- •2. 3. 2. 4. Изменение энтропии при фазовых превращениях
- •2. 3. 2. 5. Расчет абсолютной энтропии вещества
- •2. 3. 2. 6. Изменение энтропии при химическом превращении
- •2. 3. 3. Применение второго начала термодинамики к химическим процессам.
- •2. 3. 3. 1. Термодинамические потенциалы
- •2. 3. 3. 2. Уравнение Гиббса-Гельмгольца
- •2. 3. 3. 3. Критерии направления процессов в закрытых системах
- •2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность.
- •2. 3. 5. Уравнение изотермы химической реакции
- •3. Химическое равновесие
- •3. 1. Константы равновесия
- •3. 2. Расчет равновесного состава и равновесного выхода продуктов химической реакции
- •3. 3. Влияние температуры и давления на равновесный выход продуктов реакции. Принцип Ле Шателье.
- •3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции.
- •3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции.
- •4. Фазовые равновесия
- •4. 1. Основные понятия и определения
- •4. 2. Условия равновесного сосуществования фаз
- •4. 3. Правило фаз Гиббса
- •4. 4. Однокомпонентные системы
- •4. 4. 1. Уравнение Клапейрона-Клаузиуса
- •4. 4. 1. 1. Применение уравнения Клапейрона-Клаузиуса к процессу плавления
- •4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
- •4. 4. 2. Диаграмма состояния однокомпонентной системы
- •4. 5. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 6. Двухкомпонентные системы
- •4. 6. 1. Бинарные системы взаимно растворимых жидкостей.
- •4. 6. 1. 1. Общая характеристика растворов
- •4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора
- •4. 6. 1. 3. Правило рычага
- •4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов
- •4. 6. 1. 5. Разделение бинарных растворов
- •4. 6. 2. Системы взаимно нерастворимых жидкостей
- •4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
- •4. 6. 2. 2. Перегонка с водяным паром
- •4. 7. Трехкомпонентные системы
- •4. 7. 1. Закон распределения
- •4. 7. 2. Экстрагирование
- •Библиографический список
4. 6. 2. Системы взаимно нерастворимых жидкостей
Совершенно несмешивающихся друг с другом жидкостей, разумеется, не существует. Однако часто их взаимная растворимость настолько мала, что не имеет практического значения. Состав пара, находящегося в равновесии с двумя жидкими фазами, определяется только температурой (или только давлением) и не зависит от соотношения между количествами компонентов. Для таких систем при T = const
p1 = p0,1 = cons и p2 = p0,2 = const,
а общее давление над смесью двух жидкостей
Pобщ. = p0,1 + p0,2
Состав пара, в соответствии с законом Дальтона, можно вычислить по уравнению
![]() ,
,
которое для рассматриваемой системы примет вид:
![]() и
и
![]()
4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
Диаграмма Т – N для несмешивающихся жидкостей приведена на рис. 14. Точки a и b на диаграмме показывают температуры кипения чистых компонентов T0,1 и T0,2, соответственно. Линии аЕ и Еб являются линиями начала конденсации пара, а составляющие их точки называют «точками росы». Линия e’Ee’’ соответствует началу кипения смеси двух жидкостей при температуре T1+2. При кипении смеси двух жидкостей система образована двумя чистыми жидкостями и однофазным паром (f = 3). В изобарных условиях число степеней свободы
s = k – f + 1 = 2 – 3 + 1 = 0.
Это означает, что смесь двух жидкостей кипит при постоянной температуре, соответствующей данному внешнему давлению, до тех пор, пока не полностью не испарится одна из жидкостей, кипит при постоянной температуре, соответствующей данному внешнему давлению, до тех пор, пока не полностью не испарится одна из жидкостей. Из диаграммы перегонки видно, что температура кипения смеси двух жидкостей T1+2 значительно ниже температуры кипения чистых компонентов T0,1 и T0,2.

Рис. 14. Диаграмма температура кипения – состав при постоянном давлении для двух несмешивающихся жидкостей
4. 6. 2. 2. Перегонка с водяным паром
На описанных выше свойствах несмешивающихся жидкостей основана перегонка с водяным паром. Этот способ выделения или очистки органических веществ особенно целесообразно применять для веществ с высокой температурой кипения или разлагающихся (осмоляющихся) при нормальной температуре кипения. Той же цели служит перегонка под пониженным давлением (в вакууме), однако ее аппаратурное оформление значительно сложнее.
Как следует из рис. 14, если первый компонент вода, то температура кипения смеси при атмосферном давлении обязательно ниже 100 ◦С. Из соотношения молярных долей компонентов в паре (см. п. 4. 6. 2.) легко вычисляется так называемы расходный коэффициент водяного пара g1/g2 (компонент 1 – вода). Так как
![]() и
и
![]() ,
,
где Mi – молярная масса i-го компонента,
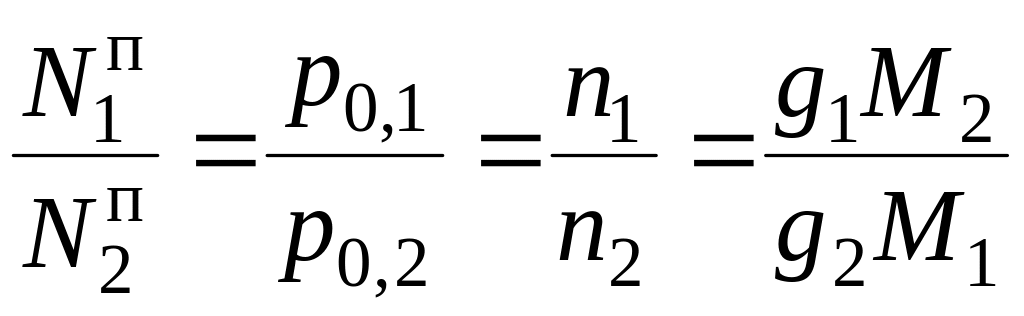 ,
,
Откуда
![]() ,
,
где gi – масса , а Mi – молярная масса i-го компонента.
Из полученного уравнения следует, что расход водяного пара g1 на единицу массы отгоняемого вещества тем меньше, чем больше p0,2 и M2. А это значит, что даже малолетучие вещества, но обладающие большой молекулярной массой, будут отгоняться с водяным паром в значительных количествах.
Иногда в качестве пара-носителя применяют не водяной пар, а некоторые газы. Например, известны патенты, предусматривающие использование при перегонке каменноугольной смолы газов, содержащих. СО2, N2 и водяной пар.
Некоторая взаимная растворимость веществ не препятствует перегонке с водяным паром, однако при расчетах нужно будет учесть, что давление насыщенного пара компонента при этом отличается от p0,i.
