
- •Химико-технологические системы
- •Содержание
- •Введение
- •1. Химико-технологические процессы и химико-технологические системы
- •1. Термины и определения
- •2. Технологические критерии эффективности химико-технологических систем
- •1. 2. 1. Степень превращения
- •1. 2. 2. Выход продукта
- •1. 2. 4. Производительность и интенсивность
- •1. 2. 5. Избирательность
- •1. 3. Структуры химико-технологических систем
- •1. 3. 1. Хтс с последовательной технологической связью
- •1. 3. 2. Параллельная технологическая связь
- •1. 3. 3. Последовательно-обводная технологическая связь (байпас)
- •1. 3. 4. Обратная (рециркуляционная) технологическая связь
- •1. 3. 5. Перекрестная технологическая связь
- •1. 4. Системный декомпозиционный анализ химико-технологических систем
- •4. 1. Молекулярно-кинетический уровень
- •1. 4. 2. Макрокинетический уровень
- •1. 4. 3. Аппаратный уровень
- •1. 4. 4. Уровень химико-технологической системы
- •1. 4. 4. 1. Синтез химико-технологической системы
- •1. 4. 4. 2. Анализ химико-технологической системы в целом
- •1. 4. 4. 3. Оптимизация химико-технологической системы
- •2. Химическая термодинамика
- •2. 1. Основные понятия и определения
- •2. 2. Первое начало термодинамики
- •2. 2. 1. Работа расширения идеального газа
- •2. 2. 2. Теплота процесса в различных условиях
- •2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
- •2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
- •2. 3. Второе начало термодинамики
- •2. 3. 1. Термодинамически обратимые и необратимые процессы.
- •2. 3. 2. Математическое выражение второго начала термодинамики. Энтропия.
- •2. 3. 2. 1. Энтропия и термодинамическая вероятность
- •2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
- •2. 3. 2. 3. Изменение энтропии при нагревании
- •2. 3. 2. 4. Изменение энтропии при фазовых превращениях
- •2. 3. 2. 5. Расчет абсолютной энтропии вещества
- •2. 3. 2. 6. Изменение энтропии при химическом превращении
- •2. 3. 3. Применение второго начала термодинамики к химическим процессам.
- •2. 3. 3. 1. Термодинамические потенциалы
- •2. 3. 3. 2. Уравнение Гиббса-Гельмгольца
- •2. 3. 3. 3. Критерии направления процессов в закрытых системах
- •2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность.
- •2. 3. 5. Уравнение изотермы химической реакции
- •3. Химическое равновесие
- •3. 1. Константы равновесия
- •3. 2. Расчет равновесного состава и равновесного выхода продуктов химической реакции
- •3. 3. Влияние температуры и давления на равновесный выход продуктов реакции. Принцип Ле Шателье.
- •3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции.
- •3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции.
- •4. Фазовые равновесия
- •4. 1. Основные понятия и определения
- •4. 2. Условия равновесного сосуществования фаз
- •4. 3. Правило фаз Гиббса
- •4. 4. Однокомпонентные системы
- •4. 4. 1. Уравнение Клапейрона-Клаузиуса
- •4. 4. 1. 1. Применение уравнения Клапейрона-Клаузиуса к процессу плавления
- •4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
- •4. 4. 2. Диаграмма состояния однокомпонентной системы
- •4. 5. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 6. Двухкомпонентные системы
- •4. 6. 1. Бинарные системы взаимно растворимых жидкостей.
- •4. 6. 1. 1. Общая характеристика растворов
- •4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора
- •4. 6. 1. 3. Правило рычага
- •4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов
- •4. 6. 1. 5. Разделение бинарных растворов
- •4. 6. 2. Системы взаимно нерастворимых жидкостей
- •4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
- •4. 6. 2. 2. Перегонка с водяным паром
- •4. 7. Трехкомпонентные системы
- •4. 7. 1. Закон распределения
- •4. 7. 2. Экстрагирование
- •Библиографический список
2. 3. 5. Уравнение изотермы химической реакции
Рассмотрим химическую реакцию
![]() ,
,
протекающую при P = const и T = const в газовой фазе. Химический потенциал каждого газообразного вещества в реакционной смеси может быть записан как частная производная энергии Гиббса по числу молей данного вещества:
![]()
Если в систему добавляется бесконечно малые количества разных газов (dn1, dn2 … dnk) при постоянном давлении и постоянной температуре, то суммарное изменение энергии Гиббса буден равно:
![]()
Изменение энергии Гиббса при изменении конечного числа молей веществ в газообразной смеси за счет протекания химической реакции можно записать как
![]() ,
,
где Δni – изменение числа молей i-го вещества в ходе химической реакции.
![]() ,
,
аналогично
![]()
![]()
![]()
Для данной химической реакции изменение энергии Гиббса
![]() ,
,
а для каждого участника реакции
![]()
Тогда
![]() или
или
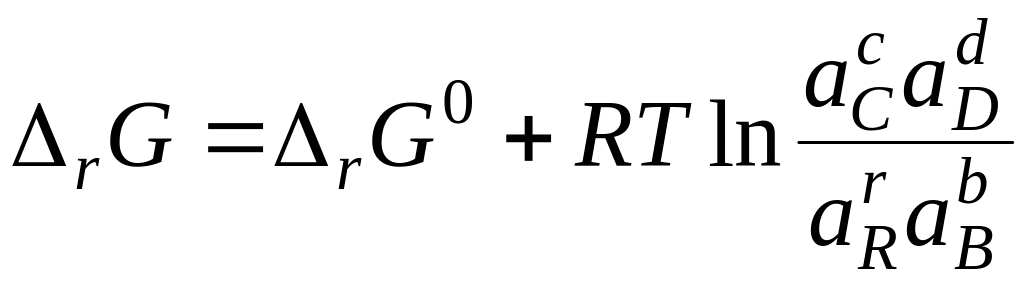
В общем виде для любой реакции
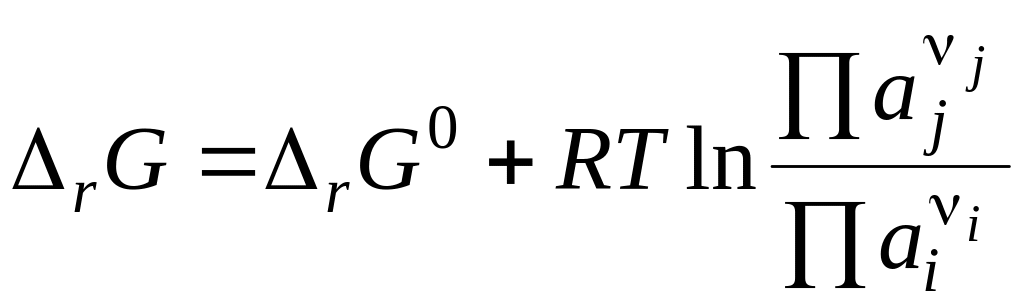 .
.
Полученное уравнение называется уравнением изотермы химической реакции. Здесь ΔrG0 - стандартное изменение энергии Гиббса – не зависит от состава системы, так как в него входят стандартные химические потенциалы.
3. Химическое равновесие
Многие химические процессы в химико-технологических системах являются двусторонними – они могут протекать как в прямом, так и в обратном направлении. Скорость химических реакций пропорциональна концентрации реагентов. Для большинства реакций скорость прямой реакции падает во времени, а скорость обратной реакции растет по мере накопления реагентов. При достижении равенства скорости прямой и обратной реакции наступает равновесие. Химическое равновесие является динамическим равновесием, при котором прямая и обратная реакция идут с одинаковыми скоростями. При этом концентрации исходных веществ и продуктов реакции не меняются и называются равновесными концентрациями.
3. 1. Константы равновесия
В разд. 2. 3. 3. 2 было показано, что при химическом равновесии свободная энергия Гиббса принимает минимальное значение, и далее ее изменения не происходит: ΔrG = 0. Уравнение изотермы химической реакции при равновесии примет вид:
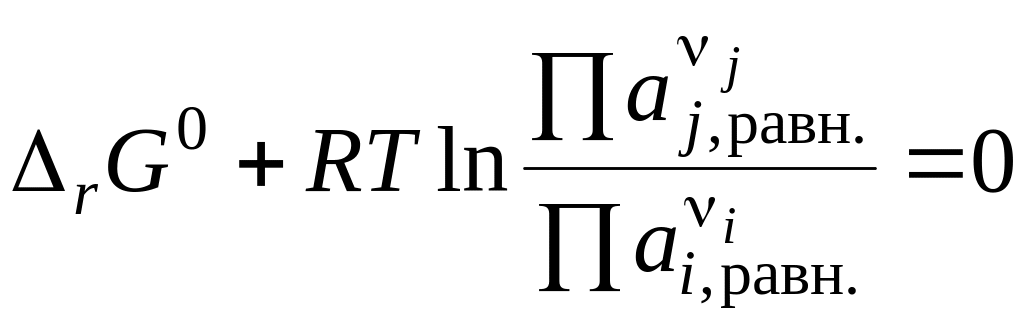
Обозначим
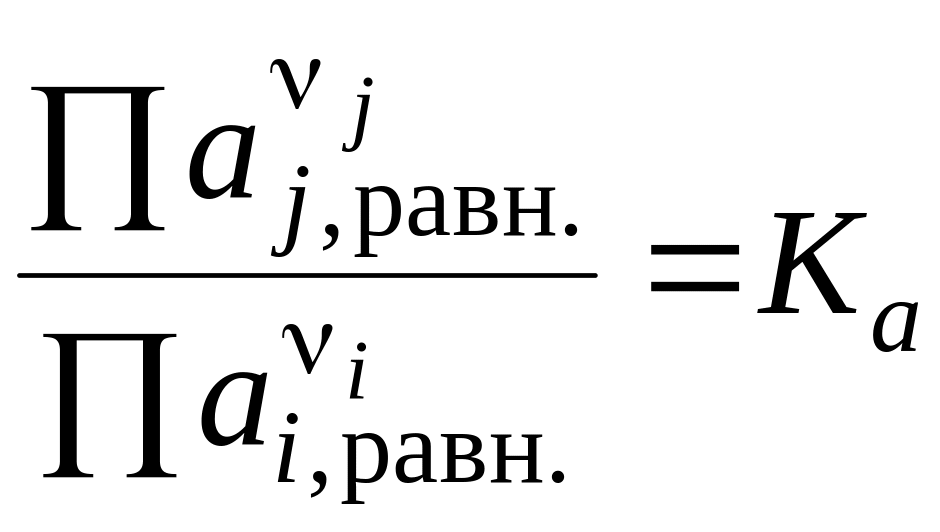 ,
,
тогда
![]()
или
![]()
Полученное уравнение называется частным уравнением изотермы химической реакции. Оно справедливо для состояния равновесия, а выражение называется термодинамической константой равновесия.
Термодинамическая константа равновесия может быть рассчитана, если известно изменение энергии Гиббса системы в результате протекания химической реакции при стандартном давлении и данной температуре:
![]()
Термодинамическая константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от давления, поскольку изменение стандартной энергии Гиббса не зависит от давления по определению.
Поскольку
![]() величина константы равновесия может
принимать значения от нуля до бесконечности
величина константы равновесия может
принимать значения от нуля до бесконечности
![]()
Термодинамическая константа равновесия может быть выражена как через активности веществ, участвующих в реакции, Ka (п. 3. 1.), так и через фугитивности Kf:
 ,
,
Термодинамические константы равновесия являются безразмерными величинами.
Кроме термодинамических констант равновесие могут характеризовать практические константы равновесия. Практические константы равновесия могут быть рассчитаны, если при равновесии определить количества или концентрации веществ, участвующих в реакции тем или иным методом химического или физико-химического анализа. Они могут быть выражены
через числа молей веществ ni,j в равновесии:
 ;
;
через молярные концентрации веществ Ci,j в равновесии:
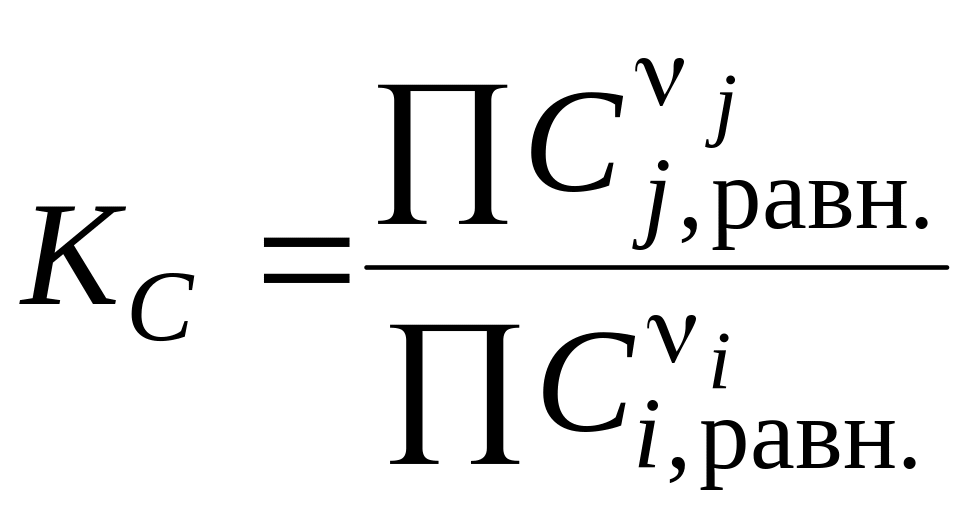 ;
;
через мольные доли веществ Ni,j в равновесии:
 ;
;
через парциальные давления веществ Pi,j в равновесии:

В отличие от термодинамических констант равновесия, практические константы являются размерными величинами.
Между термодинамическими и практическими константами равновесия существует определенная математическая связь. Найдем связь между термодинамической константой равновесия Ka и константой равновесия, выраженной через приведенные парциальные давления. Так как
![]() ,
,
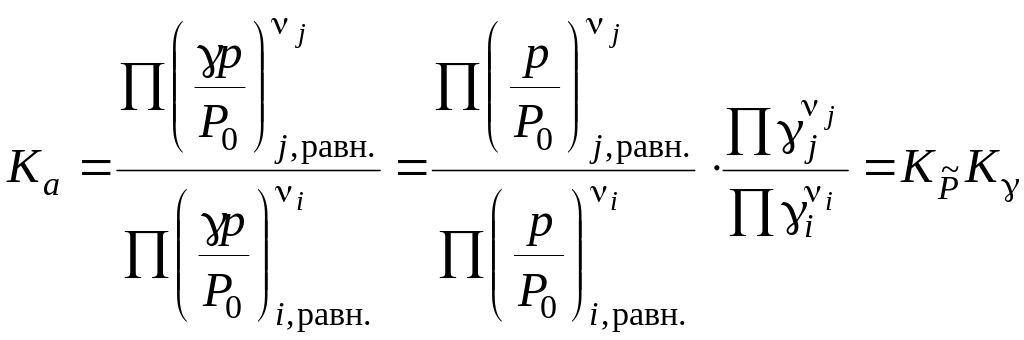 ,
,
где
![]() - константа равновесия, выраженная через
приведенные парциальные давления
- константа равновесия, выраженная через
приведенные парциальные давления
![]() .
.
При давлениях ≤ 50 атмосфер свойства газов близки к свойствам идеальных газов, и γi,j = 1. Тогда Kγ = 1 и
= Ka (при P ≤ 50 атм)
Таким образом, если химическая реакция протекает при не очень высоких давлениях (P ≤ 50), то константа равновесия, выраженная через приведенные давления, равна термодинамической константе равновесия и является безразмерной величиной.
Найдем связь между константой равновесия, выраженной через приведенные давления и практической константой равновесия, выраженной через количества молей веществ, участвующих в реакции Kn. Так как приведенные парциальные давления по закону Дальтона равны
![]() ,
,
а мольные доли выражаются как отношения
![]() ,
,
то
![]()
При подстановке последнего выражения в формулу константы равновесия, выраженной через приведенные давления, получим
 ,
,
где
![]() .
.
Связь термодинамической Ka = и практической Kn констант равновесия используется для расчета равновесного состава и равновесного выхода продуктов реакции.
