
- •Химико-технологические системы
- •Содержание
- •Введение
- •1. Химико-технологические процессы и химико-технологические системы
- •1. Термины и определения
- •2. Технологические критерии эффективности химико-технологических систем
- •1. 2. 1. Степень превращения
- •1. 2. 2. Выход продукта
- •1. 2. 4. Производительность и интенсивность
- •1. 2. 5. Избирательность
- •1. 3. Структуры химико-технологических систем
- •1. 3. 1. Хтс с последовательной технологической связью
- •1. 3. 2. Параллельная технологическая связь
- •1. 3. 3. Последовательно-обводная технологическая связь (байпас)
- •1. 3. 4. Обратная (рециркуляционная) технологическая связь
- •1. 3. 5. Перекрестная технологическая связь
- •1. 4. Системный декомпозиционный анализ химико-технологических систем
- •4. 1. Молекулярно-кинетический уровень
- •1. 4. 2. Макрокинетический уровень
- •1. 4. 3. Аппаратный уровень
- •1. 4. 4. Уровень химико-технологической системы
- •1. 4. 4. 1. Синтез химико-технологической системы
- •1. 4. 4. 2. Анализ химико-технологической системы в целом
- •1. 4. 4. 3. Оптимизация химико-технологической системы
- •2. Химическая термодинамика
- •2. 1. Основные понятия и определения
- •2. 2. Первое начало термодинамики
- •2. 2. 1. Работа расширения идеального газа
- •2. 2. 2. Теплота процесса в различных условиях
- •2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
- •2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
- •2. 3. Второе начало термодинамики
- •2. 3. 1. Термодинамически обратимые и необратимые процессы.
- •2. 3. 2. Математическое выражение второго начала термодинамики. Энтропия.
- •2. 3. 2. 1. Энтропия и термодинамическая вероятность
- •2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
- •2. 3. 2. 3. Изменение энтропии при нагревании
- •2. 3. 2. 4. Изменение энтропии при фазовых превращениях
- •2. 3. 2. 5. Расчет абсолютной энтропии вещества
- •2. 3. 2. 6. Изменение энтропии при химическом превращении
- •2. 3. 3. Применение второго начала термодинамики к химическим процессам.
- •2. 3. 3. 1. Термодинамические потенциалы
- •2. 3. 3. 2. Уравнение Гиббса-Гельмгольца
- •2. 3. 3. 3. Критерии направления процессов в закрытых системах
- •2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность.
- •2. 3. 5. Уравнение изотермы химической реакции
- •3. Химическое равновесие
- •3. 1. Константы равновесия
- •3. 2. Расчет равновесного состава и равновесного выхода продуктов химической реакции
- •3. 3. Влияние температуры и давления на равновесный выход продуктов реакции. Принцип Ле Шателье.
- •3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции.
- •3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции.
- •4. Фазовые равновесия
- •4. 1. Основные понятия и определения
- •4. 2. Условия равновесного сосуществования фаз
- •4. 3. Правило фаз Гиббса
- •4. 4. Однокомпонентные системы
- •4. 4. 1. Уравнение Клапейрона-Клаузиуса
- •4. 4. 1. 1. Применение уравнения Клапейрона-Клаузиуса к процессу плавления
- •4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
- •4. 4. 2. Диаграмма состояния однокомпонентной системы
- •4. 5. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 6. Двухкомпонентные системы
- •4. 6. 1. Бинарные системы взаимно растворимых жидкостей.
- •4. 6. 1. 1. Общая характеристика растворов
- •4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора
- •4. 6. 1. 3. Правило рычага
- •4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов
- •4. 6. 1. 5. Разделение бинарных растворов
- •4. 6. 2. Системы взаимно нерастворимых жидкостей
- •4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
- •4. 6. 2. 2. Перегонка с водяным паром
- •4. 7. Трехкомпонентные системы
- •4. 7. 1. Закон распределения
- •4. 7. 2. Экстрагирование
- •Библиографический список
4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
Испарение – это процесс перехода из жидкого состояния в газообразное. Газ, полученный испарением жидкости, называют паром. Изменение молярного объема при испарении представляет собой разность между объемом 1 моля вещества в парообразном и в жидком состоянии:
ΔVисп. = Vпар – Vж.
В одинаковых условиях молярный объем любого вещества в паровой фазе во много раз больше, чем объем 1 моля в жидком виде. Например, объем 1 моля воды в парообразном состоянии при температуре кипения (373 К) стандартном давлении (101,320 кПа) составляет 30,6 л, как легко рассчитать из уравнения Менделеева-Клапейрона. В жидком же состоянии при этих условиях 1 моль воды занимает объем 18,8 см3 . Поэтому можно считать, что
ΔVисп. = Vпар – Vж. ≈ Vпар
Из уравнения Менделеева-Клапейрона
для 1 моля вещества (n = 1) Vпар = P/RT. Тогда уравнение Клаузиуса –Клапейрона для процесса испарения примет вид:
![]()
или
![]()
Разделим переменные и проинтегрируем
![]()
При температурах, далеких от критической температуры, можно считать, что теплота испарения не зависит от температуры, тогда
![]()
и
![]()
Полученное уравнение является уравнением Клаузиуса-Клапейрона в интегральной форме. Оно описывает зависимость давления насыщенного пара от температуры. Насыщенным называется пар, находящийся в равновесии с жидкостью. Данное уравнение можно представить в виде
![]() ,
,
где
коэффициент A
равен константе интегрирования (A
= const),
а
![]() ,
,
Из этого уравнения видно, что график зависимости lnP = f(1/T) представляет собой прямую линию, из тангенса угла наклона которой можно найти теплоту испарения (рис. 4).
1/T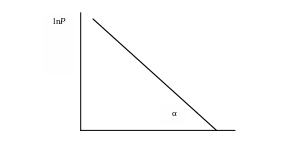
Рис.4. Зависимость логарифма давления насыщенного пара от обратной температуры.
tgα = - B, а ΔHисп. = BR
Для процесса возгонки – перехода из твердого состояния в газообразное – интегральная форма уравнения Клапейрона-Клаузиуса имеет аналогичный вид:
![]() ,
,
так как молярный объем любого вещества в твердом состоянии много меньше молярного объема вещества в газообразном состоянии и выполняется соотношение
ΔVвозг. = Vгаз – Vтв. ≈ Vгаз.
4. 4. 2. Диаграмма состояния однокомпонентной системы
Зависимость давления от температуры для различных фазовых превращений в равновесных условиях, вытекающие из уравнения Клаузиуса- Клапейрона, могут быть представлены в виде диаграммы состояния однокомпонентной системы.
На рис. 5 в качестве примера приведена диаграмма состояния воды.

Рис. 5. Диаграмма состояния воды в области невысоких давлений (приведена схематично без соблюдения масштаба).
На диаграмме видны:
- три области давлений и температур, при которых устойчиво существуют твердая (лед), жидкая и газообразная фазы;
- три линии, разделяющие эти области и отвечающие равновесному сосуществованию твердой и жидкой фаз (кривая плавления OB), твердой и газообразной фаз (кривая возгонки OA), жидкой и газообразной (парообразной) фаз (кривая испарения OK);
- точка O, в которой сходятся три линии, что соответствует равновесному сосуществованию трех фаз – твердой, жидкой и газообразной – так называемая, тройная точка.
Рассчитаем число степеней свободы в состоянии, которому соответствует точка O:
![]() ,
,
т. е. система нонвариантна. Это означает, что существуют только одно определенное значение температуры (273,16 К) и одно определенное значение давление насыщенного пара воды (610 Па), при которых сосуществуют три фазы. Изменение хотя бы одного из параметров – температуры или давления – приводит к изменению числа фаз в системе. Так как сосуществованию трех фаз соответствует строго определенная температура, тройную точку воды используют для создания эталона температуры. Первичный государственный эталон температуры хранится в Санкт-Петербурге во Всероссийском научно-исследовательском институте метрологии им. Д. И. Менделеева.
В любой точке, лежащей на линиях, соответствующих равновесию между двумя фазами, число степеней свободы равно:
![]()
Это означает, что, сохраняя двухфазное равновесие, независимо можно менять только один параметр – или давление, или температуру. Второй параметр будет изменяться в соответствии с уравнением Клаузиуса-Клапейрона.
Точки на диаграмме состояния, лежащие в областях существования одной из фаз – льда, жидкой воды или пара – отвечают состояниям системы с числом термодинамических степеней свободы
![]()
