
- •Химико-технологические системы
- •Содержание
- •Введение
- •1. Химико-технологические процессы и химико-технологические системы
- •1. Термины и определения
- •2. Технологические критерии эффективности химико-технологических систем
- •1. 2. 1. Степень превращения
- •1. 2. 2. Выход продукта
- •1. 2. 4. Производительность и интенсивность
- •1. 2. 5. Избирательность
- •1. 3. Структуры химико-технологических систем
- •1. 3. 1. Хтс с последовательной технологической связью
- •1. 3. 2. Параллельная технологическая связь
- •1. 3. 3. Последовательно-обводная технологическая связь (байпас)
- •1. 3. 4. Обратная (рециркуляционная) технологическая связь
- •1. 3. 5. Перекрестная технологическая связь
- •1. 4. Системный декомпозиционный анализ химико-технологических систем
- •4. 1. Молекулярно-кинетический уровень
- •1. 4. 2. Макрокинетический уровень
- •1. 4. 3. Аппаратный уровень
- •1. 4. 4. Уровень химико-технологической системы
- •1. 4. 4. 1. Синтез химико-технологической системы
- •1. 4. 4. 2. Анализ химико-технологической системы в целом
- •1. 4. 4. 3. Оптимизация химико-технологической системы
- •2. Химическая термодинамика
- •2. 1. Основные понятия и определения
- •2. 2. Первое начало термодинамики
- •2. 2. 1. Работа расширения идеального газа
- •2. 2. 2. Теплота процесса в различных условиях
- •2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
- •2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
- •2. 3. Второе начало термодинамики
- •2. 3. 1. Термодинамически обратимые и необратимые процессы.
- •2. 3. 2. Математическое выражение второго начала термодинамики. Энтропия.
- •2. 3. 2. 1. Энтропия и термодинамическая вероятность
- •2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
- •2. 3. 2. 3. Изменение энтропии при нагревании
- •2. 3. 2. 4. Изменение энтропии при фазовых превращениях
- •2. 3. 2. 5. Расчет абсолютной энтропии вещества
- •2. 3. 2. 6. Изменение энтропии при химическом превращении
- •2. 3. 3. Применение второго начала термодинамики к химическим процессам.
- •2. 3. 3. 1. Термодинамические потенциалы
- •2. 3. 3. 2. Уравнение Гиббса-Гельмгольца
- •2. 3. 3. 3. Критерии направления процессов в закрытых системах
- •2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность.
- •2. 3. 5. Уравнение изотермы химической реакции
- •3. Химическое равновесие
- •3. 1. Константы равновесия
- •3. 2. Расчет равновесного состава и равновесного выхода продуктов химической реакции
- •3. 3. Влияние температуры и давления на равновесный выход продуктов реакции. Принцип Ле Шателье.
- •3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции.
- •3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции.
- •4. Фазовые равновесия
- •4. 1. Основные понятия и определения
- •4. 2. Условия равновесного сосуществования фаз
- •4. 3. Правило фаз Гиббса
- •4. 4. Однокомпонентные системы
- •4. 4. 1. Уравнение Клапейрона-Клаузиуса
- •4. 4. 1. 1. Применение уравнения Клапейрона-Клаузиуса к процессу плавления
- •4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
- •4. 4. 2. Диаграмма состояния однокомпонентной системы
- •4. 5. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 6. Двухкомпонентные системы
- •4. 6. 1. Бинарные системы взаимно растворимых жидкостей.
- •4. 6. 1. 1. Общая характеристика растворов
- •4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора
- •4. 6. 1. 3. Правило рычага
- •4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов
- •4. 6. 1. 5. Разделение бинарных растворов
- •4. 6. 2. Системы взаимно нерастворимых жидкостей
- •4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
- •4. 6. 2. 2. Перегонка с водяным паром
- •4. 7. Трехкомпонентные системы
- •4. 7. 1. Закон распределения
- •4. 7. 2. Экстрагирование
- •Библиографический список
2. 2. Первое начало термодинамики
Первое начало термодинамики представляет собой одну из формулировок закона сохранения энергии.
Для закрытой системы первое начало может быть сформулировано следующим образом:
В любом процессе изменение внутренней энергии равно разности между количеством подведенной теплоты и количеством совершенной работы:
![]()
или для бесконечно малого изменения внутренней энергии
![]()
Теплота и работа являются функциями процесса, их изменение зависит от пути протекания процесса. Поэтому бесконечно малые величины теплоты и работы не обладают свойствами дифференциала и для их обозначения используют греческую букву δ. Внутренняя энергия, напротив, является функцией состояния, поэтому для обозначения её бесконечно малого изменения используется знак дифференциала (dU).
В химической термодинамике рассматриваются процессы, связанные с превращениями теплоты и работы, поэтому первое начало термодинамики представляют в виде
![]()
для бесконечно малого процесса или для конечного процесса:
![]()
Итак, согласно первому началу термодинамики:
Теплота, подведенная к закрытой системе, расходуется на увеличение ее внутренней энергии и совершение работы.
В химико-технологических системах обычно совершается работа против внешнего давления.
В термодинамике используют следующую систему знаков. Положительной считают теплоту, подведенную к системе, а отрицательной – отведенную от нее. Работу, совершенную системой, считают положительной, а совершаемую над системой, например, работу сжатия – отрицательной.
2. 2. 1. Работа расширения идеального газа
Рассмотрим работу расширения газов, которое происходит во многих химико-технологических процессах. При не очень высоких давлениях ( P < 50 ат) свойства газов близки к свойствам идеального газа.
В общем случае работа расширении газа в бесконечно малом процессе равна
![]()
Для реального конечного процесса расширения газа
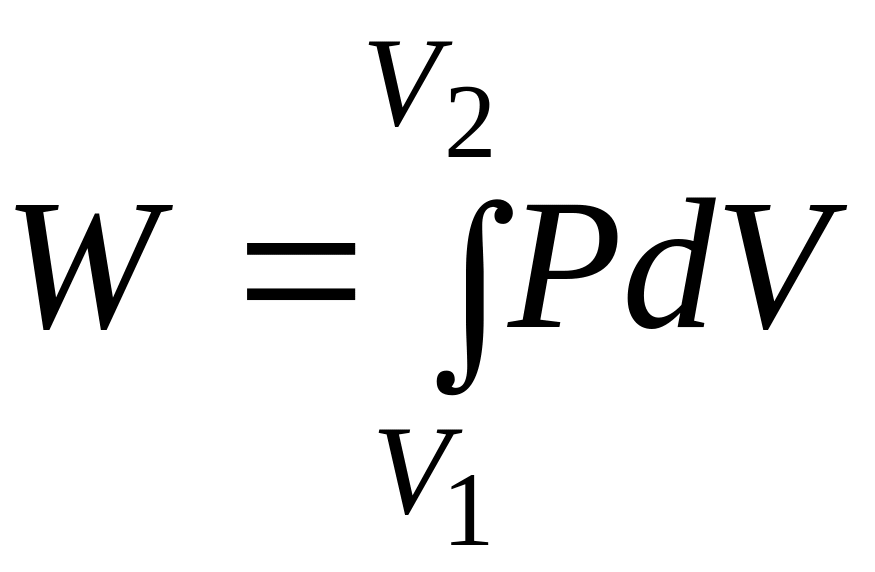
При не очень высоких давлениях (P < 50 ат) свойства газов близки к свойствам идеального газа. Поэтому для вычисления работы расширения будем использовать уравнение состояния идеального газа Менделеева-Клапейрона.
Работа расширения как функция процесса зависит от условий, в которых протекает процесс.
Изохорный процесс (V = const):
Если процесс протекает при постоянном объеме системы, то изменение объема dV = 0, тогда
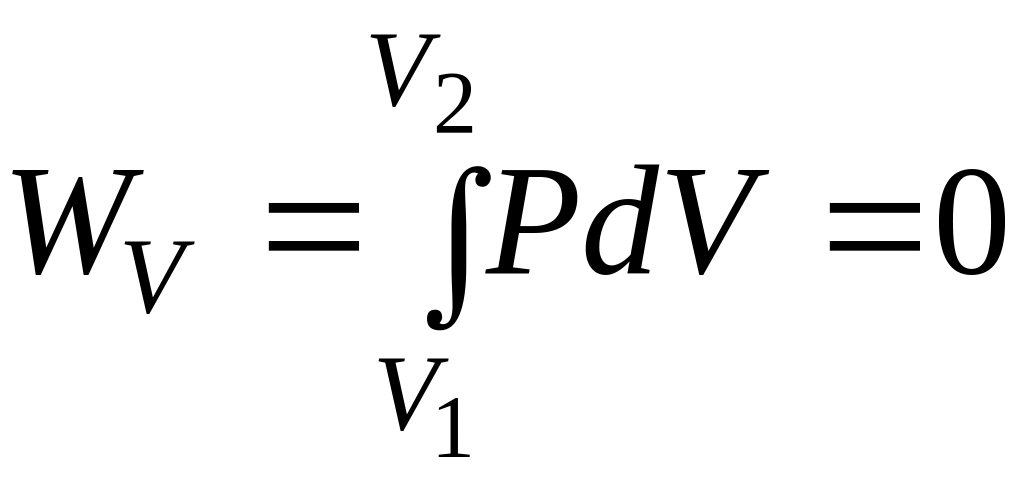
Изотермический процесс (T =const):
Из уравнения Менделеева-Клапейрона
![]() ,
,
тогда при T = const
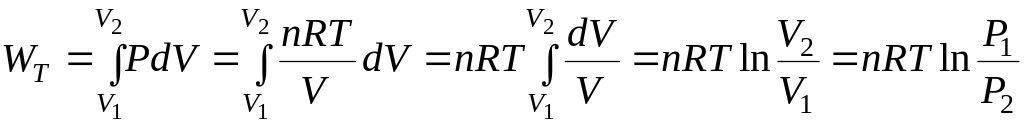
Изобарный процесс (P = const):

Изобарно-изотермический процесс (P = const и T = const):
Из уравнения Менделеева-Клапейрона
![]()
![]()

Таким образом, в изобарно-изотермических условиях работа расширения может совершаться только за счет изменения числа молей газа.
2. 2. 2. Теплота процесса в различных условиях
Изохорный процесс (V = const):
Работа изохорного процесса W = 0. Тогда, как следует из первого начала термодинамики, теплота процесса в изохорных условиях QV равна изменению внутренней энергии:
![]()
Так
как внутренняя энергия является функцией
состояния, то в изохорных условиях
теплота
![]() приобретает
свойства функции состояния.
приобретает
свойства функции состояния.
Изотермический процесс (T =const):
По закону Гей-Люсака-Джоуля внутренняя энергия идеального газа зависит только от температуры и не зависит от объема и давления. Следовательно, в изотермическом процессе не происходит изменения внутренней энергии (ΔU = 0). Тогда из первого начала термодинамики следует
![]()
Таким образом, вся теплота в изотермическом процессе идет на совершение работы, Работа изотермического процесса совершается за счет подведенной теплоты.
Изобарный процесс (P = const):
![]()
или для конечного процесса
![]()
Функция H = U + PV называется энтальпией.
Энтальпия, как и внутренняя энергия, является функцией состояния, поэтому в изобарных условиях теплота QP приобретает свойства функции состояния.
Изохорный и изобарный тепловые эффекты связаны соотношением
![]()
Все выведенные закономерности для расчета теплоты процесса выполняются и для химических реакций. Если в результате химической реакции теплота поглощается, то тепловой эффект считается положительным (Q > 0), а реакция называется эндотермической. Если в результате химической реакции теплота выделяется, то тепловой эффект считается отрицательным(Q < 0), а реакция называется экзотермической. Теплота, которая выделяется или поглощается в результате химической реакции, зависит от условий проведения реакции. При проектировании химико-технологических систем очень важно знать величину и знак теплового эффекта реакции. В химико-технологических системах реакции проводят чаще всего в изобарно изотермических условиях.
Методы расчета и измерения тепловых эффектов химических реакций рассматриваются в разделе физической химии – термохимии. Рассмотрим практически важные из них.
