
- •Химико-технологические системы
- •Содержание
- •Введение
- •1. Химико-технологические процессы и химико-технологические системы
- •1. Термины и определения
- •2. Технологические критерии эффективности химико-технологических систем
- •1. 2. 1. Степень превращения
- •1. 2. 2. Выход продукта
- •1. 2. 4. Производительность и интенсивность
- •1. 2. 5. Избирательность
- •1. 3. Структуры химико-технологических систем
- •1. 3. 1. Хтс с последовательной технологической связью
- •1. 3. 2. Параллельная технологическая связь
- •1. 3. 3. Последовательно-обводная технологическая связь (байпас)
- •1. 3. 4. Обратная (рециркуляционная) технологическая связь
- •1. 3. 5. Перекрестная технологическая связь
- •1. 4. Системный декомпозиционный анализ химико-технологических систем
- •4. 1. Молекулярно-кинетический уровень
- •1. 4. 2. Макрокинетический уровень
- •1. 4. 3. Аппаратный уровень
- •1. 4. 4. Уровень химико-технологической системы
- •1. 4. 4. 1. Синтез химико-технологической системы
- •1. 4. 4. 2. Анализ химико-технологической системы в целом
- •1. 4. 4. 3. Оптимизация химико-технологической системы
- •2. Химическая термодинамика
- •2. 1. Основные понятия и определения
- •2. 2. Первое начало термодинамики
- •2. 2. 1. Работа расширения идеального газа
- •2. 2. 2. Теплота процесса в различных условиях
- •2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
- •2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
- •2. 3. Второе начало термодинамики
- •2. 3. 1. Термодинамически обратимые и необратимые процессы.
- •2. 3. 2. Математическое выражение второго начала термодинамики. Энтропия.
- •2. 3. 2. 1. Энтропия и термодинамическая вероятность
- •2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
- •2. 3. 2. 3. Изменение энтропии при нагревании
- •2. 3. 2. 4. Изменение энтропии при фазовых превращениях
- •2. 3. 2. 5. Расчет абсолютной энтропии вещества
- •2. 3. 2. 6. Изменение энтропии при химическом превращении
- •2. 3. 3. Применение второго начала термодинамики к химическим процессам.
- •2. 3. 3. 1. Термодинамические потенциалы
- •2. 3. 3. 2. Уравнение Гиббса-Гельмгольца
- •2. 3. 3. 3. Критерии направления процессов в закрытых системах
- •2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность.
- •2. 3. 5. Уравнение изотермы химической реакции
- •3. Химическое равновесие
- •3. 1. Константы равновесия
- •3. 2. Расчет равновесного состава и равновесного выхода продуктов химической реакции
- •3. 3. Влияние температуры и давления на равновесный выход продуктов реакции. Принцип Ле Шателье.
- •3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции.
- •3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции.
- •4. Фазовые равновесия
- •4. 1. Основные понятия и определения
- •4. 2. Условия равновесного сосуществования фаз
- •4. 3. Правило фаз Гиббса
- •4. 4. Однокомпонентные системы
- •4. 4. 1. Уравнение Клапейрона-Клаузиуса
- •4. 4. 1. 1. Применение уравнения Клапейрона-Клаузиуса к процессу плавления
- •4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
- •4. 4. 2. Диаграмма состояния однокомпонентной системы
- •4. 5. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 6. Двухкомпонентные системы
- •4. 6. 1. Бинарные системы взаимно растворимых жидкостей.
- •4. 6. 1. 1. Общая характеристика растворов
- •4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора
- •4. 6. 1. 3. Правило рычага
- •4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов
- •4. 6. 1. 5. Разделение бинарных растворов
- •4. 6. 2. Системы взаимно нерастворимых жидкостей
- •4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
- •4. 6. 2. 2. Перегонка с водяным паром
- •4. 7. Трехкомпонентные системы
- •4. 7. 1. Закон распределения
- •4. 7. 2. Экстрагирование
- •Библиографический список
2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
Закон Гесса является основным законом термохимии. Он гласит:
Тепловой эффект процесса не зависит от пути его протекания (промежуточных стадий), а определяется начальным и конечным состоянием системы при условии, что давление и температура или объем системы и температура в ходе всего процесса остаются постоянными.
Закон Гесса позволяет рассчитывать тепловые эффекты реакций, если известны тепловые эффекты других реакций с участием тех же веществ. Из закона Гесса следует два важных следствия.
1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ (с учетом стехиометрических коэффициентов).
Теплотой
образования вещества
называется
тепловой эффект реакции образования
одного моля вещества из простых веществ.
Простым веществом называется химическое
соединение, состоящее из атомов одного
элемента, в наиболее устойчивой
модификации при данных условиях. В
изобарных условиях теплота образования
обозначается ΔHf
(f
– сокращение от английского слова
formation).
Значения теплот образования при
стандартных условиях
![]() для большого количества веществ приведены
в справочниках.
для большого количества веществ приведены
в справочниках.
Тепловой эффект реакции в изобарных условиях ΔrH можно рассчитать, в соответствии со следствием из закона Гесса, по уравнению:
![]() ,
,
где
индексы i
относятся к исходным веществам или
реагентам (исх.), а индексы j
–
к конечным веществам или продуктам
реакции (кон.);
![]() и
и
![]() - стехиометрические коэффициенты в
уравнении реакции для исходных веществ
и продуктов реакции, соответственно.
- стехиометрические коэффициенты в
уравнении реакции для исходных веществ
и продуктов реакции, соответственно.
В стандартных условиях тепловой эффект химической реакции может быть рассчитан по справочным значениям теплот образования :
![]()
2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов).
Теплотой
сгорания вещества ΔHc
(combustion
– горение)
называется
тепловой эффект реакции сгорания одного
моля вещества в избытке кислорода до
CO2,
H2O(ж.),
N2,
SO2
и галогеноводородов. Стандартные теплоты
сгорания
![]() можно
найти в справочниках, однако, они
приведены для значительно меньшего
количества веществ (в основном
органических), чем теплоты образования.
можно
найти в справочниках, однако, они
приведены для значительно меньшего
количества веществ (в основном
органических), чем теплоты образования.
Тепловой эффект химической реакции с использованием теплот сгорания можно рассчитать по уравнению
![]()
2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
Пользуясь следствиями из закона Гесса можно рассчитать тепловой эффект реакции только при стандартной температуре 298 К, так как в справочниках приводятся только стандартные теплоты образовании и сгорания. Большинство же химических реакций в химико-технологических системах ведут при повышенных температурах, чтобы повысить скорость реакций и, следовательно, повысить производительность системы. Для того, чтобы рассчитать тепловой эффект химической реакции при любой температуре надо знать вид зависимости теплового эффекта от температуры ΔrH = f(T).
Рассмотрим реакцию
![]() ,
,
протекающую в изобарных условиях. Тепловой эффект реакции QP = ΔrH можно представить как разность сумм энтальпий продуктов реакции и исходных веществ:
![]()
Продифференцируем полученное выражение по температуре:
![]()
Производная
энтальпии по температуре
![]() для вещества является его истинной
изобарной теплоемкостью, так как она
характеризует бесконечно малое количество
теплоты, необходимое для нагревания
вещества на бесконечно малую температуру
в изобарных условиях:
для вещества является его истинной
изобарной теплоемкостью, так как она
характеризует бесконечно малое количество
теплоты, необходимое для нагревания
вещества на бесконечно малую температуру
в изобарных условиях:
![]()
Тогда
![]()
или в общем виде
![]()
где ΔCP – характеризует изменение изобарной теплоемкости системы в результате протекания химической реакции и называется температурным коэффициентом теплового эффекта реакции.
Полученное выражение
![]()
называется дифференциальным уравнением Кирхгофа. Из него следует, что зависимость теплового эффекта от температуры определяется знаком ΔrCP, т.е. зависит от того, что больше, суммарная теплоемкость исходных веществ или суммарная теплоемкость продуктов реакции. Проанализируем дифференциальное уравнение Кирхгофа.
1.
Если температурный коэффициент ΔrCP
> 0, то производная
![]() > 0 и функция
> 0 и функция
![]() возрастающая. Следовательно, тепловой
эффект реакции с ростом температуры
увеличивается.
возрастающая. Следовательно, тепловой
эффект реакции с ростом температуры
увеличивается.
2. Если температурный коэффициент ΔrCP < 0, то производная < 0 и функция убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается увеличивается.
3.
Если температурный коэффициент ΔrCP
= 0, то производная
= 0 и
![]() .
Следовательно, тепловой эффект реакции
не зависит от температуры. Этот случай
на практике не встречается.
.
Следовательно, тепловой эффект реакции
не зависит от температуры. Этот случай
на практике не встречается.
Дифференциальные уравнения удобны для анализа, но неудобны для расчетов. Чтобы получить уравнение для расчета теплового эффекта химической реакции, проинтегрируем дифференциальное уравнение Кирхгофа, разделив переменные:
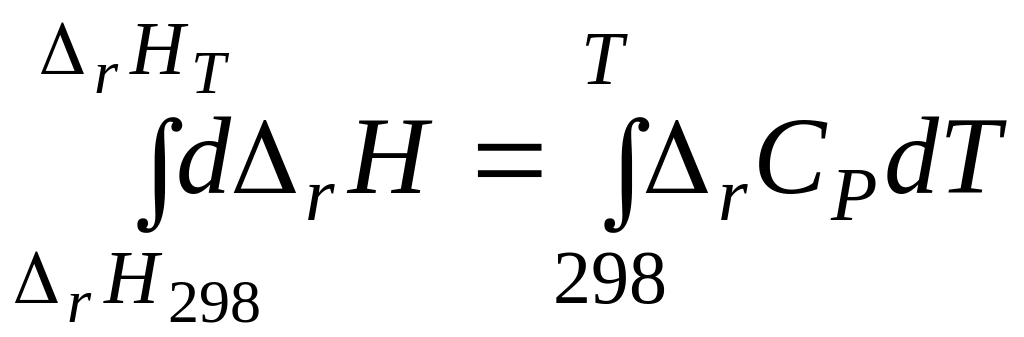
![]()
Теплоемкости
веществ зависят от температуры,
следовательно, и
![]() .
Однако, в области обычно используемых
в химико-технологических процессах
температурах эта зависимость не
значительна. Для практических целей
пользуются средними теплоемкостями
веществ в интервале температур от 298 К
до заданной температуры
.
Однако, в области обычно используемых
в химико-технологических процессах
температурах эта зависимость не
значительна. Для практических целей
пользуются средними теплоемкостями
веществ в интервале температур от 298 К
до заданной температуры
![]() ,
которые приводятся в справочниках.
Температурный коэффициент теплового
эффекта, рассчитанный с использованием
средних теплоемкостей:
,
которые приводятся в справочниках.
Температурный коэффициент теплового
эффекта, рассчитанный с использованием
средних теплоемкостей:
![]()
Тогда
![]() ,
,
откуда
![]()
При стандартном давлении
![]()
Полученное уравнение называется интегральным уравнением Кирхгофа. Оно позволяет рассчитать изобарный тепловой эффект химической реакции при любой температуре, если известен ее тепловой эффект при стандартной температуре (T = 298 К).
