
- •Химико-технологические системы
- •Содержание
- •Введение
- •1. Химико-технологические процессы и химико-технологические системы
- •1. Термины и определения
- •2. Технологические критерии эффективности химико-технологических систем
- •1. 2. 1. Степень превращения
- •1. 2. 2. Выход продукта
- •1. 2. 4. Производительность и интенсивность
- •1. 2. 5. Избирательность
- •1. 3. Структуры химико-технологических систем
- •1. 3. 1. Хтс с последовательной технологической связью
- •1. 3. 2. Параллельная технологическая связь
- •1. 3. 3. Последовательно-обводная технологическая связь (байпас)
- •1. 3. 4. Обратная (рециркуляционная) технологическая связь
- •1. 3. 5. Перекрестная технологическая связь
- •1. 4. Системный декомпозиционный анализ химико-технологических систем
- •4. 1. Молекулярно-кинетический уровень
- •1. 4. 2. Макрокинетический уровень
- •1. 4. 3. Аппаратный уровень
- •1. 4. 4. Уровень химико-технологической системы
- •1. 4. 4. 1. Синтез химико-технологической системы
- •1. 4. 4. 2. Анализ химико-технологической системы в целом
- •1. 4. 4. 3. Оптимизация химико-технологической системы
- •2. Химическая термодинамика
- •2. 1. Основные понятия и определения
- •2. 2. Первое начало термодинамики
- •2. 2. 1. Работа расширения идеального газа
- •2. 2. 2. Теплота процесса в различных условиях
- •2. 2. 3. Закон Гесса. Расчет тепловых эффектов химических реакций с использованием стандартных теплот образования и сгорания.
- •2. 2. 4. Зависимость тепловых эффектов химических реакций от температуры. Закон Кирхгофа
- •2. 3. Второе начало термодинамики
- •2. 3. 1. Термодинамически обратимые и необратимые процессы.
- •2. 3. 2. Математическое выражение второго начала термодинамики. Энтропия.
- •2. 3. 2. 1. Энтропия и термодинамическая вероятность
- •2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
- •2. 3. 2. 3. Изменение энтропии при нагревании
- •2. 3. 2. 4. Изменение энтропии при фазовых превращениях
- •2. 3. 2. 5. Расчет абсолютной энтропии вещества
- •2. 3. 2. 6. Изменение энтропии при химическом превращении
- •2. 3. 3. Применение второго начала термодинамики к химическим процессам.
- •2. 3. 3. 1. Термодинамические потенциалы
- •2. 3. 3. 2. Уравнение Гиббса-Гельмгольца
- •2. 3. 3. 3. Критерии направления процессов в закрытых системах
- •2. 3. 4. Химический потенциал идеального и реального газа. Термодинамическая активность.
- •2. 3. 5. Уравнение изотермы химической реакции
- •3. Химическое равновесие
- •3. 1. Константы равновесия
- •3. 2. Расчет равновесного состава и равновесного выхода продуктов химической реакции
- •3. 3. Влияние температуры и давления на равновесный выход продуктов реакции. Принцип Ле Шателье.
- •3. 3. 1. Зависимость константы равновесия от температуры. Уравнения изобары химической реакции.
- •3. 3. 2. Влияние давления на равновесный выход продуктов химической реакции.
- •4. Фазовые равновесия
- •4. 1. Основные понятия и определения
- •4. 2. Условия равновесного сосуществования фаз
- •4. 3. Правило фаз Гиббса
- •4. 4. Однокомпонентные системы
- •4. 4. 1. Уравнение Клапейрона-Клаузиуса
- •4. 4. 1. 1. Применение уравнения Клапейрона-Клаузиуса к процессу плавления
- •4. 4. 1. 2. Применение уравнения Клапейрона-Клаузиуса к процессам испарения и возгонки
- •4. 4. 2. Диаграмма состояния однокомпонентной системы
- •4. 5. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 6. Двухкомпонентные системы
- •4. 6. 1. Бинарные системы взаимно растворимых жидкостей.
- •4. 6. 1. 1. Общая характеристика растворов
- •4. 6. 1. 2. Диаграмма состояния температура кипения – состав для идеального жидкого раствора
- •4. 6. 1. 3. Правило рычага
- •4. 6. 1. 4. Диаграммы температура кипения – состав для неидеальных растворов
- •4. 6. 1. 5. Разделение бинарных растворов
- •4. 6. 2. Системы взаимно нерастворимых жидкостей
- •4. 6. 2. 1. Диаграмма температура кипения состав для двух несмешивающихся жидкостей
- •4. 6. 2. 2. Перегонка с водяным паром
- •4. 7. Трехкомпонентные системы
- •4. 7. 1. Закон распределения
- •4. 7. 2. Экстрагирование
- •Библиографический список
2. 3. 2. 2. Изменение энтропии как критерий направления процессов.
Для изолированной системы δQ = 0, поэтому dS ≥ 0. Всякий реальный самопроизвольный процесс всегда является необратимым и для него
dS > 0
Следовательно, энтропия может играть роль критерия для выбора направления протекания самопроизвольного процесса. Если изменение энтропии для процесса в изолированной системе больше нуля (энтропия возрастает), то такой процесс может протекать самопроизвольно. Самопроизвольный процесс приводит систему в состояние равновесия, и энтропия при этом достигает своего максимального значения. Таким образом, введение в термодинамику энтропии как функции состояния, позволяет сделать очень важный вывод, который следует из математической формулировки второго начала термодинамики:
В изолированных системах самопроизвольные процессы могут протекать только в направлении возрастания энтропии, а в состоянии равновесия энтропия имеет максимальное значение.
2. 3. 2. 3. Изменение энтропии при нагревании
В изобарных условиях (Р = const) теплота процесса равна изменению энтальпии, и тогда
![]()
Изменение энтропии при нагревании ΔSнагр. от температуры T1 до температуры T2:
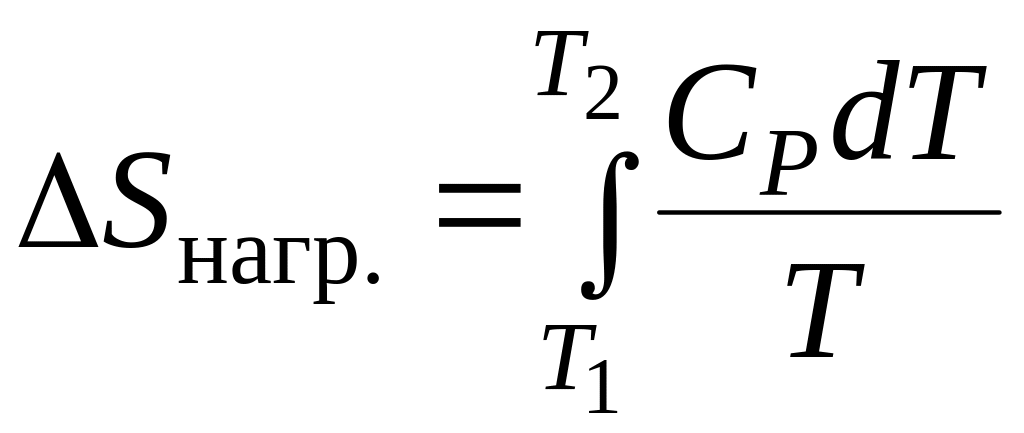
Если использовать средние теплоемкости в интервале температур от T1 до T2, то изменение энтропии при нагревании, может быть рассчитано как
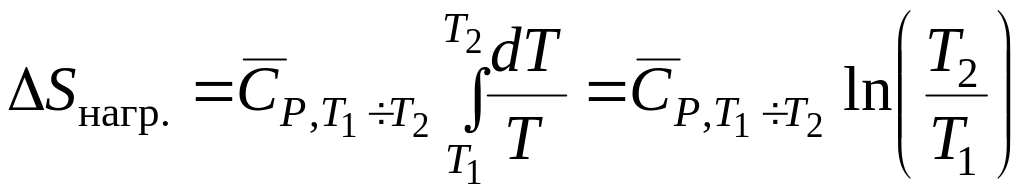
Так как T2 > T1 , то ΔSнагр.> 0, т. е. при нагревании энтропия возрастает. Это соответствует физическому смыслу энтропии, так как при повышении температуры скорость хаотичного движения молекул возрастает.
2. 3. 2. 4. Изменение энтропии при фазовых превращениях
Фазовые превращения (плавление, испарение, возгонка и др.) происходят при неизменных температуре и давлении, поэтому в общем виде изменение энтропии при фазовом превращении ΔSф.п. равно
![]()
Процессы плавления (твердое вещество → жидкость), испарения (жидкость → газ) и возгонки (твердое вещество → газ) протекают с поглощением тепла, т.е. в этих процессах ΔHф.п. > 0. Поэтому при плавлении, испарении и возгонке энтропия возрастает, что так же соответствует ее физическому смыслу. Изменение энтропии в процессах фазовых переходах происходит скачком при температуре данного фазового перехода.
2. 3. 2. 5. Расчет абсолютной энтропии вещества
В отличие от внутренней энергии и энтальпии расчет абсолютного значения энтропии оказывается возможным. Это следует из постулата Планка:
Энтропия идеального (не имеющего дефектов) кристалла при температуре абсолютного нуля равна нулю (ST=0 = 0).
Таким образом, энтропия вещества при температуре равна:
![]()
Если с веществом при нагревании от абсолютного нуля не происходит фазовых или агрегатных превращений, то абсолютная энтропия при температуре T равна:
![]() ,
,
где CP,тв. – изобарная теплоемкость твердого вещества а идеальном кристаллическом состоянии.
Если в интервале температур от 0 К до Т с веществом происходят фазовые или агрегатные превращения, то для вычисления абсолютной энтропии вещества при температуре Т нужно знать его теплоемкости в различных агрегатных (фазовых) состояниях, температуры и теплоты этих превращений. Тогда значения абсолютной энтропии при любой температуре T может быть рассчитано по уравнению:
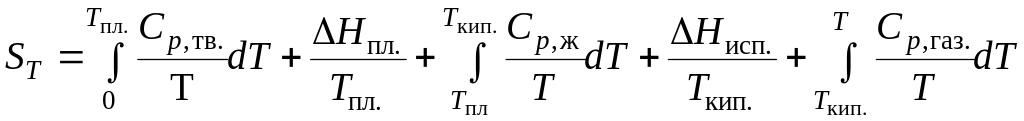
По
этому уравнению рассчитаны абсолютные
энтропии для многих веществ при
стандартных условиях (![]() ),
значения которых приведены в справочниках.
),
значения которых приведены в справочниках.
