
- •Реакция Фаворского
- •Получение реактивов Гриньяра
- •28. Понятие об илидах. Применение илидов в органическом синтезе (реакции Виттига, Хорнера-Виттига, Петерсена, синтезы с использованием илидов серы и т.Д.). Амполунг-реагенты.
- •Примеры Umpolung
- •Методы получения алкенов:
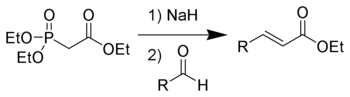
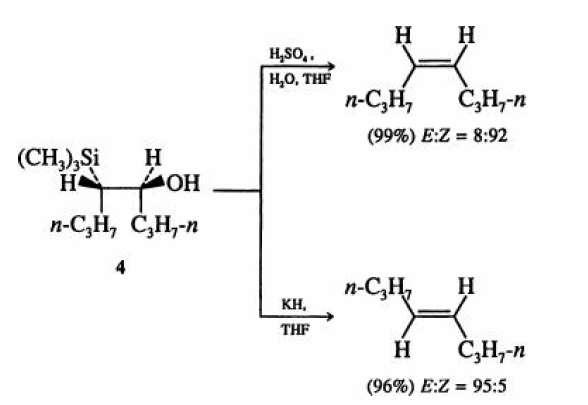
- •Методы получения алкинов
- •Второе уравнение не надо!
- •Реакции олигомеризации
- •Получение ароматических углеводородов
- •Тримеризация алкинов над активированным углем (реакция Зелинского):
28. Понятие об илидах. Применение илидов в органическом синтезе (реакции Виттига, Хорнера-Виттига, Петерсена, синтезы с использованием илидов серы и т.Д.). Амполунг-реагенты.
ИЛИДЫ, соед. общей ф-лы I (п = 1-3 определяется валентностью атома Z); особый тип цвиттер-ионов.
ЦВИТТЕР-ИОНЫ (биполярные ионы), нейтральные молекулы, содержащие одновременно положит. и отрицат. ионные центры. Цвиттер-ионную структуру с пространственно разделенными зарядами имеют аминокислоты, существующие в виде внутр. солей - бетаинов, а также мезоионные соединения.
![]()
Известны для след. элементов Z: N, P, As, Sb, Bi, О, S, Se, Те, Cl, Вr, I. Для О зафиксированы только карбонил-илиды.
![]()
Реакция Виттига — химическая реакция альдегидов или кетонов с илидами фосфора (которые иногда называют «реагентами Виттига»), которая приводит к образованию алкенов или алленов и оксида трифенилфосфина.
![]()
Реакция Хорнера
Модификация реакции Виттига, в которой вместо илидов фосфора используются фосфонаты.
Присоединение стабилизированных триорганилсилильнойгруппой α-карбоанионов к карбонильным соединениям с последующим стереоселективным элиминированием под воздействием кислоты или основания с образованием алкена называют олефинированием по Петерсону.
Реакция Хека
Реакция Хека (также известна как Реакция Мизороки-Хека) — химическая реакция сочетания ненасыщенных галогенидов (или трифлатов) с алкенами в присутствии сильных оснований и катализаторов на основе Pd(0). Реакция названа в честь американского химика Ричарда Хека.
![]()
Классическими компонентами реакции Хека являются арил-, бензил- или винилгалогениды, а также алкены, содержащие по крайней мере один атом водорода, и являющиеся как правило электронно-дефицитными соединениями (такими как например производные акриловой кислоты).
В качестве катализатора может применяться тетракис(трифенилфосфин)палладий(0), хлорид палладия или палладий(II) ацетат. Лигандами палладия в этой реакция являются как правило Трифенилфосфин или BINAP. Как основания используют триэтиламин, карбонат калия или ацетат натрия.
Реакция Судзуки
Реакция Судзуки — органическая реакция арил- и винилборных кислот с арил- или винилгалогенидами, катализируемая комплексами Pd(0). Реакция Судзуки широко используется в препаративной органической химии для получения полиолефинов, стиролов, а также замещенных бифенилов.
![]()
В реакцию также могут вступать органические производные псевдогалогенов, таких как трифлаты (трифторацетаты OTf). Вместо борных кислот можно использовать их эфиры, относительная активность субстратов уменьшается в ряду: R2-I > R2-OTf > R2-Br >> R2-Cl
Реакция Соногашира
Реакция Соногашира — именная реакция в органической химии, присоединение галогеналканов к терминальным алкинам. Данная реакция была впервые проведена Кенкичи Соногашира и Нобуе Хогихара в 1975 году.
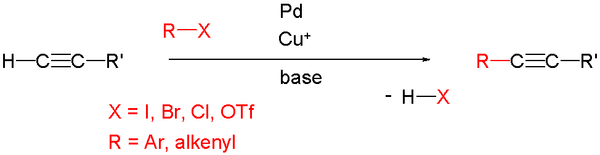
Для проведения реакции необходимы два катализатора: комплекс палладия (0) и галогенид меди (I). Палладиевый комплекс активирует галогеналкан путём окислительного присоединения к связи галоген-углерод. Часто для реакции используются фосфиновые комплексы палладия, такие как тетракис(трифенилфосфин)палладий(0). Для катализа могут быть также использованы комплексы палладия (II), который в присутствии субстрата-восстановителя переходит в активную для катализа форму комплекса палладия (0).
В процессе реакции галогенид меди (I) реагирует с терминальным алкином с образованием алкинида меди (I).
Реакцию Соногашира следует проводить в атмосфере инертного газа, так как комплексы палладия (0) легко окисляются в присутствии кислорода воздуха.
Илиды P, S и I способны гидролизоваться по двум направлениям, напр.:
![]()
Илиды N и S при нагр. претерпевают [1, 2]-сигматропную перегруппировку, напр.:
![]()
Для илидов S, кроме того, характерны [2, 3]-сигматропные термич. перегруппировки, напр.:
![]()
Umpolung или инверсии полярности в органической химии является химическая модификация функциональной группы с целью изменение полярности этой группы. Данная модификация позволяет вторичные реакции этой функциональной группы, которые иначе не возможно.
Подавляющее большинство важных органических молекул, содержащих гетероатомы, которое поляризовать углеродных скелетов в силу их электроотрицательность. Таким образом, в стандартных органических реакций, большинство новых облигаций образуется между атомами противоположной полярности. Это может рассматриваться как «нормальном» режиме реактивности.
Одним из последствий этого природного поляризации молекул является то, что 1,3 - и 1,5 - гетероатом заменить скелеты углерода чрезвычайно легко синтезировать ( альдольной реакции , Кляйзена конденсация , реакция Михаэля , перестройка Кляйзена , Дильса-Альдера ), тогда как 1, 2 -, 1,4 - и 1,6 - модели гетероатомом замена труднее доступ через "нормального" реактивности. Поэтому важно понять и разработать методы, чтобы вызвать umpolung в органических реакциях.
