- •Опорні лекції Статична біохімія
- •Лекція №1. Біохімія як наука. Хімічний склад організму. Хімічний склад харчових продуктів
- •З авдання біохімії:
- •Хімічний склад живих організмів
- •Знаходження води
- •Вміст води в харчових продуктах
- •Вода в продуктах
- •3 Основні групи компонентів, що формують хімічний склад харчового продукту:
- •Всі речовини, які входять до складу харчового продукту поділяють на:
- •Вміст білка в тканинах тварин і в рослинах
- •Функції білків в організмі
- •В торинна структура
- •К ласифікація білків:
- •Ф ізико-хімічні властивості білків:
- •У харчових продуктах білки знаходяться в колоїдному стані:
- •Утворення пластівців
- •Глобулярні
- •Денатурація
- •Коагуляція
- •Утворення гелів
- •Ущільнення гелю, виділення рідини
- •Фібрилярні
- •Зварювання
- •Дезагрегація
- •Методи виділення і очищення білків
- •Методи визначення білків
- •Якісне і кількісне визначення білків
- •Визначення вмісту загального та білкового азоту за методом Кьєльдаля
- •Визначення загального білка за біуретовою реакцією
- •Функціональні властивості білків
- •Лекція № 3. Ліпіди. Жири
- •Вміст жирів у харчових продуктах
- •Хімічні властивості жирів
- •Гідроліз в харчових виробництвах:
- •Фактори, які випливають на процес окислення ліпідів:
- •Методи виділення ліпідів із сировини та харчових продуктів і їх аналіз
- •Метод Сокслета для визначення вмісту сирого жиру
- •Лекція №4. Вуглеводи
- •Найважливіші представники моносахаридів і дисахаридів
- •Властивості моносахаридів Фізичні властивості моносахаридів і дисахаридів:
- •Властивості дисахаридів
- •Найважливіші представники полісахаридів
- •Гомополісахариди
- •Роль харчових волокон (25г на добу):
- •Гетерополісахариди
- •Методи визначення вуглеводів у харчових продуктах
- •Зв’язування ароматичних речовин
- •Утворення продуктів неферментативного потемніння та харчового аромату
- •Структурно-функціональні властивості полісахаридів
- •Речовини полісахаридної природи, які змінюють структуру і фізико-хімічні властивості харчових продуктів
- •Модифіковані целюлози та їх технологічні функції:
Ренатурація,
або пептизація
(оборотна
денатурація) – при недовготривалій
дії денатуруючого агента білок можна
повернути в попередній, нативний, стан
(відновлення каталітичної дії ферменту
лізоциму, втраченої в результаті
теплової денатурації і розриву чотирьох
дисульфідних зв’язків, які стабілізують
конформацію молекули ферменту).
золю
гелю
мало
концентрованого
концентрованого
обводненого
безводного
Результат
денатурації
- коагуляція або зсідання білків.
Типи коагуляції
глобулярних білків
І тип
Білок в стані
мало концентрованого золю
Утворення піни,
пластівців
ІІ тип
Білок в стані
концентрованого золю
Утворення гелю
ІІІ тип
Білок у вигляді
гелю
Ущільнення
молекул в гелі, випресовування води
(коагель)
На температуру
денатурації впливають: Сіль
– зниження температури; Цукор
– підвищення температури.
Деструкція
‑ нагрів
денатурованого білка вище 1000С,
проходить руйнування макромолекули
(відбувається за допомогою протеолітичних
ферментів, що сприяє розм’якшенню
м’яса, послабленню клейковини тіста,
отриманню білкових гідролізатів). І
етап –
відщеплення аміаку, сірководню, фосфіну,
вуглекислого газу. Ці речовини беруть
участь у формуванні смаку і аромату
готової їжі. ІІ
етап –
деполімеризація білкової молекули з
утворенням водорозчинних азотистих
речовин.У харчових продуктах білки знаходяться в колоїдному стані:
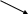





Зміна колагену при тепловій обробці
І етап |
температура 60-650С |
скорочування волокон у довжину |
з |
ІІ етап (тривале нагрівання з водою) |
температура 65-1000С |
д |
утворення глютину (розчинна речовина), тканина розм’якшується |
Фактори, що впливають на швидкість переходу колагену в глютин:
температура (підвищення температури);
тривалість теплової обробки;
кисле середовище ( денатурація, прискорює розм’якшення);
структура сполучної тканини.
Основні зміни, що відбуваються з білками при їх нагріванні в процесі кулінарної обробки
Утворення пластівців
Глобулярні
Денатурація
Коагуляція





Утворення гелів

БілкиУщільнення гелю, виділення рідини
Фібрилярні
Зварювання
Дезагрегація

Білки молока
Казеїн – фосфопротеїд, що входить до складу молока і молочних продуктів в колоїдному стані. Не розчиняється у воді. Необхідний для утворення АТФ, формування кісткової тканини, містить усі незамінні амінокислоти. Денатурація казеїну - поява плівки на поверхні молока, t=40-450С.
П або при дії сичужних ферментів |
Молочна кислота виділяє Са, казеїн випадає в осад |
+ |
Виділяється рідина, утворюється коагель (використовується при виробництві сирів) |
Альбумін – початок денатурації при t=600С, при t=75-1000С - утворення осаду у вигляді пластівців, піни.
Глобулін – денатурація при t=700С, разом з лактозою утворює меланоїдини (темнозабарвлені речовини).
Ліпопротеїн – жироподібна речовина, утворює оболонку навколо жирових кульок, що запобігають їх злипанню.
Білки яєць
(концентровані колоїдні розчини (золі), в результаті денатурації утворюють гель, здатний утримувати воду)
Овоальбумін (яєчний білок)– фосфопротеїд, забезпечує розчинення яєчного білка у воді.
Коноальбумін (яєчний білок) – містить незамінні амінокислоти в оптимальних співвідношеннях.
Овоглобулін (яєчний білок) – при збиванні утворює піну.
Овомукоїд (яєчний білок) – обумовлює піноутворюючу здатність білка, пригнічує дію трипсину (тому сирі яйця погано засвоюються, утруднюють засвоєння інших продуктів, сприяють алергічним проявам).
Вітелін (яєчний жовток) – емульгатор.
Денатурація білків:
білкової частини – t= 50-550С (поступове помутніння), t = 650С (загусання), t = 750С (непрозора біла драглеподібна маса);
жовткової частини - 70-750С.
Білки зернобобових (знаходяться у вигляді сухих гелів, алейронових зерен)
Зміни при тепловій обробці:
набухання (збільшення маси бобових, круп, утворення клейковини борошна), яка не переходить в середовище, так як зразу поглинається крохмалем (клейстеризація);
білки протоплазми згортаються, проникливість збільшується: білки, що знаходяться в стані мало концентрованого золю, коагулюють з утворенням піни, пластівців (з прогрітих овочів у воду переходить більше поживних речовин).
Способи одержання та очищення білків і пептидів:
З природних джерел: неповним гідролізом білків одержують з тканин тварин карнозин, глутатіон, ансерин. Потім їх видаляють та ідентифікують звичайними методами якісного і кількісного аналізу органічних речовин. Окремі пептиди з таких тканин одержують методом екстракції.
Методами органічного синтезу (реакції синтезу пептидів і захисту під час синтезу їх аміногруп і карбоксильних груп від вступу в реакції з іншими реагентами. Синтез можна продовжити повторенням попередніх стадій). Так було синтезовано інсулін, багато пептидів, їх видаляють із сумішей звичайними методами виділення та ідентифікації органічних речовин, нерідко використовуючи хроматографію, електрофорез.
|
|
|
|
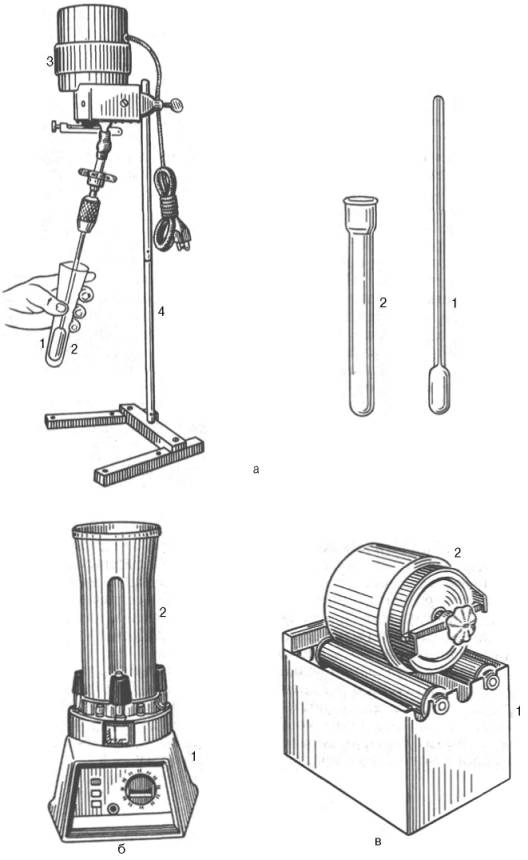
||
а ‑ ручной гомогенізатор; б – механічний гомогенізатор; в – шаровий млин. |
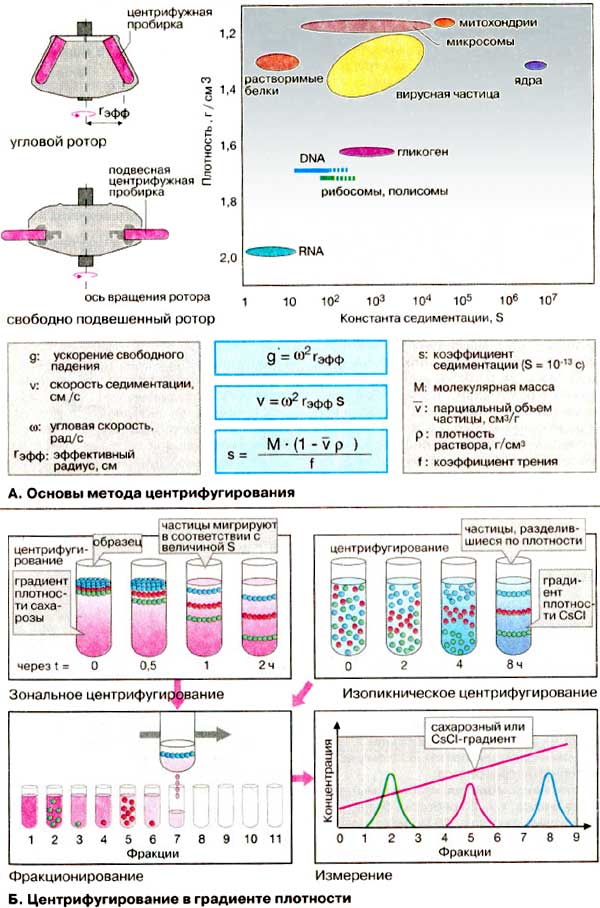
Центрифугування |
Схема електрофорезу |
|
||
|
|
|
|||
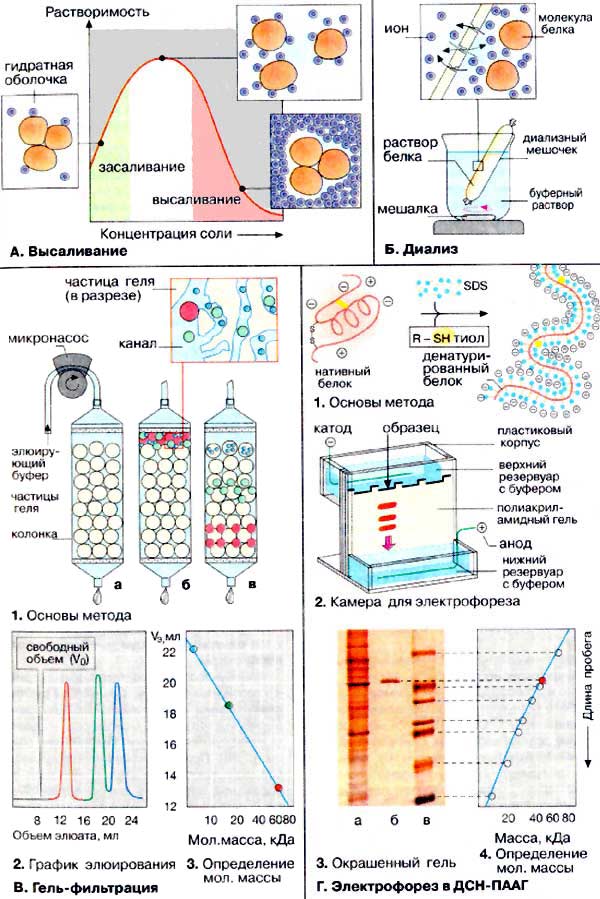
Висолювання (осадження) |
Гель-фільтрація |
Діаліз |
|||

 варювання
варювання еструкція
еструкція ри
збільшенні кислотності,
ри
збільшенні кислотності,
 температура
температура