- •Опорні лекції Статична біохімія
- •Лекція №1. Біохімія як наука. Хімічний склад організму. Хімічний склад харчових продуктів
- •З авдання біохімії:
- •Хімічний склад живих організмів
- •Знаходження води
- •Вміст води в харчових продуктах
- •Вода в продуктах
- •3 Основні групи компонентів, що формують хімічний склад харчового продукту:
- •Всі речовини, які входять до складу харчового продукту поділяють на:
- •Вміст білка в тканинах тварин і в рослинах
- •Функції білків в організмі
- •В торинна структура
- •К ласифікація білків:
- •Ф ізико-хімічні властивості білків:
- •У харчових продуктах білки знаходяться в колоїдному стані:
- •Утворення пластівців
- •Глобулярні
- •Денатурація
- •Коагуляція
- •Утворення гелів
- •Ущільнення гелю, виділення рідини
- •Фібрилярні
- •Зварювання
- •Дезагрегація
- •Методи виділення і очищення білків
- •Методи визначення білків
- •Якісне і кількісне визначення білків
- •Визначення вмісту загального та білкового азоту за методом Кьєльдаля
- •Визначення загального білка за біуретовою реакцією
- •Функціональні властивості білків
- •Лекція № 3. Ліпіди. Жири
- •Вміст жирів у харчових продуктах
- •Хімічні властивості жирів
- •Гідроліз в харчових виробництвах:
- •Фактори, які випливають на процес окислення ліпідів:
- •Методи виділення ліпідів із сировини та харчових продуктів і їх аналіз
- •Метод Сокслета для визначення вмісту сирого жиру
- •Лекція №4. Вуглеводи
- •Найважливіші представники моносахаридів і дисахаридів
- •Властивості моносахаридів Фізичні властивості моносахаридів і дисахаридів:
- •Властивості дисахаридів
- •Найважливіші представники полісахаридів
- •Гомополісахариди
- •Роль харчових волокон (25г на добу):
- •Гетерополісахариди
- •Методи визначення вуглеводів у харчових продуктах
- •Зв’язування ароматичних речовин
- •Утворення продуктів неферментативного потемніння та харчового аромату
- •Структурно-функціональні властивості полісахаридів
- •Речовини полісахаридної природи, які змінюють структуру і фізико-хімічні властивості харчових продуктів
- •Модифіковані целюлози та їх технологічні функції:
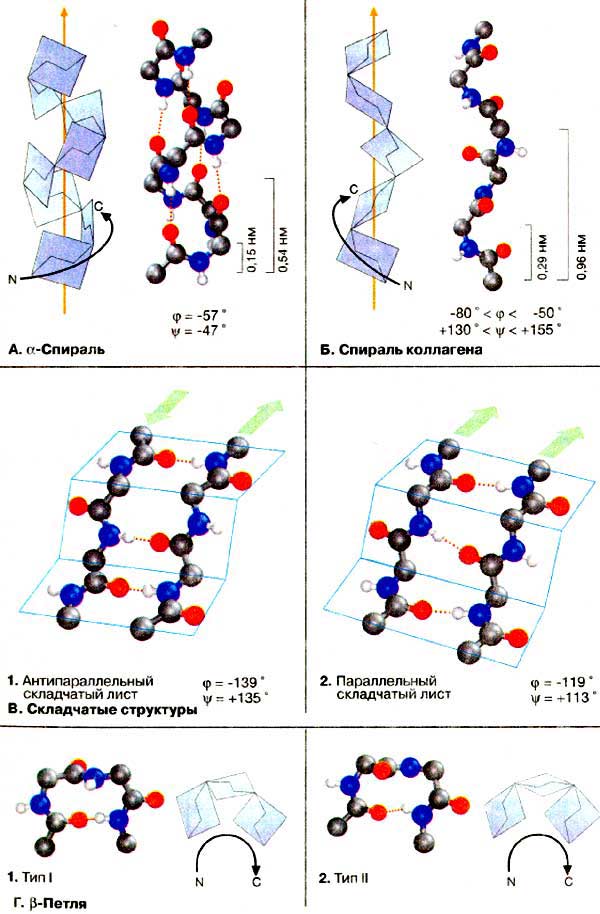
В торинна структура
|
|
|
|
α-спіраль |
β-структура |
|
|
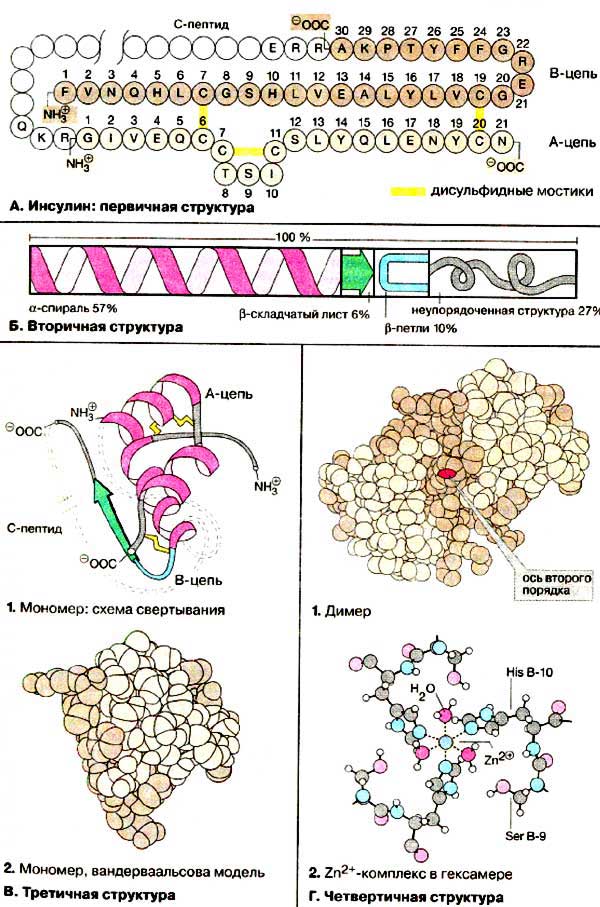
Третинна структура молекули білка утворюється внаслідок взаємодії між боковими відгалуженнями поліпептидних ланцюгів. Це призводить до формування водневих, дисульфід них, іонних (сольових), вандерваальсових та інших зв’язків. Поліпептидні ланцюги згортаються в певному порядку, що призводить до утворення просторової конфігурації білкової молекули. При цьому гідрофобні радикали «втягуються» всередину молекули, а гідрофільні орієнтуються в бік розчинника, створюючи енергетично вигідну конфігурацію білкової молекули. Четвертинна структура білкової молекули є асоціацією декількох субодиниць поліпептидної природи, мають первинну, вторинну і третинну структури, або глобул, що сполучені у єдину складну молекулу. Окремі субодиниці називаються протомери, а їх комплекс – мультимер. Кількість протомерів – різна: від 4 у гемоглобіні до кількох тисяч у білка тютюнової мозаїки. Підтримується слабкими взаємодіями. Реалізується в глобулярних білках. |
|
|
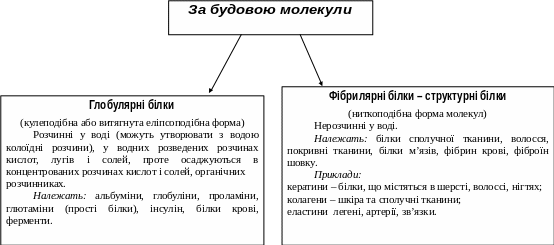
К ласифікація білків:
За будовою молекули: глобулярні і фібрилярні;
За складом молекул: прості (протеїни) і складні (протеїди);
За розчинністю: у воді, солях, у кислотах;
За фізичним станом: тверді, рідкі, напіврідкі;
З
 а
харчовою цінністю:
повноцінні, неповноцінні.
а
харчовою цінністю:
повноцінні, неповноцінні.

Структура молекули білка дуже лабільна й легко змінюється під впливом різних факторів, що приводить до зміни їх нативних властивостей – фізичних, фізико-хімічних і біологічних властивостей.
Фактори, що впливають на зміну структури і стану білків:
температура;
механічний вплив (струшування, збивання);
дія лугів, кислот;
дегідратація при сушінні або заморожуванні.
Ф ізико-хімічні властивості білків:
Рідкі, напіврідкі, тверді аморфні та кристалічні речовини. Деякі білки мають консистенцію в’язких рідин або драглів (альбуміни, глобуліни сироватки крові).
При високій температурі всі білки згоряють, відчувається запах паленого волосся.
Не мають температури плавлення та кипіння, так як згортаються при нагріванні.
Оптично активні речовини. Розчини природних білків обертають площину поляризації світла ліворуч так як складаються переважно з α-амінокислот.
Розчинність білків ‑ різна: нерозчинні (колаген, еластин), альбуміни розчиняються у воді з утворенням колоїдних розчинів, проламіни – у сумішах спиртів.
Білки утворюють колоїдні розчини, які здатні переходити в гелі (драглеподібний стан). Наприклад, перехід із золю в гель спостерігається під час охолодження драглів. Білки опірних тканин лише набухають і можуть зв’язувати воду в набагато більших кількостях, ніж їх маса.
Практично всі білки погано кристалізуються.
Б
 ілки
є амфотерними сполуками, їх властивості
визначаються наявністю в складі їх
макромолекул різних функціональних
груп, здатних до іонізації в водних
розчинах (карбоксильна і гідроксильна
групи). Ступінь іонізації функціональних
груп залежить від значення рН середовища.
В кислому середовищі пригнічується
дисоціація карбоксильних груп, і
молекула набуває сумарного позитивного
заряду – білок виявляє властивості
катіону (переважають позитивно заряджені
іони) – реагує як основа, а у лужному
середовищі пригнічується іонізація
аміногруп, і білок набуває сумарного
негативного заряду, виявляє властивості
аніону – реагує як кислота.
ілки
є амфотерними сполуками, їх властивості
визначаються наявністю в складі їх
макромолекул різних функціональних
груп, здатних до іонізації в водних
розчинах (карбоксильна і гідроксильна
групи). Ступінь іонізації функціональних
груп залежить від значення рН середовища.
В кислому середовищі пригнічується
дисоціація карбоксильних груп, і
молекула набуває сумарного позитивного
заряду – білок виявляє властивості
катіону (переважають позитивно заряджені
іони) – реагує як основа, а у лужному
середовищі пригнічується іонізація
аміногруп, і білок набуває сумарного
негативного заряду, виявляє властивості
аніону – реагує як кислота.
Білки можуть мати:
кислотний характер (складаються переважно із залишків двох основних кислот);
лужний характер ( в їх складі більшість аміногруп);
нейтральний характер (однакова кількість карбоксильних і аміногруп в їх молекулі).
Залежно від знака заряду молекула білка в електричному полі переміщується відповідно до катода або анода. При певному значенні рН середовища кількість позитивно і негативно заряджених груп у складі молекули білка урівноважується, тобто молекула стає електронейтральною.
Значення рН середовища, при якому молекула білка містить однакову кількість позитивно і негативно заряджених груп, називається ізоелектричною точкою білка.
Ізоелектрична точка білка характеризується:
найменшою розчинністю білка і випадінню його в осад при додаванні водовідбірних агентів (внаслідок втрати заряду молекули);
втратою здатності рухатися в електричному полі до позитивно або негативно зарядженого полюсів.