
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
Теория ориентации
Ориентирующее влияние заместителей объясняется общим положением: из нескольких возможных -комплексов в первую очередь и преимущественно образуется наиболее устойчивый.

Стабильность -комплекса зависит от равномерности распределения электронного облака по частице, которое определяем по числу граничных структур.

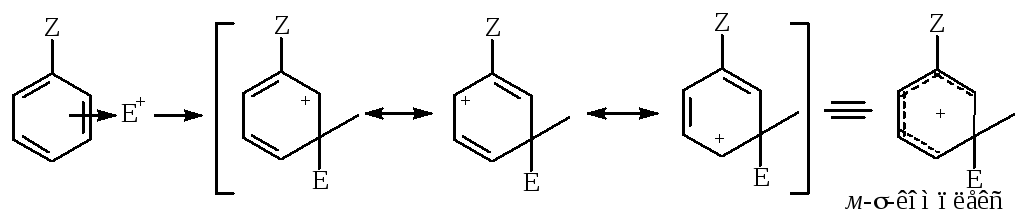

Заместители первого рода распределяют положительный заряд в орто- и пара- -комплексах, поэтому они стабильнее мета--комплекса.
Например, орто- и пара- -комплексы фенолов, аминов и их производных, а также галогенбензола, изображаются уже 4 и более граничными структурами, причем оксониевые и аммониевые катионы значительно устойчивее, чем остальные.


Заместители второго рода препятствуют распределению положительного заряда, поэтому орто- и пара- -комплексы менее стабильны, чем мета--комплекса, т.к. в этом случае в орто- -комплексе 3 и пара--комплексе 2 заряды находятся на соседних атомах, что энергетически невыгодно и такие структуры маловероятны. Следовательно, эти -комплексы могут быть изображены только двумя структурами.


Электрофильное замещение в нафталине
Электрофил, атакуя -электронное облако нафталина, так же образует - и -комплексы. -Комплекс сохраняет ароматичность одного из циклов и стабильнее, чем карбокатионы бензола, поэтому нафталин активнее бензола в реакциях SE.
В отличие от бензола в нафталине реакция электрофильного замещения может иметь два направления.
Из двух возможных -комплексов (I и II) преимущественно образуется более устойчивый.

Распределение заряда в -комплексе I можно отразить двумя граничными структурами (а, б). В катионе II такой возможности распределения заряда нет. При этом мы рассматриваем лишь структуры, в которых сохраняется ароматичность одного из колец нафталина. Граничные структуры, в которых нарушена ароматичность обоих колец нафталина, неизмеримо менее устойчивы, чем указанные выше и мы их не учитываем.
В реакциях электрофильного замещения в ряду нафталина наиболее легко и преимущественно замещается -водородный атом.
Глава 1. Методы получения органических сульфокислот
1. Общие сведения о процессе сульфирования
Существуют разные методы введения группы –SO3H в молекулу органического соединения. Процесс прямого замещения атома водорода сульфогруппой, который наиболее широко применяется в промышленности, называют сульфированием. В зависимости от того, у какого элемента замещается атом водорода на сульфогруппу, различают С-, N- и О-сульфирование. О-Сульфирование называют также сульфатированием.
Субстратом (исходным веществом) при сульфировании служат, главным образом, ароматические и гетероароматические соединения и их производные. Реже используются вещества алифатического и алициклического ряда. Среди них наибольшее значение в синтезе сульфо-БАВ имеют полисахариды и стероиды. В ряде случаев сульфируются сами лекарственные вещества.
Основными сульфирующими агентами являются:
Безводная серная кислота — при комнатной температуре представляет собой тяжелую маслянистую жидкость, т.к. ее молекулы за счет водородных связей образуют полимер, который при повышении температуры разрушается:

Кипит она при температуре около 300 °С, перегоняется с разложением. Жидкая 100 %-ая серная кислота является ионизирующим растворителем, однако, ее собственная ионизация незначительная:
![]()
Серная кислота смешивается с Н2О и SO3 в любых соотношениях. В водных растворах она полностью диссоциирует на ионы:
![]()
Для промышленного сульфирования чаще всего используют купоросное масло (92—98 %-ную H2SO4) и 98—100 %-ную серную кислоту. Концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании.
Олеум — образуется при растворении серного ангидрида в концентрированной серной кислоте и представляет собой раствор SO3 в смеси кислот: серной (H2SO4), двусерной (H2S2O7), трисерной (H2S3O10) и других полисерных кислот:

При концентрации сульфотриоксида 20—25 % и 60—65 % олеум представляет собой густую маслянистую, дымящуюся на воздухе жидкость. Олеум с другими концентрациями SO3 при комнатной температуре является твердым веществом, и его готовят из стандартного раствора непосредственно в реакторе.
Серный ангидрид — это общее название нескольких модификаций триоксида серы. Молекула SO3 существует в виде мономера, тримера и полимера (существуют и другие формы, например, димер):

В газовой фазе и в разбавленных неводных растворах оксид серы (VI) находится в мономерной форме. При конденсации паров SO3 образуется летучая бесцветная жидкость (tкип = 44,8 °С), состоящая преимущественно из циклических тримерных молекул (SO3)3. При охлаждении до 16,8 °С она затвердевает с образованием прозрачных кристаллов. Эта форма SO3 неустойчива и при хранении превращается в устойчивые, похожие на асбест, нити. Полимеризацию SO3 предотвращают введением Р2О5 и других ингибиторов.
Для сульфирования серный ангидрид получают: а) обжигом пирита и последующим каталитическим окислением SO2 в SO3 непосредственно на предприятии, где он используется; б) на специализированных заводах с последующей доставкой на предприятие в баллонах под давлением в жидком стабилизированном виде; в) десорбцией из высокопроцентного олеума при нагревании. Остающаяся после десорбции серного ангидрида 100 %-ная серная кислота может быть использована в других производствах. Первый метод применяют на производствах большой мощности, например, заводах по синтезу поверхностно-активных веществ сульфированием (сульфатированием) первичных спиртов, олефинов, алкилбензолов и т. п. Остальные — на предприятиях с малой мощностью, например, на химико-фармацевтических заводах.
Область применения концентрированной серной кислоты ограничивается незамещенными и активированными аренами. Малоактивные субстраты сульфируются олеумом различной концентрации или сульфотриоксидом.
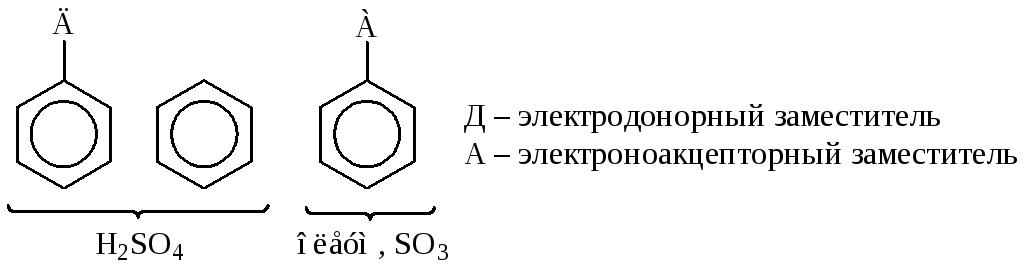
Сульфогруппа вводится в субстрат как с целью придания ему новых свойств (снижения токсичности лекарственного препарата, придания ему несколько иной биологической активности, повышения его растворимости в воде, что создает предпосылки для получения инъекционных лекарственных форм), так и с целью дальнейшей замены сульфогруппы на гидроксил, аминогруппу и т. п.
Целевым продуктом сульфирования аренов являются сульфоновые кислоты, которые называют, добавляя к названию основы окончание «сульфокислота» («сульфоновая кислота»), например, бензолсульфокислота, 2-нафталинсульфокислота.

При N- и O- сульфировании образуются амиды и эфиры серной кислоты.
Сульфокислоты, как правило, являются твердыми гигроскопичными кристаллическими веществами, хорошо растворимыми в воде. Это сильные кислоты, по константе диссоциации близкие к минеральным. В разбавленных водных растворах они диссоциируют практически нацело.
Число синтетических сульфокислот очень велико, и они широко используются в практике.
Из природных сульфокислот следует, прежде всего, отметить аминосульфокислоты: таурин и цистеиновую кислоту, которые играют большую роль в процессе всасывания жиров в организме млекопитающих, а также сульфатированные фито- и зоополисахариды


Гепарин — (сульфатированный зоогетерополисахарид, состоящий из глюкуроновой кислоты и глюкозамина) выпускается в качестве лекарственного препарата для регулирования свертываемости крови и лечения ряда других заболеваний.
