
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
1. Химизм процесса и краткая характеристика продуктов реакции
Реакции нитрозирования можно представить следующей химической схемой:

Большинство процессов нитрозирования формально можно отнести к реакциям электрофильного замещения, т.к. нитрит натрия в кислой среде образует электрофильные частицы.
При взаимодействии солей нитрита натрия с минеральными кислотами образуется азотистая кислота, которая частично протонируется с образованием активной электрофильной частицы нитрозацидий-катиона (H2NO2+). Однако, в водном растворе этот катион гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с амином, образуя катион нитрозония NO+, нитрозилгалогенид NOHlg, азотистый ангидрид N2O3, которые и нитрозируют субстрат:

Соотношение активных частиц в реакционной массе зависит от кислотности среды и природы минеральной кислоты. При проведении реакции в соляной кислоте основной нитрозирующей частицей является нитрозилхлорид NOCl, а в среде серной кислоты — азотистый ангидрид N2O3. Катион нитрозония NO+ в заметных количествах образуется лишь в концентрированной серной кислоте. Активность перечисленных частиц уменьшается в ряду: катион нитрозония > нитрозилхлорид > азотистый ангидрид.
Реакция диазотирования протекает по уравнению:
![]()
Механизм реакции можно представить следующей схемой:



![]()
Лимитирующей стадией процесса является нитрозирование, поэтому скорость реакции зависит от рКа амина и кислотности среды. Поскольку в кислой среде амин находится в состоянии динамического равновесия с солью, реакция идет тем быстрее, чем в большей степени равновесие смещено в сторону свободного основания.
![]()
Соли арендиазония в водных растворах минеральных кислот при низкой температуре (0—10 °С) относительно устойчивы и полностью диссоциированы. Это связывают с равномерностью распределения электронного облака катиона, структуру которого можно представить в виде следующих граничных структур:
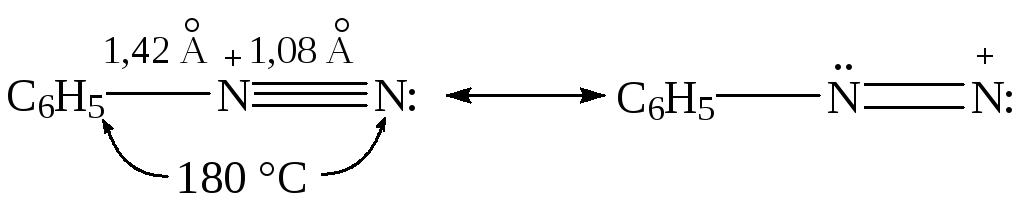

В связи с этим электронодонорные заместители в орто- и пара-положениях к диазогруппе участвуют в распределении положительного заряда и увеличивают устойчивость диазокатиона, а электроноакцепторные — уменьшают.

В сухом кристаллическом состоянии при нагревании или ударе соли диазония разлагаются иногда со взрывом.
Соли алкандиазония, полученные из первичных алифатических аминов, неустойчивы. Электронное облако катиона неравномерно распределено по частице, поэтому катион отщепляет азот, превращается в карбониевый ион и далее в спирт, алкен и другие стабильные продукты:
![]()
В случае метиламина, а также соединений, имеющих в α-положении заместители с сильным I-эффектом, образуются устойчивые алифатические биполярные ионы диазония за счет отщепления протона от радикала. Например, диазометан и диазоуксусный эфир (этиловый эфир диазоуксусной кислоты) в большей мере отвечают структуре:
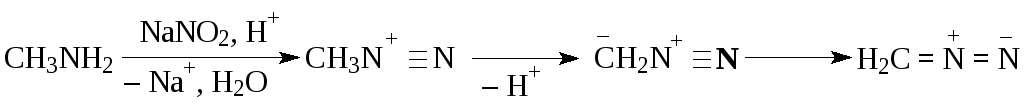

N-Нитрозирование наблюдается при взаимодействии вторичных аминов с азотистой кислотой, в результате чего образуются N-нитрозосоединения, которые не могут изомеризоваться в диазогидрат:

N-Нитрозамины — токсичные, неустойчивые соединения. Они разлагаются уже при комнатной температуре и могут изомеризоваться в С-нитрозосоединения (перегруппировка Фишера-Хеппа):

С-Нитрозирование возможно как для активированных аренов, так и алифатических соединений.
Ароматические соединения, содержащие сильные электронодонорные заместители (третичные жирноароматические амины и фенолы), взаимодействуют с нитрозирующими частицами по механизму электрофильного замещения (SE) у атома углерода.
В случае производных бензола нитрозогруппа почти всегда замещает атом водорода в пара-положении к ОН- или NR2-группе. Продукт реакции, как правило, выделяется в виде интенсивно окрашенного осадка:

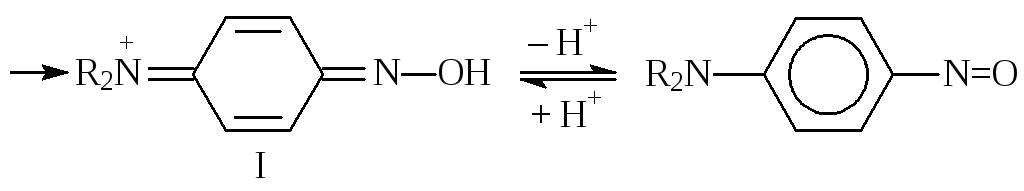

В ряду нафталина чаще образуется смесь изомеров. Например, при нитрозировании α-нафтола получаются почти равные количества 1-гидрокси-2-нитрозонафталина и 1-гидрокси-4-нитрозонафталина.

С-нитрозирование алифатических соединений протекает по радикальному механизму SR. Из насыщенных углеводородов таким образом получают нитрозоалканы, которые неустойчивы и легко перегруппировываются в изомерные оксимы. Например, в синтезе лизина и -аминокапроновой кислоты используют следующую реакцию:

О-Нитрозирование осуществляют взаимодействием спирта с азотистой кислотой.
![]()
Алкилнитриты получают также действием нитритов на алкилгалогениды:
![]()
