
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
4. Особенности сульфирования аренов олеумом и серным ангидридом
Сульфирование олеумом и серным ангидридом отличается универсальностью (можно сульфировать разные субстраты, устойчивые в условиях реакции) и большой сульфирующей активностью, которая сохраняется до конца процесса.
Все это объясняется высокой концентрацией электрофильных частиц (SO3 и HSO3+), которая несравнимо выше, чем в H2SO4, и отсутствием реакционной воды.
![]()
Недостатком этих сульфирующих агентов является возможность протекания побочных реакций: окисление, образование дисульфокислот, сульфонов и др. (значительно бόльшая по сравнению с H2SO4), поэтому их чаще всего используются в случае малоактивных аренов. Побочные реакции ограничивают, главным образом, температурой, которая при сульфировании бензола и его гомологов олеумом и SO3 обычно изменяется от –10 до 40—60 °С, а также оптимальным соотношением реагентов и способом их смешения.
Серный ангидрид более энергичный сульфирующий агент, чем олеум, однако, сульфирование серным ангидридом, особенно в отсутствие жидкого разбавителя, технологически сложно. По мере образования сульфокислоты реакционная масса густеет, затрудняется отвод тепла, создаются местные перегревы, резко ухудшается контакт серного ангидрида с субстратом. Поэтому в чистом виде серный ангидрид применяется крайне редко. Чаще процесс комбинируют с сульфированием олеумом. Сначала сульфируют парами серного ангидрида до загустевания реакционной массы, а затем добавляют олеум. Это позволяет снизить расход сульфирующих агентов (в пересчете на SO3) почти вдвое по сравнению с сульфированием олеумом в одну стадию.
В отличие от серного ангидрида сульфирование олеумом, также как в случае H2SO4, начинается обычно как гетерогенный процесс, однако затем реакционная масса гомогенизируется, и основное время процесс протекает как гомогенный.
Олеум иногда применяют и для сульфирования активных субстратов, например, N,N-диметиланилина в производстве прозерина:
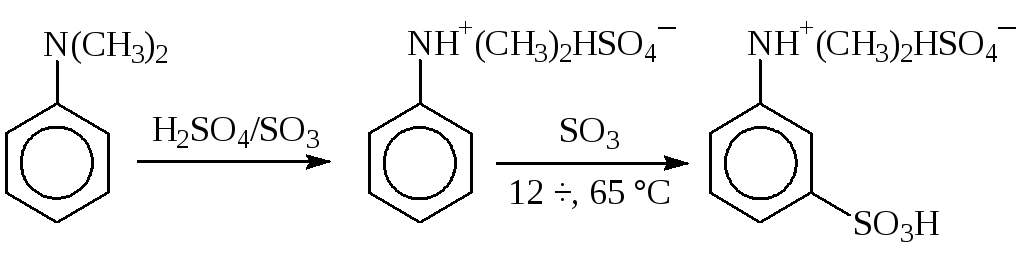
Диметиламиногруппа протонируется и превращается в сильный электроноакцепторный мета-ориентирующий заместитель, однако он не может помешать активному сульфотриоксиду атаковать ядро.
Для введения сульфогруппы этим методом в орто- или пара-положение к аминогруппе необходимо предварительно защитить ее (например, ацилировать) или использовать метод запекания.

5. Основные способы выделения сульфокислот
Сульфокислоты обычно хорошо растворяются в сульфомассе, поэтому их чаще всего выделяют в виде солей после нейтрализации реакционной массы.
В качестве нейтрализующих агентов обычно применяют соду, сульфит натрия, мел, известь и щелочь.
Химизм процесса нейтрализации сульфомассы:
2ArSO3H + Na2CO3 (Na2SO3) 2ArSO3Na + CO2 (SO2) + H2O
H2SO4 + Na2CO3 (Na2SO3) Na2SO4 + CO2 (SO2) + H2O
2ArSO3H + Ca(OH)2 (CaCO3) (ArSO3)2Ca + CO2 + (2)H2O
H2SO4 + Ca(OH)2 (CaCO3) CaSO4 + (CO2) + (2)H2O
Образующиеся в результате нейтрализации реакционной массы соли могут находиться в одной фазе (в растворе или в осадке). Это сильно затрудняет их разделение и очистку сульфокислот, поэтому при выборе нейтрализующего агента следует учитывать стоимость этих процессов и сложность утилизации отходов производства.
Особенно трудно разделить натриевые соли серной кислоты и сульфокислот. С этой целью используются многочисленные переосаждения солей, длительные упаривания и фильтрации растворов, что связано с энергетическими и временными затратами, с коррозией оборудования.
Общим недостатком нейтрализации кислот солями сернистой и угольной кислот является выделение газов. При нарушении технологии и образовании большого количества газов возможен выброс реакционной массы.
Нейтрализация сульфитом выгодна только в производствах, где комбинируются процессы сульфирования и щелочного плавления продуктов сульфирования. В этом случае сульфит является отходом щелочного плавления аренсульфонатов, а образующийся при нейтрализации сульфомассы диоксид серы может быть использован для нейтрализации щелочного плава:
ArSO3Na + 2NaOH = ArONa + Na2SO3 + H2O
2ArSO3H + Na2SO3 = 2ArSO3Na + SO2↑ + H2O
2NaOH + SO2 = Na2SO3 + H2O
Для нейтрализации сульфомассы ее рассчитанное количество постепенно, при работающей мешалке, загружают в предварительно нагретый раствор сульфита. (Необходимо строго соблюдать режим загрузки, чтобы исключить выброс реакционной массы!) После этого содержимое нейтрализатора кипятят до полного удаления сернистого газа. При организации процесса особое внимание уделяется герметичности оборудования, организации улавливания диоксида серы (сернистого газа), а также защите окружающей среды от вредного воздействия SO2.
Технология нейтрализации карбонатом натрия безопаснее, требует более простого аппаратурного оформления, но дороже по сырьевым затратам.
Мел и известь являются относительно дешевым сырьем. Кроме того, кальциевые соли сульфокислот в противоположность сульфату кальция, как правило, растворимы в воде, что позволяет на стадии нейтрализации избавиться от неорганических солей.
При нейтрализации сульфомассы известью не образуется углекислый газ, что существенно облегчает ведение процесса на данной стадии, но мел является более дешевым сырьем, и при его использовании образуется более легко фильтрующейся гипс (СаSO4.2Н2О). Раствор, полученный после фильтрации и промывки гипса, упаривают и осаждают аренсульфонат кальция.
Перевод кальциевой соли в натриевую осуществляют по схеме:
(RSO3)2Сa + Na2CO3 = 2RSO3Na + СаСО3↓ (!)
Из солей свободные сульфокислоты могут быть выделены с помощью ионообменных смол, либо хлороводорода.
Таким образом, стадия выделения продукта сульфирования часто оказывается технологически более сложной и дорогой, чем стадия сульфирования (спокойная, хорошо управляемая реакция, коррозия оборудования незначительная).
Большие трудности вызывает утилизация отходов производства, так как для использования CaSO4, Na2SO4, Na2SO3 нужна их предварительная очистка.
