
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
7. Нитрование разбавленной азотной кислотой
Разбавленная азотная кислота широко применяется для нитрования алканов и алкиларенов в боковую цепь (М.И. Коновалов).
![]()
Реакция идет по радикальному механизму и значительно медленнее, чем электрофильное нитрование ароматических углеводородов.
Один из возможных путей протекания реакции в отсутствие инициаторов можно представить следующей схемой:
![]()
![]()
![]()
![]()
![]()
Направление реакции и реакционная способность нитруемых соединений определяется устойчивостью образующихся радикалов, поэтому жирно-ароматические соединения в первую очередь нитруются в α-положение боковой цепи, а алканы — по третичному атому углерода.
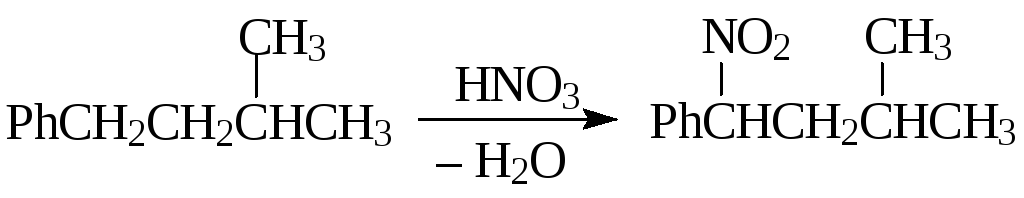

Повышение температуры снижает селективность и ведет к образованию полинитросоединений.
Следует отметить три основных промышленных способа нитрования алканов: 1) в газовой фазе при 350—400 °С с помощью 40—70 %-ной азотной кислоты; 2) в жидкой фазе при 100—200 °С под действием 50—70 %-ной азотной кислоты; 3) окислами азота.
Высокотемпературное газофазное нитрование всегда сопровождается деструкцией углеродной цепи и образованием низших нитроалканов. Таким образом, нитрование алканов является процессом низкоселективным.
Прямое нитрование алканов приводит к получению сложной смеси продуктов и проходит в жестких условиях.
Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
Учебное пособие построено по технологическому признаку, т. е. по методам синтеза целевого продукта. В связи с тем, что часто по разным причинам прямое введение необходимых функциональных групп в молекулу органического соединения невозможно, в этой главе будут рассмотрены процессы замены одних групп атомов на другие. В синтезе биологически активных веществ очень широко используются реакции замещения галогена, поэтому данный раздел посвящен замене его на нуклеофил.
Нуклеофильное замещение атома галогена позволяет получать соединения практически всех классов органических веществ (спирты, эфиры, амины, нитрилы и др.). Благодаря этому, эти реакции широко применяются в синтезе лекарственных субстанций практически всех фармакологических групп.
Сведения о механизмах реакции
Замещение галогена у sp3-гибридного атома углерода обычно осуществляется по SN1 или по SN2 механизмам, а у sp2-гибридного (в арил- и винилгалогенидах) — по механизму присоединения-отщепления либо отщепления-присоединения и значительно труднее, чем у sp3-гибридного.
Механизм SN1 включает две стадии: диссоциация алкилгалогенида на ионы и взаимодействие катиона с нуклеофилом:

Во многих случаях, молекула алкилгалогенида диссоциирует с последовательным образованием контактной ионной пары (а), сольватно-разделенной ионной пары (b) и сольватированных ионов (с). Каждый из продуктов диссоциации может взаимодействовать с реагентом.
Нуклеофильная атака контактной ионной пары, в которой асимметрия в значительной мере сохраняется, приводит к обращению конфигурации. В сольватно-разделенной ионной паре одна сторона катиона экранируется сольватированным галогенид-ионом и атака нуклеофила также более вероятна с другой стороны, что приводит к преимущественному обращению конфигурации, но селективность снижается, и рацемизация увеличивается. Полная рацемизация возможна лишь при взаимодействии реагента со свободным катионом (с). Однако для оптически активных галогенидов при механизме SN1 полная рацемизация обычно не наблюдается (рацемизация составляет от 5 до 20 %). Это, вероятно, можно объяснить завершением процесса до появления в реакционной массе значительного количества сольватированного катиона.
Стадия образования карбокатиона является лимитирующей, а, следовательно, стабильность катиона определяет реакционную способность галогенида. Поэтому скорость процесса зависит от концентрации алкилгалогенида и не зависит от концентрации нуклеофила.
Образование карбокатиона может являться причиной ряда побочных процессов: изомеризация углеродной цепи, элиминирование (EI) и др.:
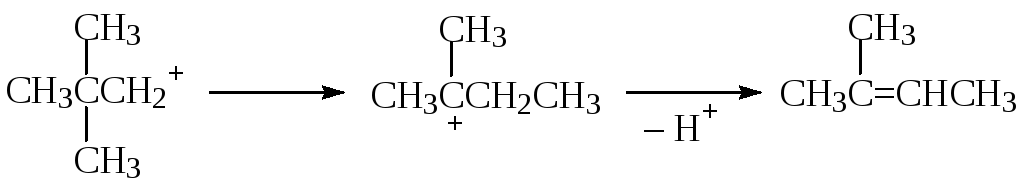
Бимолекулярное замещение SN2 — одностадийный синхронный процесс:

Нуклеофил Nu– атакует субстрат со стороны, противоположной уходящей группе. При этом реакция идет в одну стадию с образованием переходного состояния, в котором sp3-гибридизация центрального атома углерода изменяется на sp2- с р-орбиталью, перпендикулярной плоскости расположения гибридных орбиталей. Одна доля р-орбитали перекрывается с нуклеофилом, а вторая — с уходящей группой. Связь С–Nu образуется одновременно с разрывом связи С–Y, поэтому реакция всегда сопровождается обращением конфигурации. Побочной может быть реакция элиминирования Е2.
Скорость превращения исходных веществ в продукты реакции зависит: от пространственных факторов, величины положительного заряда на атоме углерода субстрата, силы нуклеофила и в кинетической области от концентрации как нуклеофила, так и алкилгалогенида. При большом избытке нуклеофила реакция может протекать по первому или дробному порядку. (Термины SN1 и SN2 указывают лишь на молекулярность, но не на порядок реакции.)
Механизм SNAr (присоединение-отщепление) — обычно реализуется в аренах при наличии электроноакцепторных заместителей (А), которые создают частичный положительный заряд (+) относительно себя в положениях 2, 4, 6 бензольного цикла и направляют туда нуклеофил, а также стабилизируют -комплекс. В гетероциклах эту роль выполняет «пиридиновый» азот, активирующий α-и - положения.

В отличие от механизма SN2 в алкилгалогенидах, в аренах новая связь с нуклеофилом образуется раньше, чем отщепляется уходящая группа. При этом реакция включает стадии присоединения нуклеофила с образованием -комплекса и отщепления галогенид-иона с регенерацией ароматичности цикла.

Первая стадия, а, следовательно, стабильность -комплекса, обычно определяет скорость всей реакции. Чем равномернее распределяется электронное облако -комплекса, тем он устойчивее и тем легче замещается галоген.

Нитрогруппа принимает участие в распределении электронного облака -комплекса, при этом структура (г) — наиболее устойчивая и напоминает анион ациформы нитросоединения. Существование таких -комплексов (соли Мейзенгеймера, 1902 г.) доказано экспериментально.
Механизм отщепления-присоединения (SNEA) реализуется при замене галогена в арилгалогенидах, не содержащих электроноакцепторных групп.
С помощью меченого атома углерода, а также с использованием галогенбензолов, имеющих еще один заместитель, было показано, что нуклеофил присоединяется не только к атому углерода, с которым был связан галоген, но и в равной степени к соседнему атому. Это объясняется тем, что реакция идет через стадию образования 1,2-дегидробензола.

Образование дегидробензола было доказано как физико-химическими, так и чисто химическими методами.
