
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
Замена атома галогена на цианогруппу (синтез нитрилов кислот)
Нитрилы являются важными промежуточными продуктами в синтезе многих химико-фармацевтических препаратов. Они легко превращаются в амиды карбоновых кислот, карбоновые кислоты, амины. При использовании алифатических галогенидов это относительно простой способ удлинения углеродной цепи:

Цианид-ион является амбидентным ионом, поэтому реакция может идти по двум направлениям — с образованием нитрилов и изонитрилов:

Первичные алифатические и бензилгалогениды в спиртах и водно-спиртовых смесях практически не образуют примесь изонитрилов. Небольшие количества изонитрила, которые легко обнаруживаются по крайне неприятному запаху, можно гидролизовать в кислой среде и таким образом отделить от основного продукта. Нитрилы гидролизуются в значительно более жестких условиях.
Выходы алифатических нитрилов при использовании первичных алкил-, бензил и аллилгалогенидов хорошие (до 90 %). В случае вторичных — средние (до 60—70 %). С третичными галогенидами в этих условиях идет реакция элиминирования, поэтому метод неприменим для пространственно затрудненных субстратов.
Реакцию в алкилгалогенидах можно проводить избирательно, учитывая разную подвижность галогенов (Cl < Br < I):
![]()
Правильный выбор растворителя во многом определяет успех реакции галогенида с цианидом. Обычно используют сухой ацетон, 70—90 % спирт, биполярные апротонные растворители, например, диметилсульфоксид, диметилформамид и другие растворители для SN2 реакций.
Реакцию используют для получения циануксусной и малоновой кислот, для синтеза замещенных бензилцианидов и цианметилирования вератрола:

![]()
В случае ароматических галогенидов синтез соответствующих фенилцианидов следует вести в апротонных растворителях при нагревании до 200 °С с цианидом меди (I):
![]()
Замещение галогена на цианид-ион в условиях межфазного катализа повышает выход продукта на 15—20 % даже по сравнению с реакциями в диполярных апротонных растворителях.
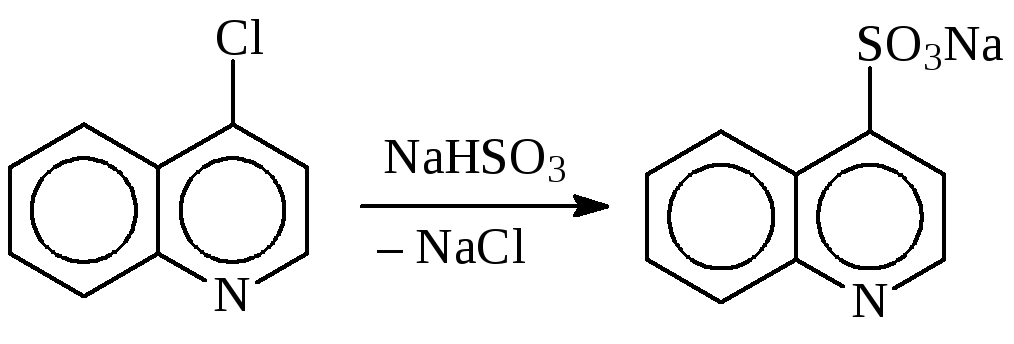
Замена атома галогена на группу -so3Na (синтез сульфокислот)
В качестве реагентов в реакции Штреккера используют сульфиты калия и натрия:
![]()
![]()
Механизм реакции SN2, поэтому в случае использования первичных алкилгалогенидов выходы сульфокислот составляют 70—90 %, вторичных— 20—25 %. Третичные алкилгалогениды превращаются в олефины.
В реакцию вступают также галогензамещенные кислоты, спирты, кетоны и ароматические соединения с подвижным галогеном.
Замена атома галогена на группу –no2 (синтез нитросоединений)
Прямое нитрование алканов приводит к получению сложной смеси продуктов и проходит в жестких условиях. В связи с этим нитроалканов часто получают реакцией алкилгалогенидов с нитрит-ионом

Реакции SN2 идут по наиболее нуклеофильному центру нитрит иона, и продуктом является нитроалкан. Карбкатион (SN1 механизм) взаимодействует с наиболее электроотрицательным атомом (жестким основанием) и образуется алкилнитрит. Третичные алкилгалогениды этим путем в нитроалканы не превращаются. Как правило, из хлоридов получаются нитроалканы, а из бромидов и иодидов с нитритом серебра — алкилнитриты.
Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
Замещение атома водорода в молекуле органического соединения у атомов углерода, азота, кислорода на нитрозогруппу, называется, соответственно, С-, N-, и О-нитрозированием.
Нитрозирование первичных аминов, с образованием солей диазония (R–N+NX–), называется реакцией диазотирования.
Диазотирование и нитрозирование являются быстрыми, необратимыми, экзотермическими и очень «капризными» процессами.
Диазо- и нитрозосоединения обладают высокой реакционной способностью и широко используются в синтезе лекарственных веществ и витаминов. Поскольку диазо- и нитрозосоединения нестабильны, получать их необходимо на том же предприятии, где производят целевой продукт.
