
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
2. Ацилирование по атому азота (n-ацилирование)
Замещение атома водорода у азота ацильной группой (синтез амидов карбоновых кислот) применяется как для получения нового соединения, так и для защиты аминогруппы. Процесс можно представить в виде следующей схемы:

В качестве ацилирующих агентов используют все ацильные производные карбоновых кислот. Взаимодействие их с амином обычно рассматривают как нуклеофильное замещение уходящей группы в ацильных соединениях в два этапа: присоединение — отщепление (SNAE):

Скорость реакции ацилирования и условия ее проведения в значительной мере зависят от строения ацилирующего агента и субстрата.
Реакционная способность ацильных соединений определяется как величиной положительного заряда на атоме углерода карбонильной группы, так и способностью уходящей группы уходить.
Величина положительного заряда С=Огруппы и, следовательно, активность реагента увеличивается с повышением электроноакцепторных свойств радикала. Так, константа диссоциации и ацилирующая активность кислот увеличивается в ряду:
![]()
В ацильных соединениях, полученных из одной и той же кислоты, величина является результатом взаимодействия электронных облаков карбонильной и уходящей групп:

Она увеличивается при возрастании отрицательного индукционного эффекта и уменьшении положительного эффекта сопряжения.
Способность группы Y уходить зависит от того, каким основанием она является: чем сильнее основание, тем хуже уходит. При определении силы основания обычно используют константу диссоциации сопряженной с ним кислоты: чем сильнее кислота, тем слабее сопряженное с ней основание:

В связи с этим ацилирующая активность производных карбоновой кислоты уменьшается от хлорангидрида к амиду.
Хлорангидриды карбоновых кислот самые активные ацилирующие агенты. Их реакции с аминами необратимые, следовательно, реагенты можно брать в стехиометрических соотношениях. Однако хлорангидриды кислот дорогие, малоустойчивые, токсичные и агрессивные агенты, что усложняет технологический процесс, поэтому их, как правило, используют только тогда, когда другие агенты не дают хороших результатов
Для связывания выделяющегося хлористого водорода обычно используют основания. Например, ацилирование L-глутаминовой кислоты п-нитробензоилхлоридом ведут при низкой температуре в присутствии гидрокарбоната натрия или щелочи:

В синтезе биотина используют щелочь:

В синтезах лекарственных препаратов применяют и хлорангидриды двухосновных карбоновых кислот, например, ацилирующим агентом является гександиоилхлорид:

Хлорангидрид угольной кислоты (фосген), в зависимости от соотношения реагентов и условий проведения реакции, может заменять как оба атома хлора, входящих в его молекулу, так и один:

Ангидриды карбоновых кислот являются активными ацилирующими агентами, их реакции с аминами идут необратимо, поэтому используются стехиометрические соотношения реагентов. Однако ангидриды, обычно, дороже и токсичнее кислот и в реакциях N-ацилирования используется только половина молекулы. В связи с этим в синтезах лекарственных препаратов, в основном, встречается наиболее доступный и дешевый уксусный ангидрид:
![]()
Ацилирование аминов уксусным ангидридом обычно ведут в воде при 30—50 °С, однако условия реакции (температура, время, катализатор и т.д.) зависят от активности субстрата.

Если выше приведенную реакцию проводить в неводной среде, то дополнительно образуются О-ацетильное и О,N-диацетильное производные:

В синтезе рентгеноконтрастных препаратов ацетилирование уксусным ангидридом проводят в присутствии катализатора (серной, фосфорной или хлорной кислот):

Иногда уксусный ангидрид используют для образования смешанных ангидридов в ходе реакции:

Карбоновые кислоты наиболее дешевые и доступные, но значительно менее активные реагенты, чем их ангидриды. Кроме того, они образуют с аминами соли, которые не ацилируются. Для разрушения солей реакционную массу нагревают до образования достаточного количества исходного амина и кислоты. Наконец, взаимодействие карбоновых кислот с аминами является обратимой реакцией:

Для смещения равновесия в сторону целевого продукта применяют избыток кислоты и/или выводят образующуюся воду из сферы реакции (отгоняют или связывают средствами, поглощающими воду).
Для ускорения реакции используют минеральную кислоту в качестве катализатора. Для более полного ацилирования амина в конце реакции добавляют ангидрид соответствующей кислоты.
Формилирование и ацетилирование аминов проводят в избытке кислоты (с муравьиной кислотой при 150 °С, с уксусной — при 110—115 °С). При этом часто используют не только 100 %-ные кислоты, но и кислоты с меньшей концентрацией (например, 80 %-ную уксусную кислоту). Нередко реакцию проводят с добавлением бензола. Образующаяся вода отгоняется с избытком кислоты в виде азеотропной смеси с бензолом. Это позволяет проводить реакцию с почти количественным выходом. Например, формилирование анилина ведут следующим образом:
![]()
Формилирование аминов муравьиной кислотой встречается и в синтезе лекарственных веществ:
![]()
![]()
![]()
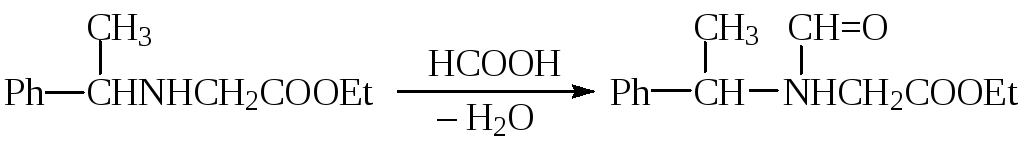
Ацетилирование аминов широко применяется, как для получения лекарственных препаратов, так и для синтеза промежуточных продуктов, для временной защиты аминогруппы:
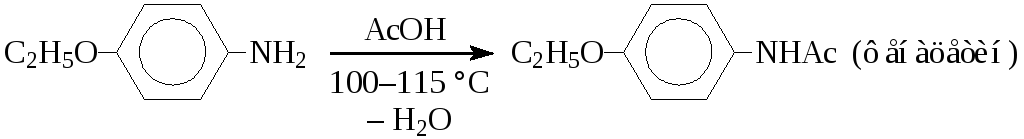

Сложные эфиры карбоновых кислот в большинстве своем малоактивны, но не образуют солей с аминами и реагируют при более низких температурах, чем сами кислоты. Этот метод используется в реакциях с сильными нуклеофилами (гидразинами, гидроксиламином и др.) или в случае эфиров активных карбоновых кислот, имеющих электроноакцепторные заместители в α-положении (алкокси-, хлор-, дихлоруксусных кислот и др.). Реакции идут при низких температурах:

![]()
N-ацилирование амидами карбоновых кислот применяют очень редко из-за малой активности реагента. Тем не менее, известны реакции, где применение амидов в качестве ацилирующих агентов технологически и экономически оправдано.
Амид муравьиной кислоты, который получают из окиси углерода и аммиака, применяется для формилирования аминов:
![]()
![]()
Мочевина используется для получения N-алкилмочевины:
![]()
Ацилирование гидроксиламина и гидразина амидами карбоновых кислот применяется в синтезе гидроксамовых кислот и гидразидов карбоновых кислот:

3. О-Ацилирование (получение сложных эфиров)
Ацилирование гидроксисоединений проводится реже, чем аминогрупп и идет менее энергично. Механизмы О- и N-ацилирования, обычно, одинаковые, поэтому активность ацильных соединений изменяется также, как в случае аминов. Условия реакции зависят от строения субстрата и реагента. Свойства ацилирующих агентов приведены в разделе «N-ацилирование».
О-Ацилирование хлорангидридами кислот можно представить следующей схемой:
![]()
Для связывания выделяющегося хлористого водорода применяют основания или ведут реакцию в таких условиях (среда, температура), когда выделяющийся хлористый водород удаляется из реакционной массы:
Хлороводород связывают: щелочью, гидрокарбонатом натрия, триэтиламином, пиридином:



При ацилировании аминоспирта в кипящем дихлорэтане образуется соль продукта:

В ряде случаев гидроксисоединения ацилируют смесью кислоты и треххлористого фосфора (PCl3) или хлорокиси фосфора (POCl3). Вероятно, реакция протекает через стадию образования хлорангидрида кислоты:

При О-ацилировании ангидридами кислот используется только половина молекулы, поэтому в промышленном синтезе применяется, в основном, уксусный и фталевый ангидриды.
![]()
Ацилирование уксусным ангидридом в водных щелочных растворах проводят при температуре до 50 °С, так как в этих условиях он реагирует с гидроксисоединениями значительно быстрее, чем с водой. В среде же уксусной кислоты или в неводных растворителях ацилирование обычно ведут при температуре кипения реакционной массы.
Так, ацетилирование салициловой кислоты уксусным ангидридом ведут в хлорбензоле при температуре 78—82 °С два часа:

Для ускорения реакции уксусного ангидрида с гидроксисоединениями в ряде случаев используют кислоты (серную, фосфорную) или пиридин:
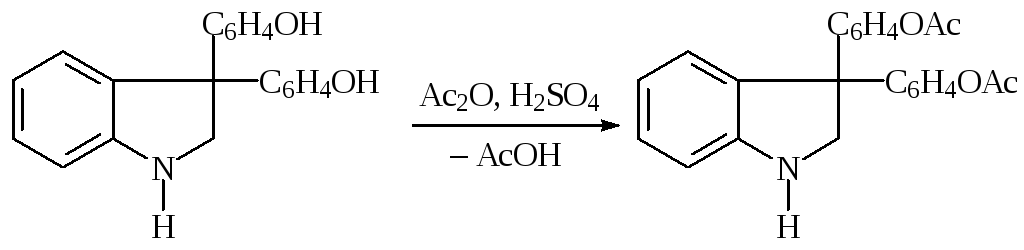
![]()

Карбоновые кислоты значительно менее активные реагенты, чем ангидриды, не взаимодействуют с фенолами, к тому же их реакции со спиртами обратимые, однако это наиболее дешевый и доступный реагент. Реакцию этерификации обычно ведут в присутствии минеральных кислот. Чаще других для активации ацилирующего агента используют серную кислоту:
![]()
![]()
![]()
![]()

Значительно реже используют соляную и фосфорную кислоты:

В связи с малой активностью сложных эфиров реакцию переэтерификации проводят при повышенных температурах в присутствии катализаторов. Например, переэтерификацию метилуретана производным триметиленгликоля проводят при температуре до 150 °С:

Реакцию проводят под вакуумом, выделяющийся метанол отгоняют.
Переэтерификацию анестезина β-диэтиламиноэтиловым спиртом в синтезе новокаина ведут при температуре от 80 до 110 °С под вакуумом с отгонкой азеотропной смеси этанола с аминоспиртом:

Алкоголят получают нагреванием избытка аминоспирта с твердым КОН при температуре до 120 °С с отгонкой воды.
