
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
2. Ковалентные связи в соединениях углерода
Ковалентные связи, свойства, способы и причины образования – школьная программа.
Напомню, лишь что:
1. Образование связи между атомами можно рассматривать как результат перекрывания их атомных орбиталей, при этом, чем оно эффективнее (больше интеграл перекрывания), тем прочнее связь.
Согласно расчетным данным, относительные эффективности перекрывания атомных орбиталей Sотн возрастают следующим образом:
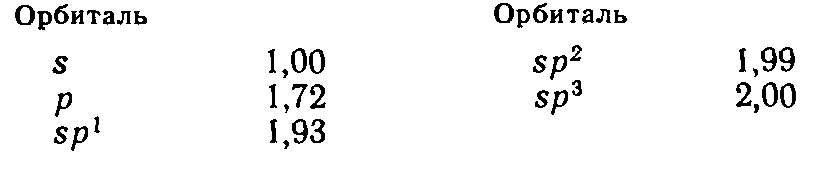
Следовательно, использование гибридных орбиталей, например, sp3-орбиталей углерода в образовании связей с четырьмя атомами водорода, приводит к возникновению более прочных связей.
2. Ковалентные связи в соединениях углерода образуются двумя способами:
А) Если две атомные орбитали перекрываются вдоль их главных осей, то образующуюся связь называют — σ-связью.
Геометрия. Так, при образовании связей с атомами водорода в метане четыре гибридные sр3~орбитали атома углерода перекрываются с s-орбиталями четырех атомов водорода, образуя четыре идентичные прочные σ-связи, располагающиеся под углом 109°28' друг к другу (стандартный тетраэдрический угол). Сходная строго симметричная тетраэдрическая структура возникает также, например, при образовании ССl4; если же атомы, образующие связи с углеродом, неодинаковы, например, в случае СН2С12, пространственная структура будет несколько отличаться от полностью симметричной, хотя по существу она остается тетраэдрической.
Длина σ-связи между атомами углерода зависит от гибридизации атомов и уменьшается при переходе от sр3 – гибридизации к sр. Это объясняется тем, что s – орбиталь находится ближе к ядру, чем р-орбиталь, поэтому, чем больше её доля в гибридной орбитале, тем она короче, а следовательно, короче и образующаяся связь
Б) Если две атомные p-орбитали, расположенные параллельно друг другу, осуществляют боковое перекрывание над и под плоскостью, где расположены атомы, то образующуюся связь называют — π (пи) -связью
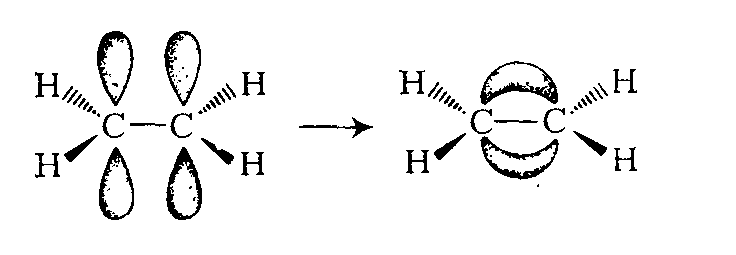

Боковое перекрывание атомных орбиталей менее эффективно, чем перекрывание вдоль главной оси, поэтому π -связи менее прочны, чем σ -связи. Это проявляется, в частности, в том, что энергия двойной углерод-углеродной связи превышает энергию одинарной связи менее чем в два раза. Так, энергия связи С—С в этане равна 347 кДж/моль, тогда как энергия связи С = С в этене составляет только 598 кДж/моль, а не ~ 700 кДж/моль.
Степень бокового перекрывания двух атомных 2р-орбиталей, а следовательно, и прочность π -связи максимальна, если два атома углерода и четыре связанные с ними атомы расположены строго в одной плоскости, т. е. если они копланарны, поскольку только в этом случае атомные 2р-орбитали точно параллельны одна другой и поэтому способны к максимальному перекрыванию. Любое отклонение от копланарного состояния вследствие поворота вокруг σ-связи, соединяющей два атома углерода, приведет к уменьшению степени перекрывания и соответственно к снижению прочности π-связи, которая, таким образом, способствует сохранению плоскостности молекулы.
Вращение вокруг двойной углерод-углеродной связи невозможно.
Распределение π-электронов над и под плоскостью молекулы означает существование области отрицательного заряда, готовой к взаимодействию с любыми электронодефицитными реагентами.
Атомы кислорода, азота и др. также имеют разные валентные состояния (гибридизации), при этом их электронные пары могут находиться как на гибридных, так и p-орбиталях.
