
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
5. Реакция азосочетания
Одним из важнейших превращений солей диазония, во многом определившим их широкое использование, является реакция азосочетания. Диазотирование аминов при этом обычно ведут в соляной кислоте, так как NOCl активнее N2O3.
Азосочетание с аренами идет по механизму электрофильного замещения. Электрофилом (диазосоставляющей) является диазокатион. В качестве азосоставляющей чаще всего используют фенолы и амины, а также другие активированные арены (производные бензола, нафталина, гетероциклов и др.). Это связано с тем, что обычно диазокатион существует при 0—10 °С, поэтому реакцию азосочетания ведут при температуре 0—25 °С, а в этих условиях с диазокатионом реагируют только активированные арены.

![]()
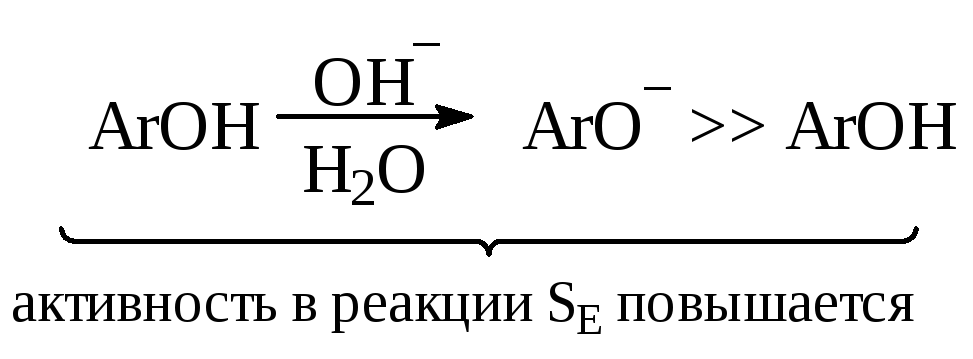
Активность электрофильных частиц в этой реакции зависит от заместителей в ароматическом ядре в орто- и пара-положениях относительно диазогруппы и уменьшается в ряду:

Сочетание с фенолами и нафтолами чаще всего проводят в слабощелочной среде (растворы соды, ацетата натрия), в которой они хорошо растворяются и находятся в активной фенолятной форме. Сильнощелочные растворы (растворы NaOH) неблагоприятны для азосочетания, так как переводят соли диазония в неактивные формы (диазогидрат и диазотат).

Сочетание с аминами лучше вести в слабокислой среде (разбавленная уксусная кислота). В этих условиях амины растворяются, и значительная часть их находится в активной форме, а соли диазония устойчивы.
Сильнокислая среда недопустима, т.к. группа NH3+ является акцептором электронов и дезактивирует ароматическое ядро. Соли аминов не вступают в реакцию азосочетания.
В случае первичных и вторичных аминов электрофилы атакуют и атом азота. Образующиеся при этом диазоаминосоединения (арилтриазены) в ряде случаев изомеризуются в С-азосоединения:
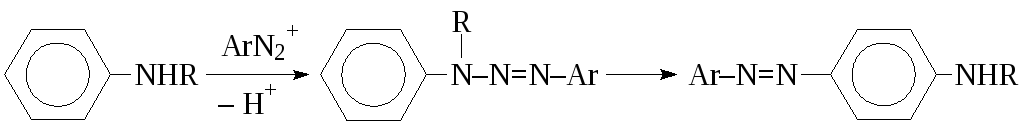
Направление реакции азосочетания с первичными и вторичными аминами сильно зависит от кислотности среды. Чтобы снизить образование побочных арилтриазенов реакцию проводят при рН не более 4.
Азосочетание ведут при низких температурах (0—25 °С), чтобы избежать разложения соли диазония. Реакция проходит практически нацело. Продукт реакции, как правило, нерастворим и может быть выделен из реакционной массы фильтрованием.
Глава 5. Методы получения органических галогенидов
Методов получения органических галогенидов много. Кроме собственно «галогенирования» — процесса замены атома водорода в молекуле органического соединения на галоген (Hlg) — используются и другие методы образования связи C–Hlg. Выбор метода и условий проведения реакции зависит как от природы субстрата, так и от природы вводимого галогена (фтор, хлор, бром, иод).
Органические галогениды, благодаря высокой химической активности, широко используются в синтезе новых соединений, в том числе и БАВ. Они вступают в реакции нуклеофильной замены атома галогена, элиминирования, образования металлорганических соединений, и т.д.
Соединения, содержащие галоген, часто биологически активны: алифатические галогениды нередко обладают наркотическими, а арилгалогениды — антимикробными свойствами. В связи с этим, в состав молекулы многих лекарственных соединений входит один или несколько атомов галогена (хлороформ, хлоралгидрат, бромизовал, дииодтирозин, левомицетин, фторурацил и т.д.). Биологическую активность галогенидов связывают, с одной стороны, с их высокой растворимостью в жировых тканях и липидах и, с другой стороны, с высокой химической активностью (в частности, алкилирующей).
Увеличение числа атомов галогена в молекуле соединения, как правило, приводит к увеличению его токсичности.
