
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
Получение простых эфиров в синтезе лекарственных препаратов встречается значительно чаще, чем гидролиз. Реакция идет как по SN2 механизму, так и по механизму SNAr.

Ароматические субстраты (арилгалогениды) должны быть активированными, иначе выход целевого продукта (эфира) может оказаться низким за счет побочных процессов.
В качестве реагента используют либо алкоголят, либо спирт в щелочной среде.

Следует отметить, что все эти реакции по замене атома водорода или металла у атома кислорода на алкил или арил можно отнести к реакциям алкилирования и арилирования, которые будут рассмотрены в следующих разделах.
Применение метода межфазного катализа в синтезе простых эфиров позволяет повысить выход продукта, скорость реакции и технически упростить процесс.
При получении эфиров по Вильямсону в большинстве случаев используют обезвоженные реагенты и растворители, а также такие сильные основания как металлический натрий и амид натрия, необходимые для получения алкоголята. Это усложняет производство и повышает его опасность.
В двухфазном синтезе в качестве основания используется концентрированный (обычно 50 %-ный) водный раствор щелочи, при этом нет необходимости обезвоживать растворители. Щелочь депротонирует спирт в водной среде или на границе раздела фаз. Образовавшийся алкоголят-ион взаимодействует с липофильным катионом межфазного катализатора (чаще всего четвертичная соль аммония) и переходит в органическую фазу. В отличие от него более эффективно гидратированный гидроксид-ион ОН– остается в водной фазе.
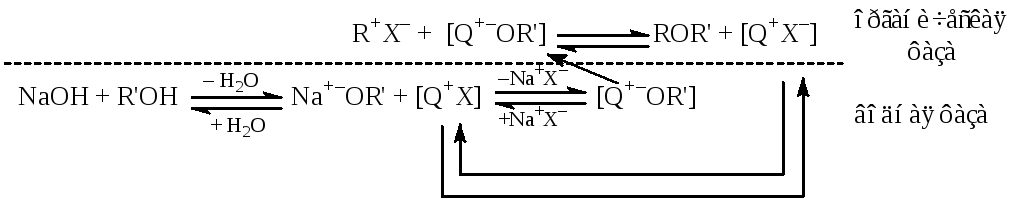
Увеличение скорости процесса объясняется повышением нуклеофильности алкоголят-иона, который, во-первых, при переходе из водной фазы в органическую теряет гидратную оболочку, что в гомогенных условиях затруднено, особенно в протонных растворителях; во-вторых, при замене катионов калия или натрия на больший по размеру катион межфазного катализатора повышается его свобода от противоиона.


Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
Синтез тиоспиртов и тиоэфиров осуществляется с помощью реагентов, содержащих гидросульфид-, сульфид- и алкил(арил)тио-ионы.
![]()
![]()
Вместо сульфидов металлов, которые в результате гидролиза выделяют сероводород, можно использовать тиомочевину
Субстратами могут быть алкил и арилгалогениды:
Реакцию с алкилгалогенидами обычно проводят в среде этанола:
![]()
Реакции с активированными алкил- и арилгалогенидами, как правило, идут с хорошими выходами по SN2 и SNAr механизму. Под действием сульфид-иона (S–2) можно получить диалкил- и диарилсульфиды:
![]()
![]()
Алкил(арил)тио – ион (Alk(Ar)S–) сильный нуклеофил и в полярных апротонных растворителях (диметилформамид, диметилсульфоксид) реагирует даже с неактивированными ароматическими и алифатическими галогенидами, например, винилгалогенидом:
![]()
Замена атома галогена на аминогруппы (синтез аминов)
В алкилгалогенидах замена галогена на аминогруппу осуществляется нагреванием их со спиртовым, водным или водно-спиртовым раствором аммиака, первичного или вторичного амина под давлением в автоклаве. При этом образуется смесь первичных, вторичных, третичных аминов и четвертичных солей аммония:
![]()
Третичные алкилгалогениды в этих условиях образуют алкены и для алкилирования аминов обычно не применяются.
Условия реакции зависят от активности галогенида и нуклеофила, температура колеблется от 50 до 150 °С, в основном реализуются механизмы SN2 и SNAr.
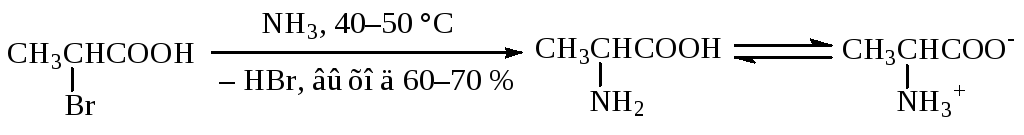
Основным недостатком приведенного метода получения аминов является полиалкилирование, которое обусловлено повышением нуклеофильности реагентов от аммиака к третичному амину. Выход первичного амина можно повысить, используя специальные технологические приемы. Однако даже в этом случае образуется смесь соединений, которые приходится разделять. Лишь α-галогенкарбоновые кислоты при действии большого избытка концентрированного водного раствора аммиака и карбоната аммония при 40—50 °С образуют α-аминокислоты (первичные амины) с выходом 60—70 %. Для примера приведен синтез аланина:
При аммонолизе алкилгалогенидов ароматическими аминами нуклеофильность продукта повышается мало, и реакция идет значительно селективнее:
![]()
Среди селективных методов получения аминов из алкилгалогенидов, наиболее широко применяемых в синтезе БАВ, необходимо отметить:
-
Синтез первичных и вторичных аминов из амидов сульфокислот:


-
Синтез первичных аминов по Габриэлю из фталимида:
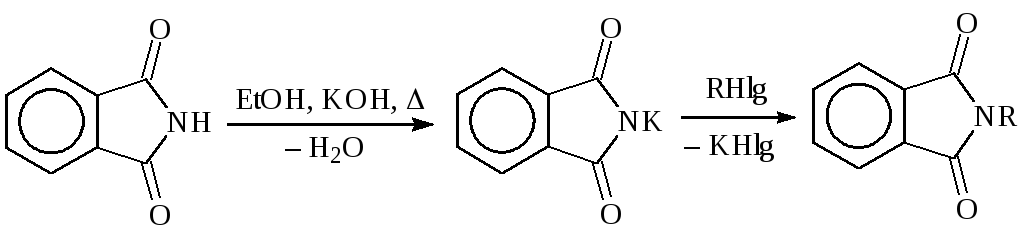
Гидролиз N-алкилфталимида осуществляют водными растворами кислот или оснований при высоких температурах под давлением.

Иногда для выделения аминов используют гидразинолиз, который идет при нормальном давлении.
-
Синтез вторичных аминов из азометинов и алкилгалогенидов:

В неактивированных галогенаренах замена галогена осуществляется действием раствора аммиака при высокой температуре (~ 200 °С) и давлении в присутствии катализатора (Cu2O, Cu2Cl2 и т.д.) через образование медного комплекса, или действием амида натрия в жидком аммиаке в более жестких условиях через образование дегидробензола. Примером может служить синтез 3,4-ксилидина в производстве рибофлавина:

В активированных галогенаренах условия замены галогена зависят от его реакционной способности:

