
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
-
Атом углерода, его особенности, валентные состояния
Органическая химия – химия атома углерода. Число соединений на уго основе (органических соединений) в десятки раз больше, чем неорганических, что может быть объяснено только особенностями атома углерода:
а) он находится в середине шкалы электроотрицательности и второго периода, поэтому ему невыгодно отдавать свои и принимать чужие электроны и приобретать положительный или отрицательный заряд;
б) он имеет особенное строение валентной электронной оболочки в возбужденном состоянии – нет электронных пар и свободных орбиталей (есть еще только один атом с подобным строением – водород, вероятно, поэтому углерод с водородом образует столь много соединений - углеводородов).
Состояние электронного облака атома углерода
- в невозбужденном состоянии электронная формула имеет вид:
С – 1s22s22p2 или 1s22s22px12py1 2pz0
В
графическом виде:
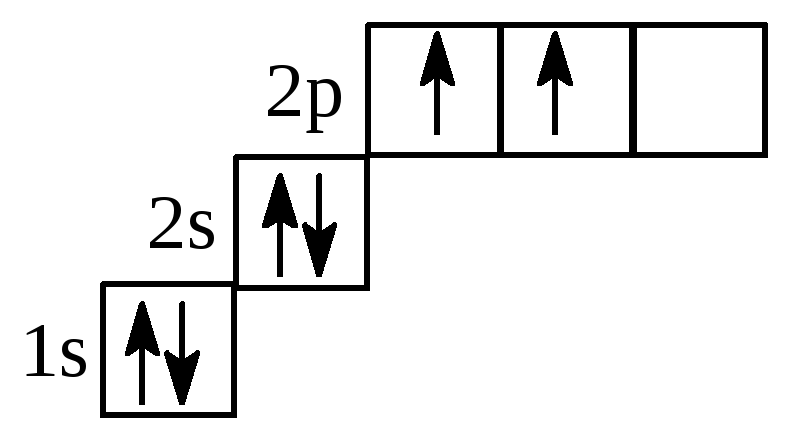
- в возбужденном состоянии:
*С – 1s22s12p3 или 1s22s12px12py1 2pz1
В
виде ячеек:
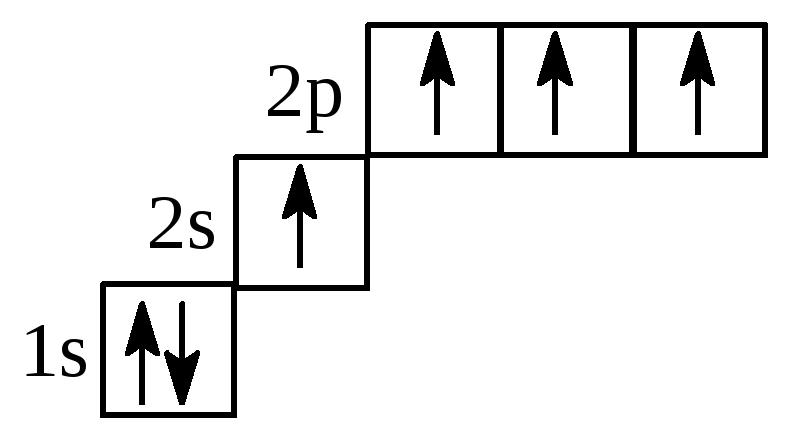
- Форма s- и p – орбиталей


Атомная орбиталь - область пространства, где с наибольшей вероятностью можно обнаружить электрон, с соответствующими квантовыми числами.
Относительные размеры атомных орбиталей увеличиваются по мере возрастания их энергий (главное квантовое число - n), а их форма и ориентация в пространстве определяется – квантовыми числами l и m. Электроны на орбиталях характеризуются спиновым квантовым числом. На каждой орбитали могут находиться не более 2 электронов с противоположными спинами.
При образовании связей с другими атомами электронная оболочка атома углерода преобразуется так, чтобы образовались наиболее прочные связи, а, следовательно, выделилось как можно больше энергии, и система приобретала наибольшую устойчивость.
Энергия, затраченная на изменение электронной оболочки атома, затем компенсируется за счет образования более прочных связей.
Различают 3 типа преобразования электронной оболочки (гибридизации) углерода, в зависимости от числа атомов, с которыми он образует связи.
Виды гибридизации атома углерода:
sp3 – Гибридизация (валентное состояние) – углерод образует связи с 4 соседними атомами (тетраэдрическая гибридизация):
Электронная формула sp3 – гибридного атома углерода:
*С
–1s22(sp3)4
в виде ячеек
![]() .
.
В гибридизации участвуют одна s- и три p-орбитали, которые суммируются и образуют четыре sp3 – гибридных орбитали, направленные к углам правильного тетраэдра.
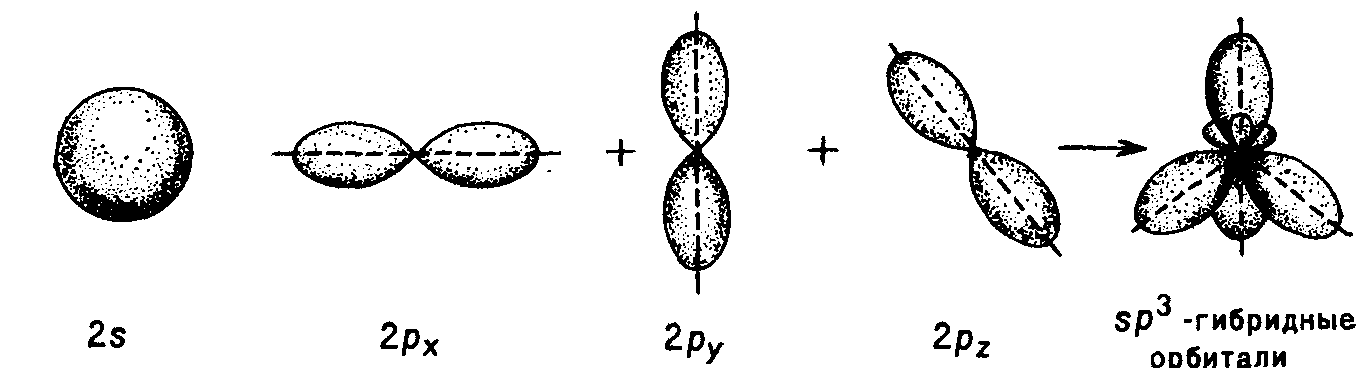
Валентный угол между гибридными орбиталями ~109°.
Стереохимическая формула атома углерода:

sp2 – Гибридизация (валентное состояние) – атом образует связи с тремя соседними атомами (тригональная гибридизация):
Электронная формула sp2 – гибридного атома углерода:
*С
–1s22(sp2)32p1
в виде ячеек


В гибридизации участвуют одна s- и две p-орбитали, которые суммируются и образуют три sp2 – гибридных орбитали, расположенные в одной плоскости. Оставшаяся p-орбиталь расположена перпендикулярно этой плоскости.
Валентный угол между гибридными орбиталями ~120°.
Стереохимическая формула sp2 – гибридного атома углерода:

sp – Гибридизация (валентное состояние) – атом образует связи с 2 соседними атомами (линейная гибридизация):
Электронная формула sp – гибридного атома углерода:
*С
–1s22(sp)22p2
в виде ячеек


Валентный угол между гибридными орбиталями ~180°.
Стереохимическая формула:

Во всех видах гибридизации участвует s-орбиталь, т.к. она имеет минимум энергии.
Перестройка электронного облака позволяет образовывать максимально прочные связи и минимальное взаимодействие атомов в образующейся молекуле. При этом гибридные орбитали могут быть не идентичные, а валентные углы – разные, например СН2Cl2 и СCl4
