
- •Глава 6. Гельминтозы 291
- •Глава 7. Инфекции дыхательных путей 327
- •Глава 8. Трансмиссивные (кровяные) инфекции 473
- •Глава 9. Инфекции наружных покровов 604
- •Глава 10. Прионовые болезни 675
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5. Кишечные инфекции и инвазии 70
- •Глава 6. Гельминтозы 291
- •Период болезни
- •Глава 6
- •21. Шувалова
- •Глава 7
- •Спинномозговая пункция с исследованием цереброспинальной жидкости. Гнойный менингит
- •Бактериологическое исследование цереброспинальной жидкости, крови, носоглоточной слизи
- •Глава 8
- •31. Шувалова
- •32. Шувалова
- •Рск с антигена из Rprourazei им с антигеном из Rprourazekt
- •Симптом
- •Головная боль
- •34. Шувалова
- •P. Vivax p. Ovale Кровь Печень ВыздороВление p. Malariae
- •Общая продолжительность p.Vivax-малярии составляет от 1,5 года до 3 лет, р. Ovale-малярии — 2—3 года (от 1 года до 4 лет).
- •Малярия?
- •Малярия
- •Лейшманиоз кожный
- •Глава 9
- •Инфекции наружных покровов
- •Зя Шувалова
- •Глава 10
- •Прионовые болезни
- •Предметный указатель
Период болезни
1—3 иед
Тоже
Начальный период (1-я неделя болезни)
Разгар болезни (2—3-я неделя болезни)
Разгар болезни (2—3-я неделя болезни)
Период разрешения болезни (4-я неделя болезни)
Период выздоровления (5—6-я неделя болезни)
С момента развития инфекции возникают защитные реакции, способствующие освобождению организма от микроорганизма-возбудителя. В этом процессе немаловажная роль принадлежит специфическим антителам (опсонины, агглютинины, бактериолизины, преципитины, антиэндотоксины, комплементсвязывающие), а также нарастанию фагоцитарной активности макрофагов.
В процессе освобождения организма от бактерий брюшно-.о тифа существенное значение имеет усиление функции выделительных систем: печени, желез кишечника (кишечные крипты, или либеркюновы железы), почек. Начиная с 8—9-го дня болезни бактерии вместе с желчью выделяются в просвет кишечника и частично выводятся из организма. Оставшиеся бактерии внедряются в первично сенсибилизированные групповые и солитарные лимфатические фолликулы дистального отдела тонкой кишки. Быстрое развитие в них некротического процесса объясняют аллергической реакцией, проявляющейся в виде гиперергического воспаления (выделительно-аллергическая фаза).
Выделение возбудителя из организма может также происходить с мочой, потом, слюной, грудным молоком. Значительное усиление выделения бактерий из организма, накопление специфических антител, повышение фагоцитарной активности макрофагов свидетельствуют о формировании иммунитета и восстановлении физиологического равновесия. Из локализованных очагов брюшнотифозные бактерии могут прорываться в кровь с последующей генерализацией инфекционного процесса в виде рецидивов болезни.
Существенное значение в возникновении рецидивов имеет недостаточная напряженность формирующегося иммунитета вследствие приема антибиотиков, которые, ослабляя антигенное раздражение, способствуют снижению выработки специфических антител.
При брюшном тифе нередко наблюдается длительное бактериовыделение. В настоящее время оно рассматривается как хроническая форма брюшнотифозной инфекции, при которой возбудитель сохраняется в клетках СМФ. В основе формирования брюшнотифозного носительства лежит несовершенство иммунной системы. У хронических носителей выявлен дефицит макроглобулиновых О-антител (IgM). Известно, что этому классу иммуноглобулинов принадлежит важная роль в формировании противобрюшнотифозного иммунитета.
Показано, что в случаях бактериовыделения брюшнотифозные бактерии при внутриклеточном паразитировании в клетках СМФ в костном мозге могут переходить в L-формы, которые в определенных условиях среды могут реверсировать в исходные формы бактерий и вызывать бессимптомную бактериемию с выделением возбудителя с испражнениями.
Основные патоморфологические изменения при тифо-паратифозных заболеваниях наблюдаются в лимфоидной ткани подвздошной кишки. Закономерность и цикличность развития этих изменений в кишечнике послужили основанием для выделения пяти патоморфологических периодов. Они условны, так как не всегда полностью соответствуют клиническим периодам и тяжести болезни.
Первый период соответствует примерно 1-й неделе болезни и характеризуется значительным набуханием лимфоидной ткани тонкой кишки. Групповые и солитарные лимфатические фолликулы увеличиваются в размерах и выступают над уровнем слизистой оболочки — период мозговидного набухания (рис. 1, а; см. цв. вклейку). На 2-й неделе начинается некротизация центральных частей набухших лимфатических образований (период некроза). Поверхность их становится грязно-серой или зеленовато-желтой. На 3-й неделе происходит отторжение некротизированных элементов лимфоидной ткани и образование язв (период образования язв) (рис. 1, б). При этом обнажаются глубокие слои слизистой оболочки и подслизистой основы. К концу 3-й — началу 4-й недели болезни отторжение некротизированных тканей заканчивается и начинается четвертый период — период «чистых язв». Язвы с чистым, гладким дном и слегка набухшими краями образуются в области групповых и солитарных лимфатических фолликулов, располагаясь вдоль подвздошной кишки. Пятый период, соответствующий примерно 5—6-й неделе болезни, характеризуется заживлением язв без стягивающих Рубцовых изменений, но с незначительной пигментацией аспидно-серого цвета.
Специфическими для брюшного тифа являются гиперпластические процессы в ретикулярной строме групповых и солитарных лимфатических фолликулов. Кроме гиперплазии, формируются брюшнотифозные гранулемы («тифомы»), состоящие из макрофагов в виде крупных, так называемых тифозных клеток с массивной светлой цитоплазмой и светлыми ядрами. Их находят в червеобразном отростке, толстой кишке, лимфатических узлах брыжейки, в печени, селезенке, костном мозге, реже в лимфоидной ткани глотки, альвеолах, мозговых оболочках.
Печень при брюшном тифе увеличенная, набухшая, на разрезе тусклая, желтоватого цвета. При микроскопическом исследовании обнаруживаются специфические гранулемы с очагами некроза, белковая и жировая дистрофия гепатоцитов. Селезенка увеличена за счет кровенаполнения и воспалительной пролиферации ретикулярных клеток с образованием тифозных гранулем, возможно развитие инфарктов селезенки с их последующим нагноением. В почках — мутное набухание. Иногда могут встречаться некротический нефроз, геморрагический или эмболический нефрит и воспалительные процессы в лоханках, мочеточниках и мочевом пузыре. Дегенеративные изменения часто выявляются в сердечной мышце и нервных ганглиях. Такие же изменения наблюдаются в ганглиозных клетках узлов симпатической нервной системы, вегетативных сплетениях. Характерен восковидный (ценкеровский) некроз прямых мышц живота.
Пневмонии при брюшном тифе в большинстве случаев обусловлены вторичной инфекцией, но встречаются и специфические брюшнотифозные пневмонии с образованием типичных гранулем («пневмотиф»).
Розеолезная сыпь при брюшном тифе и паратифах появляется в результате продуктивно-воспалительных изменений поверхностных слоев кожи по ходу кровеносных и лимфатических сосудов. В соскобах розеол обнаруживают возбудителя заболевания.
Существенных отличий в патологоанатомической картине, наблюдаемой при брюшном тифе и паратифах, нет.
Клиническая картина. Продолжительность инкубационного периода при брюшном тифе колеблется от 7 до 25 дней, чаще составляя 9—14 дней.
Различают типичное и атипичное течение брюшного тифа. Типичные формы протекают циклически. Это позволяет выделить четыре периода заболевания: начальный, разгара, разрешения болезни и выздоровления. По тяжести клинических проявлений различают легкую, средней тяжести и тяжелую формы брюшного тифа.
В соответствии с особенностями течения заболевания различают неосложенный и осложненный брюшной тиф.
Начальный период болезни. Характеризуется постепенным или, реже, острым развитием интоксикационного синдрома.
При постепенном развитии симптомов заболевания в первые дни больные отмечают повышенную утомляемость, нарастающую слабость, озноб, усиливающуюся головную боль, снижение или отсутствие аппетита Температура тела, ежедневно ступенеобразно повышаясь, к 5—7-му дню заболевания достигает 39—40 "С. К этому времени все явления интоксикации нарастают, развиваются значительная слабость, адинамия, становится упорной головная боль, нарушается сон, возникают анорексия, обстипация, метеоризм. Иногда при погрешностях в диете наблюдается диарея. Стул редко бывает более 2—4 раз в сутки.
При остром начале заболевания в первые 2—3 дня все симптомы интоксикации достигают полного развития.
При обследовании больных в начальном периоде болезни обращают на себя внимание некоторая заторможенность и адинамия. Больные безучастны к окружающему, на вопросы отвечают односложно, не сразу. Лицо бледное или слегка ги-перемировано, иногда немного пастозное.
При исследовании сердечно-сосудистой системы отмечается относительная брадикардия, иногда дикротия пульса, чаще у молодых атлетически сложенных мужчин. Артериальное давление снижено. Над легкими нередко выслушиваются везикулярное дыхание с жестким оттенком и рассеянные сухие хрипы, что свидетельствует о развитии диффузного бронхита.
Пищеварительная система закономерно вовлекается в патологический процесс и изменения ее органов имеют большое диагностическое значение. Язык обычно утолщен, с отпечатками зубов на боковых поверхностях. Спинка языка покрыта серовато-белым налетом, края и кончик свободны от налета, имеют насыщенно-розовый или красный цвет. Зев слегка ги-перемирован, иногда наблюдаются увеличение и гиперемия миндалин. Живот умеренно вздут вследствие метеоризма. При пальпации в правой подвздошной области определяется грубое, крупнокалиберное урчание в слепой кишке и мелкокалиберное урчание и болезненность по ходу терминального отдела подвздошной кишки, свидетельствующие о наличии илеи-та. При перкуссии отмечается укорочение перкуторного звука в илеоцекальной области (симптом Падалки), что обусловлено гиперплазией воспалительно измененных лимфатических узлов брыжейки. Об этом же свидетельствует и положительный «перекрестный» симптом Штернберга. К концу 1-й недели заболевания выявляется увеличение печени и селезенки (очень важный признак!).
В гемограмме после кратковременного (в первые 2—3 дня) умеренного лейкоцитоза с 4—5-го дня болезни отмечаются лейкопения со сдвигом лейкоцитарной формулы влево, анэо-зинофилия, относительный лимфоцитоз и тромбоцитопения. СОЭ умеренно увеличена. Изменения в гемограмме являются закономерным следствием воздействия токсинов брюшнотифозных бактерий на костный мозг. Изменения в урограмме нередко укладываются в синдром инфекционно-токсической почки: протеинурия, микрогематурия, цилиндрурия.
Период разгара болезни. К концу 1 -й — началу 2-й недели наступает период разгара болезни, когда все симптомы достигают своего максимального развития. Он продолжается 1— 2 нед. Температура тела, постепенно повысившись до 39— 40 °С, может иметь в дальнейшем постоянный характер (вун-дерлиховский тип температурной кривой) или иметь много-волновый характер (боткинский тип при развитии рецидивов болезни), температурная кривая может иметь характер «наклонной плоскости» (по Кильдюшевскому; рис. 2). В этот период болезни головная боль и бессонница нередко становятся мучительными. Развивается status typhosus, характеризующий-
ЛДЪОРД ТОРНЫЕ
петы
&
Гемокультура 5. typhi РНГй i 1-.200
вклейку). При надавливании или растяжении кожи по краям розеолы она исчезает, после чего появляется вновь. Каждый элемент сыпи существует 1—5 дней, чаще 3—4 дня. После исчезновения сыпи остается едва заметная пигментация кожи. Могут образовываться новые розеолы одновременно с угасанием старых (феномен «подсыпания»), что связано с волнообразным течением бактериемии. У некоторых больных обнаруживается желтушное окрашивание кожи ладоней и подошв — каротиновая гиперхромия кожи (симптом Филипповича), возникающая вследствие нарушения каротинового обмена, обусловленного поражением печени.
В разгар болезни сохраняются относительная брадикардия, дикротия пульса, еще более снижается артериальное давление. Поражение сердечной мышцы проявляется умеренным смещением границ сердечной тупости влево, глухостью тонов сердца, негрубым систолическим шумом, выслушиваемым на верхушке и у основания сердца.
Над легкими продолжают выслушиваться везикулярное дыхание с жестким оттенком и рассеянные сухие хрипы. В некоторых случаях возникают симптомы очаговой пневмонии, обусловленные как самим возбудителем брюшного тифа, так и сопутствующей микрофлорой.
Симптомы поражения органов пищеварения в разгар заболевания достигают максимального развития. Губы больных сухие, нередко покрыты корочками. Язык утолщен, густо обложен серо-коричневатым налетом, края и кончик его ярко-красного цвета с отпечатками зубов («тифозный», «поджаренный» язык). В тяжелых случаях язык становится сухим и принимает фулигинозный вид. Живот вздут вследствие метеоризма. Стул задержан, в некоторых случаях жидкий, испражнения в виде горохового супа и со своеобразным кислым запахом. Отчетливыми становятся урчание и болезненность при пальпации илеоцекального отдела кишечника, сохраняются положительные симптомы Падалки и Штернберга. Печень увеличена, хорошо доступна пальпации, край ее ровный, слегка закругленный, иногда болезненный, консистенция тестова-тая. Селезенка увеличена, как правило, доступна пальпации.
В разгар болезни уменьшается количество выделяемой мочи. Определяются протеинурия, микрогематурия, цилиндр-урия. Возникает бактериурия, которая иногда приводит к воспалению слизистой оболочки почечных лоханок и мочевого пузыря.
В этот период заболевания могут возникать такие опасные осложнения, как перфорация брюшнотифозных язв и кишечное кровотечение. В некоторых случаях вследствие тяжелой интоксикации и опасных осложнений может наступить смерть.
Период разрешения болезни. Температура тела снижается,
симптомы Энце/ралопатив
Бронхоаденит
Гепашплено-мееолия
Розеолы Мезаденит
Гемограмма ■■ лейкопений неитропения увеличение СОЭ
Терминальный илеит
Копрануль тура !уринокульгура
'С
|
Й |
74, |
|
|
|
37 ^ |
37 |
VJ
37
Гые'^ил^Г0^™*1 основные проявления и температурные кривые (типы). А - Вундерлиха, Б - Кильдюшевского, В - Боткина.
ся резкой слабостью, адинамией, апатией, нарушением сознания от оглушенности до сопора или комы. Возможно развитие инфекционного делирия.
На 8—10-й день болезни на коже появляется характерная экзантема. Она выявляется у 55—70 % заболевших брюшным тифом и локализуется преимущественно на коже живота и нижней части груди. Сыпь, как правило, скудная, число ее элементов редко превышает 6—8, по характеру розеолезная, мономорфная. Розеолы имеют вид розовых пятнышек округлой формы, с четкими контурами, диаметром около 3 мм. Нередко они слегка возвышаются над уровнем кожи (roseola ele-vata) и хорошо заметны на ее бледном фоне (рис. 3; см цв.
причем нередко перед нормализацией она начинает колебаться, приобретая амфиболический характер (различия между утренней и вечерней температурой достигают 2—2,5 °С). Прекращается головная боль, нормализуется сон, улучшается аппетит, увлажняется язык, с него исчезает налет, увеличивается диурез. Длительность периода разрешения болезни, как правило, не превышает I нед.
Период выздоровления. Восстанавливаются нарушенные функции организма и происходит освобождение его от возбудителей тифа. Для данного периода типичен астеновегетатив-ный синдром, который сохраняется 2—4 нед и зависит от тяжести перенесенного заболевания. Среди перенесших брюшной тиф 3—5 % пациентов становятся хроническими брюшнотифозными бактериовыделителями.
Рецидивы (в среднем у 7—9 % больных) чаще возникают на 2—3-й неделе нормальной температуры, но могут проявляться и в более поздние сроки (1—2 мес) независимо от формы и тяжести болезни. Они бывают однократными и многократными. Продолжительность лихорадки при рецидиве может колебаться от 1—3 дней до 2—3 нед. В предрецидивный период отмечается субфебрилитет, замедляется очищение языка от налета, сохраняются увеличенными печень и селезенка, в гемограмме отмечаются изменения, присущие периоду разгара болезни. Клинически рецидивы брюшного тифа сходны с первой волной заболевания и отличаются лишь более быстрым подъемом температуры, ранним появлением сыпи, меньшей длительностью лихорадки и обычно более легким течением.
При атипичных формах заболевания ряд характерных признаков брюшного тифа может отсутствовать. К атипичным относятся абортивная и стертая формы болезни.
Абортивная форма имеет много сходных черт с типичным течением болезни, но клиническая картина не достигает полного развития. Температура быстро (через 7—10 дней) и нередко критически снижается, исчезают другие симптомы интоксикации, наступает выздоровление.
При стертой форме («амбулаторный тиф», «легчайший тиф») интоксикация выражена незначительно. Температура субфебрильная, продолжительность ее не более 5—7 дней (иногда 2—3 дня). Экзантема возникает редко. Изменения внутренних органов выражены слабо. Больные, как правило, трудоспособны.
Крайне редко болезнь протекает с преобладанием симптомов поражения отдельных органов и систем: легких, мозговых оболочек, слепой кишки (так называемые пневмотиф, менин-готиф, колотиф).
Осложнения. При брюшном тифе осложнения могут быть условно разделены на специфические, обусловленные патогенным влиянием возбудителя и его токсина, а также неспецифические, вызванные сопутствующей микрофлорой.
Из специфических осложнений брюшного тифа наибольшее значение для исхода заболевания имеют кишечное кровотечение, перфоративный перитонит и инфекцион-но-токсический шок.
Кишечное кровотечение, возникающее у 1—2 % больных, ухудшает прогноз и чаще наблюдается на 3-й неделе болезни, иногда после снижения температуры. Причиной его является аррозия сосуда (вены или артерии) в дне брюшнотифозной язвы. Кровотечение может также носить диффузный, капиллярный характер. В механизме его развития имеют значение снижение свертываемости крови и замедление тромбообразо-вания. В зависимости от скорости эвакуации содержимого кишечника и массивности кровотечения стул больных становится дегтеобразным (мелена), содержит сгустки крови или свежую кровь.
Небольшие кровотечения обычно не влияют на состояние больного. Они обнаруживаются при осмотре стула или с помощью реакции Грегерсена спустя много часов после начала. При массивных кровотечениях температура тела внезапно снижается до нормальной или субнормальной, возникает жажда, пульс учащается, артериальное давление понижается. Небольшое кровотечение при своевременном лечении заканчивается благополучно. Массивное кровотечение может привести к развитию геморрагического шока, что всегда имеет серьезный прогноз.
Перфоративный перитонит как следствие прободения язвы кишечника — опасное осложнение брюшного тифа. Он развивается на 2—4-й неделе болезни иногда после нормализации температуры. Встречается у 0,5—1,5 % больных и может наблюдаться не только при тяжелом, но иногда и при легком течении болезни. Наиболее часто прободение язвы происходит в подвздошной кишке на расстоянии 25—30 см от места перехода ее в слепую кишку. Перфорации способствуют метеоризм, усиленная перистальтика, резкие движения, сильный кашель, грубая пальпация живота, нарушение диеты.
Клиническая картина брюшнотифозного перфоративного перитонита имеет ряд особенностей, что необходимо учитывать при диагностике. Наличие status typhosus может маскировать симптомы перфорации. Основной симптом прободения — внезапная резкая боль — нередко отсутствует, поэтому появление даже небольших болей в животе должно привлечь внимание врача. Другой ведущий симптом развивающегося перитонита — сокращение мышц брюшной стенки —у больных с помрачением сознания может быть единственным. Не постоянным, но важным признаком перфорации является положительный симптом Щеткина—Блюмберга. Перфорация кишки иногда сопровождается тяжелым коллапсом. Спустя несколько часов после перфорации развивается выраженная картина перитонита. Появляется fades hyppocratica, присоединяются рвота, упорная икота, вздутие и сильная разлитая болезненность живота. Печеночная тупость исчезает. Однако эти симптомы развиваются слишком поздно. Больного можно спасти, если оперативное вмешательство будет произведено в первые 6 ч после перфорации. При более поздней операции прогноз почти безнадежный.
Инфекционно-токсический шок развивается, как правило, в период разгара болезни и встречается у 0,5—0,7 % больных. Возникновение его обусловлено массивным поступлением в кровь брюшнотифозных бактерий и их токсинов. В клинической картине болезни инфекционно-токсическому шоку предшествуют симптомы гипертермии и неиротоксикоза. При его развитии наблюдаются резкое снижение температуры тела, повышенное потоотделение, тахикардия, тахипноэ, падение артериального давления, олигурия, в дальнейшем анурия.
К числу неспецифических осложнений относятся пневмония, тромбофлебиты, менингиты, пиелиты, паротиты, стоматиты и др.
Прогноз. При неосложненном течении брюшного тифа прогноз благоприятный. При развитии осложнений он хуже и может быть неблагоприятным (особенно при перфоративном перитоните). Летальность составляет 0,1—0,3 %.
Клиническая характеристика паратифов. По эпидемиологии, патогенезу, морфологии и клинической картине паратифы А и В в основном сходны с брюшным тифом, но имеют некоторые особенности.
Инкубационный период при паратифе А короче, чем при брюшном тифе, длительность его 8—10 дней. Начало чаще острое, иногда сопровождается насморком, кашлем. При осмотре выявляются гиперемия лица, инъекция сосудов склер, герпес на губах. Температурная кривая имеет неправильный характер, чаще волнообразный или ремиттирующий. Лихорадка нередко сопровождается ознобом, а затем обильным потом. Сыпь при паратифе А появляется в более ранние сроки (4—7-й день болезни), отличается полиморфизмом; часты дополнительные высыпания. Сыпь может быть розео-лезной, кореподобной и петехиальной. Интоксикация, как правило, выражена умеренно, отсутствует характерный тифозный статус. В гемограмме отмечается нормоцитоз, но может быть лейкоцитоз с лимфомоноцитозом.
У большинства больных заболевание протекает в форме средней тяжести, но могут наблюдаться и тяжелые формы с осложнениями в виде кишечного кровотечения, перфорации кишки, бронхопневмонии и др. Рецидивы при паратифе А встречаются довольно часто.
Инкубационный период при паратифе В составляет 5— 10 дней, но может быть и более продолжительным. Заболевание часто начинается остро, сопровождается выраженным ознобом, болями в мышцах и потливостью. В начальный период болезни явления интоксикации могут сочетаться с симптомами острого гастроэнтерита. Температурная реакция короткая, часто волнообразного характера. Тифозное состояние у большинства больных отсутствует, симптомы интоксикации, наблюдаемые в начальный период (3—5 дней), быстро исчезают. Сыпь появляется в ранние сроки, имеет полиморфный характер, часто бывает обильной. В некоторых случаях течение паратифа В может быть тяжелым с септическими проявлениями в виде гнойного менингита, менингоэнцефалита, септикопие-мии. В гемограмме наблюдается нейтрофильный лейкоцитоз. Клиническое течение тифо-паратифозных инфекций может значительно варьировать в зависимости от характера эпидемической вспышки, возраста больных, сопутствующих заболеваний и предшествующих вакцинаций. Обычно заболевание длится 3—4 нед, но может быть и более коротким (5—7 дней). Повторные рецидивы и осложнения удлиняют течение болезни иногда до нескольких месяцев.
Диагностика. При брюшном тифе и паратифах наиболее важна диагностика в первые 5—7 дней болезни (схема 1). Это связано с эпидемиологическими требованиями, обусловленными высокой контагиозностыо больного в последующие дни болезни, а также диктуется клинико-патогенетическими особенностями заболевания.
В распознавании тифо-паратифозных заболеваний большое значение имеют как клинико-эпидемиологические, так и лабораторные данные. В лабораторной диагностике используют бактериологический и серологический методы исследования, которые проводят с учетом периода инфекционного процесса.
На 1—2-й неделе заболевания возбудителя закономерно выделяют из крови, со 2—3-й недели — из испражнении и мочи, в течение всего заболевания — из дуоденального содержимого (в острый период болезни дуоденальное зондирование противопоказано, выделение биликультуры осуществляют в периоде реконвалесценции). Можно выделить возбудителя при посеве соскоба розеол, костного мозга, гноя, экссудатов, мокроты.
Обнаружение бактерий в крови всегда является показателем острого заболевания, признаком, абсолютно подтверждающим диагноз брюшного тифа. Присутствие возбудителя в фекалиях может быть результатом заболевания или бактерионосительства. В этих случаях при наличии клинических признаков вопрос решается в пользу острого заболевания брюшным тифом, при их отсутствии — в пользу бактерионосительства.
Схема 1. Ранняя (в первые 7 дней болезни) диагностика брюшного тифа
Наиболее диагностически значимые признаки:
Инфекция?
-
Лихорадка (5 дней и более)
-
Головная боль
-
Нарушение сна
4. Гепатоспленомегалия-
Г
Дифференциальная диагностика с различными видами сепсиса и другими инфекционными и неинфекционными заболеваниями
Генерализованная инфекция?
Решение вопроса о ее принадлежности к одной из 4 групп инфекционных заболеваний: кишечные, дыхательных путей, кровяные, наружных покровов
Генерализованная ♦кишечная инфекция
5. Ощущение дискомфорта в животе, энтери-тический синдром, характерный вид языка, болезненность и урчание в илеоцекальной области, положительный симптом Падалки и «перекрестный» симптом Штернберга
Вспомогательные диагностические признаки:
-
Эпидемиологический анамнез, детализированный по 3 путям передачи (водному, пищевому, контактно-бытовому) на протяжении 3 нед, предшествовавших началу заболевания
-
Микросимптомы болезни (признаки ваготонии)
-
Изменения гемограммы (после 5-го дня болезни тенденция к лейкопении, относительному лимфоцитозу, анэозинофилии, тромбо-цитопении)
Тифо-паратифозное заболевание
Решающий диагностический признак:
Выделение гемокультуры возбудителя (посев крови на желчь или среду Раппопорт)
Брюшной тиф
Посев крови для выделения гемокультуры можно осуществлять с 1-го дня болезни и на протяжении всего лихорадочного периода. Из вены берут стерильно 5—10 мл крови и засевают во флакон с 50—100 мл 10—20 % желчного бульона или среду Раппопорт. При посеве крови на питательную среду необходимо сохранять соотношение между кровью и средой 1 : 10, при меньшем объеме питательной среды кровь может оказать бактерицидное действие на микроорганизм-возбудитель.
Для получения миелокультуры можно использовать костный мозг, полученный при пункции. При выделении из крови и костного мозга L-форм бактерий применяются специальные пенициллино-сывороточные среды. Для получения копро-, били- и уринокультур используется среда Плоскирева.
Специфический антиген в крови, костном мозге и других исследуемых материалах выявляется также иммунофлюорес-центным и иммуноферментным методами. Эти методы высокочувствительны и могут быть использованы для экспрессной диагностики при эпидемических вспышках брюшного тифа.
Для серологической диагностики брюшного тифа и паратифов А и В с 5—7-го дня заболевания используется преимущественно РИГА с эритроцитарными диагностикумами (О-, Н-, Vi-антигены). Положительной считается реакция в титре 1:200 и выше. При исследовании в РИГА парных сывороток, взятых в динамике заболевания, диагностически значимым считается четырехкратное и большее нарастание титра антител к возбудителям брюшного тифа и паратифов. Для выявления бактерионосителей используют РИГА с Vi-антигеном. Широко применявшаяся в прошлом реакция Видаля утратила диагностическое значение.
Дифференциальная диагностика. Дифференцировать тифо-паратифозные заболевания приходится от гриппа, сыпного тифа, малярии, бруцеллеза, листериоза, пневмонии, сепсиса, туберкулеза, лимфогранулематоза.
Лечение. Течение и исход брюшного тифа зависят от правильного ухода, диеты и своевременного назначения антибактериальных и патогенетических средств. Лечение больных ти-фо-паратифозными заболеваниями осуществляют в условиях инфекционного стационара.
Больному необходимо обеспечить покой, удобную постель, хорошие гигиенические условия. Немаловажное значение имеет уход за полостью рта и кожей. Постельный режим необходимо соблюдать до 6—7-го дня нормальной температуры. С 7—8-го дня разрешается сидеть, а с 10—11-го дня нормальной температуры при отсутствии противопоказаний разрешается ходить.
В лихорадочный период и в течение первых 7—8 дней нормальной температуры диета больных должна быть максимально механически и химически щадящей в отношении кишечника, способствовать уменьшению бродильных и гнилостных процессов и в то же время быть достаточно калорийной. Этим требованиям соответствуют диеты № 4 и 46. С выздоровлением диету постепенно расширяют (№ 4в, № 2).
Важное значение в лечении больных брюшным тифом имеет адекватная с точки зрения выбора препаратов и продолжительности их применения антибактериальная терапия. Анти-биотикотерапия осуществляется по особой схеме — в течение всего лихорадочного периода и первых 10 дней после нормализации температуры. Если в течение 4—5 дней после начала этиотропной терапии не наблюдается отчетливого клинического эффекта, то необходимо произвести смену антибиотиков.
Длительное время наиболее эффективным антибиотиком при тифо-паратифозных заболеваниях был левомицетин (2 г/ сут), антибиотиком резерва считался ампициллин. Однако в настоящее время циркулирующие во многих регионах штаммы возбудителя брюшного тифа резистентны к этим препаратам. При устойчивости возбудителя к антибиотикам применяли бактрим (бисептол) или нитрофурановые препараты, однако полирезистентность возбудителей тифо-паратифозных заболеваний к многим антимикробным средствам становится важной проблемой практического здравоохранения. Для лечения больных в настоящее время с успехом используют фтор-хинолоны (ципрофлоксацин 500—750 мг —2—3 таблетки 2 раза в день после еды, при тяжелой форме препарат вводят внутривенно по 200—400 мг 2 раза в день), цефалоспорины третьего поколения. Применение антибиотиков не всегда предупреждает рецидивы болезни и формирование хронического бактерионосительства. В случае рецидивов антибиотики назначают повторно в тех же дозах. При хроническом бактерионосительстве антибактериальные препараты не оказывают положительного действия.
С целью повышения эффективности этиотропной терапии, предупреждения рецидивов и формирования бактерионосительства она должна сочетаться со средствами, повышающими специфическую и неспецифическую реактивность организма. Для повышения неспецифической резистентности организма, кроме полноценной диеты и витаминов, используют нестероидные анаболики (метилурацил, или метацил, оротат калия).
Для дезинтоксикации организма внутривенно назначают раствор Рингера, 5 % раствор глюкозы, гемодез, реополиглю-кин. Положительное действие оказывают также глюкокорти-костероиды, которые применяют только в тяжелых случаях болезни.
При кишечных кровотечениях необходим строгий постельный режим в положении на спине в течение 12—24 ч. Назначают холод на живот, запрещают прием пищи на 10—12 ч, а объем выпиваемой больным жидкости сокращают до 500 мл. В дальнейшем можно назначать небольшими порциями слизистые отвары, соки, желе, кисели, мясной или рыбный бульон. Со 2-го дня диету постепенно расширяют. При небольшом кровотечении используют кальция хлорид, витамины С и
К, гипертонический раствор натрия хлорида (5—10 мл в вену), желатиноль, плазму и другие препараты крови. При борьбе с массивным кровотечением в инфузионной терапии с заместительной целью используют переливание крови, полиионные растворы («Трисоль», «Ацесоль», «Лактасоль», «Квартасоль» и др.), коллоидные растворы (полиглюкин, реополиглюкин, желатиноль и др.).
При перфорации стенки кишки показано срочное оперативное вмешательство.
В терапии инфекционно-токсического шока используют методику управляемой гемодилюции с введением реологически активных и комплексообразующих препаратов (коллоидов) — гемодеза, реополиглюкина, желатиноля, кристаллоидных полиионных растворов в сочетании с введением вазоак-тивных препаратов (например, дофамин или допамин), массивных доз глюкокортикостероидов. С целью повышения ан-тиагрегационного эффекта кристаллоидных растворов к ним добавляют ингибиторы протеолиза — контрикал (трасилол), в некоторых случаях используют активаторы спонтанного фиб-ринолиза (соли магния, никотиновая кислота).
Профилактика. Мероприятия по борьбе с тифо-паратифозными заболеваниями должны быть направлены на обезвреживание источников инфекции, пресечение путей передачи, повышение невосприимчивости организма.
Большое значение в профилактике брюшного тифа имеют ранняя диагностика, своевременная изоляция и провизорная госпитализация больного, эффективная терапия с полным освобождением организма от возбудителя.
В период выздоровления с интервалами в 5 дней проводят трехкратное контрольное бактериологическое исследование кала и мочи и однократное исследование желчи. При обнаружении возбудителя в кале, моче или желчи реконвалесцента подвергают интенсивному лечению в стационаре с учетом сопутствующей патологии и реактивности организма.
Выписка бактериовыделителя возможна только с разрешения эпидемиолога. После выписки все реконвалесценты подлежат диспансерному наблюдению с систематическим обследованием для своевременного выявления рецидива болезни и формирования хронического бактерионосительства. Продолжительность и интенсивность лабораторного обследования переболевших зависят от их профессиональной принадлежности. Переболевшие состоят на учете в центре санитарно-эпидемиологического надзора в течение 2 лет, а лица, работающие на пищевых предприятиях,— 6 лет.
С целью пресечения распространения возбудителя в очаге осуществляют текущую дезинфекцию до госпитализации больного или бактериовыделителя. После госпитализации в очаге проводят заключительную дезинфекцию.
За лицами, контактировавшими с больными, устанавливается медицинское наблюдение в течение 21 дня с ежедневной термометрией. Проводится однократное, а по показаниям двукратное бактериологическое исследование кала и мочи. У ранее переболевших брюшным тифом, а также у лиц, страдающих заболеваниями печени и желчевыводящих путей, производится посев дуоденального содержимого и исследование крови в РИГА с эритроцитарным Vi-антигеном. Специфическая профилактика в очаге включает назначение бактериофага всем контактным.
Специфическую вакцинопрофилактику брюшного тифа проводят по эпидемическим показаниям. На территориях, неблагополучных по брюшному тифу, вакцинацию осуществляют всему населению, начиная с детей 7-летнего возраста. Специфическая профилактика показана также лицам, относящимся к группам риска: работникам очистных сооружений, сотрудникам инфекционных больниц и бактериологических лабораторий. Вакцинацию проводят и лицам, выезжающим в страны Африки и Азии с высоким уровнем заболеваемости брюшным тифом. В России для активной иммунизации против брюшного тифа используют инактивированные вакцины: вакцину брюшнотифозную спиртовую сухую; вакцину брюшнотифозную спиртовую, обогащенную Vi-антигеном; вакцину брюшнотифозную Vi-полисахаридную жидкую. В ответ на введение вакцин иммунитет развивается через 1—2 нед, невосприимчивость к инфекции сохраняется в течение 2 лет.
За рубежом используют также живую брюшнотифозную вакцину. Ожидается создание конъюгированной вакцины против брюшного тифа, которая была бы пригодна для введения в том числе и у детей первых 2 лет жизни.
ДИЗЕНТЕРИЯ
Син. — шигеллез
Дизентерия (Dysenteria) — инфекционное заболевание, вызываемое шигеллами, протекающее с явлениями интоксикации и преимущественным поражением дистального отдела толстой кишки.
Исторические сведения. Термин «дизентерия» введен еще в эпоху Гиппократа, который разделил все кишечные заболевания на две группы: диарею, характеризующуюся поносом, и дизентерию, отличающуюся главным образом болями в животе (греч. dys — нарушение, расстройство, enteron — кишка). Первое подробное описание болезни под названием «натужный понос» дал греческий эскулап Аретей (I в. до н.э.). Заболевания, сходные по клинической картине с дизентерией, нашли отражение в трудах Авиценны (X—XI вв.).
В древнерусской письменности есть описание этой болезни под названием «утроба кровавая, или мыт».
Дизентерия в прошлом была широко распространена, носила эпидемический характер. Описаны пандемии дизентерии в XVIII в. (1719 и 1789 гг.) и XIX в. (1834—1836 гг.). Самые большие эпидемии наблюдались в периоды войн, стихийных бедствий и т. д.
Впервые возбудители дизентерии были описаны во второй половине XIX в. [Раевский А. С, 1875; Шантемесс Д., Видаль Ф., 1888; Кубасов П. И., 1889J. В 1891 г. армейский врач А. В. Григорьев выделил грамотрицательные бактерии из органов умерших от дизентерии, изучил их морфологию и патогенные свойства в опытах на кроликах, морских свинках и котятах. В 1898 г. японский ученый К. Шига о том же возбудителе дизентерии сообщил некоторые новые данные.
В дальнейшем были открыты другие представители обширной группы дизентерийных бактерий, близкие по своим морфологическим свойствам, но отличающиеся по ферментативной активности и антигенной структуре.
Этиология. Возбудители относятся к роду Shigella, семейству Еп-terobacteriaceae. Различают 4 вида шигелл: 1) Sh. dysenteria, к ним относятся бактерии Григорьева—Шиги, Штутцера—Шмитца и Лард-жа—Сакса; 2) Sh. flexneri; 3) Sh. boydii; 4) Sh. sonnei.
В настоящее время насчитывается свыше 50 серологических разновидностей дизентерийных бактерий.
Первые три вида подразделяются на серологические варианты. Штаммы шигелл Зонне имеют совпадающую антигенную структуру, но подразделяются на разные ферментативные типы.
Морфологически все шигеллы сходны между собой, имеют вид палочек размером (0,3—0,6) х (1,0—3,0) мкм с закругленными концами. Они неподвижны, спор и капсул не образуют, грамотрицатель-ны, хорошо растут на простых питательных средах.
Шигеллы содержат термостабильный соматический О-антиген. При их разрушении выделяется эндотоксин, с которым во многом связано развитие интоксикационного синдрома. Шигеллы способны продуцировать экзотоксины. Среди них энтеротоксины (термолабильный и термостабильный), усиливающие секрецию жидкости и солей в просвет кишки, и цитотоксин, повреждающий мембраны эпителиальных клеток. Бактерии Григорьева—Шиги, кроме того, продуцируют сильнодействующий нейротоксин.
Вирулентность шигелл определяется тремя основными факторами: способностью к адгезии к мембранам эпителиальных клеток, инвазии в них и продукции токсинов.
Разные виды шигелл характеризуются неодинаковой патогенно-стью. Она исключительно высока у шигелл Григорьева—Шиги. Патогенность других видов дизентерийных бактерий значительно ниже.
В зависимости от температуры, влажности, рН среды, вида и количества микроорганизмов длительность выживания дизентерийных бактерий колеблется от нескольких дней до месяцев. Благоприятной средой для бактерий являются пищевые продукты. Шигеллы Зонне в молоке и молочных продуктах способны не только длительно существовать, но и размножаться.
Возбудители шигеллеза хорошо переносят высушивание и низкие температуры, но быстро погибают под действием прямых солнечных лучей и нагревания (при 60 °С — через 30 мин, при 100 "С — почти мгновенно). Дезинфицирующие средства (гипохлориты, хлорамины, лизол и др.) в обычных концентрациях убивают дизентерийные бактерии в течение нескольких минут.
С начала XX в. отмечается закономерная эволюция этиологической структуры дизентерии. Если до середины 30-х годов наибольший удельный вес имела дизентерия Григорьева—Шиги (50—80 %), то с 40-х годов преобладающей стала дизентерия Флекснера, удельный вес которой в Европе составлял 60—80 %. С 60-х годов доминирующее положение в Европе и на территории бывшего Советского Союза занимала дизентерия Зонне, хотя в ряде районов по-прежнему преобладал вид Флекснера.
В странах Африки и в большинстве стран Азии и Латинской Америки основное место занимает дизентерия Флекснера. В некоторых странах Центральной Америки, Юго-Восточной Азии и Африки регистрируется дизентерия, вызываемая бактериями Григорьева—Шиги. Случаи этого заболевания имели место в Узбекистане в середине и в конце 80-х годов XX в. Начиная с 1990 г. на территории России, в том числе в регионах, где в течение последних 30 лет господствовала дизентерия, вызванная шигеллами Зонне, существенно нарастает заболеваемость шигеллезом Флекснера.
Эпидемиология. Источником инфекции являются больные острой или хронической дизентерией, реконвалесценты и лица с субклинической формой инфекционного процесса (бактериовыделители). Наибольшую эпидемиологическую опасность представляют больные острой дизентерией, выделяющие в период разгара болезни в окружающую среду огромное количество возбудителей.
Шигеллез — инфекция с фекально-оральным механизмом передачи возбудителей, реализация которого осуществляется пишевым, водным и контактно-бытовым путями. Факторами передачи шигелл являются пищевые продукты, вода, руки и предметы обихода, мухи, почва.
Главным путем передачи при шигеллезе Григорьева—Шиги является контактно-бытовой, Флекснера — водный, Зонне — пищевой (особенно молочный). Основными причинами неравнозначности путей распространения при различных этиологических формах дизентерии являются существенные различия в патогенности и инфицирующей дозе возбудителей, а также их устойчивость во внешней среде.
Восприимчивость к шигеллезу неодинакова у людей разных возрастных групп. Ведущей возрастной группой среди больных дизентерией являются дети дошкольного возраста (более '/з всех случаев этой кишечной инфекции регистрируется у детей в возрасте до 6 лет).
Дизентерию, как и другие острые кишечные заболевания, характеризует выраженная осенне-летняя сезонность. Число заболеваний, регистрируемых в июле—сентябре, составляет, как правило, половину всей суммы заболеваний за год.
Постинфекционный иммунитет непродолжителен и носит видо- и типоспецифический характер в пределах года.
Патогенез и патологоанатомическая картина. Поступление шигелл в организм сопровождается гибелью части бактерий в желудке и кишечнике вследствие воздействия желудочного и других пищеварительных соков, секреторных иммуноглобулинов, антагонистического влияния кишечной микрофлоры.
Часть бактерий, обладающих способностью к инвазии, преодолев все барьеры, проникает в цитоплазму энтероцитов. Некоторые шигеллы достигают собственного слоя слизистой оболочки. Однако большинство микроорганизмов фагоцитируются нейтрофилами и макрофагами на уровне базальной мембраны.
Жизнедеятельность шигелл в тонкой кишке сопровождается продукцией энтеро- и цитотоксинов, а их разрушение — выделением эндотоксинов. Симптомы интоксикации, а также боли в мезогастрии, возникающие в начальный период болезни, во многом обусловлены действием эндотоксина, пироген-ных субстанций и биогенных аминов. Эти вещества выделяются при разрушении части фагоцитов, инфицированных шигеллами. Повышение секреции жидкостей и солей в просвет тонкой кишки определяет развитие диарейного синдрома. Стул в этот период заболевания обильный, содержит большое количество жидкости.
Параллельно с этими процессами происходит инвазия шигелл в эпителиальные клетки толстой кишки с последующим развитием типичной для дизентерии симптоматики колита.
Преимущественное поражение дистальных отделов толстой кишки может быть обусловлено сравнительно продолжительным скоплением в ней кишечного содержимого, токсинов и бактерий, создающих благоприятные условия для массивной инвазии возбудителя в колоноциты. Этому способствует и дисбактериоз кишечника.
При инвазии шигеллами слизистой оболочки толстой кишки эпителиоциты поражаются неравномерно, при этом уменьшается количество бокаловидных клеток, отторгаются эпителиальные клетки, что ведет к появлению поверхностных микроэрозий. Тяжелое течение заболевания может сопровождаться выраженной инфильтрацией слизистой оболочки кишки нейтрофилами и развитием вторичных абсцессов в криптах.
В большинстве случаев шигеллеза основная часть бактерий задерживается фагоцитирующими клетками на уровне базальной мембраны. Лишь при тяжелых формах заболевания возбудители могут в значительном количестве распространяться в подслизистую основу и брыжеечные лимфатические узлы. Возникающая иногда в этих случаях кратковременная бактериемия не имеет патогенетического значения и не меняет представление о дизентерии как о «локализованной инфекции». Основное значение в патогенезе дизентерии имеют токсины бактерий. Шигеллы, находящиеся в слизистой оболочке внеклеточно, подвергаются фагоцитозу нейтрофилами и макрофагами с образованием токсичных веществ, оказывающих на организм системное и местное воздействие.
Действие токсинов шигелл в организме больного человека неоднозначно. Экзотоксин бактерии Григорьева—Шиги и белковая часть эндотоксина обладают выраженным нейроток-сическим действием. Всасываясь в кровь, нейротоксины повреждают различные ткани и органы, в первую очередь центральную нервную систему, периферические ганглии вегетативной нервной системы и симпатико-адреналовую систему. Клинически это проявляется синдромом интоксикации и нарушением всех видов обмена.
Липополисахаридная часть эндотоксина и цитотоксина обладает выраженным энтеротропизмом и поражает слизистую оболочку толстой кишки. Энтеротоксины, активируя аденил-циклазу, способствуют накоплению жидкости и электролитов в кишечном содержимом.
Возбудитель и его токсины при повреждении ими фагоцитов и клеток слизистой оболочки способствуют выходу биологически активных веществ (гистамин, серотонин, кинины, простагландины), которые нарушают микроциркуляцию в кишечной стенке, повышают интенсивность воспалительного процесса и расстройств функций кишечника (моторики, секреции, всасывания).
Нарушение иннервации кишечника, воспалительные изменения его слизистой оболочки клинически проявляются резкими спастическими болями в животе. Спазмы и неравномерные сокращения отдельных сегментов кишки приводят к задержке содержимого кишечника в верхних его отделах. Этим объясняется выделение в типичных и тяжелых случаях дизентерии скудного бескалового содержимого, состоящего из воспалительного экссудата. Судорожное сокращение мышц сигмовидной и прямой кишки обусловливает болезненные ложные позывы к дефекации и тенезмы (ощущение жжения или саднения в заднем проходе и как бы незаконченного акта дефекации).
В период разгара болезни достигает максимального развития местный патологический процесс, продолжается воздействие токсинов, нарастает кишечный дисбактериоз.
При тяжелом течении дизентерии, особенно у детей, возникают явления токсикоза и эксикоза с развитием острой сосудистой недостаточности с возможным смертельным исходом заболевания.
Параллельно с повреждающими факторами включаются адаптационные и компенсаторные механизмы, обеспечивающие саногенез и ведущие к преодолению инфекции. В зависимости от напряженности патогенетических и саногенетиче-ских механизмов дизентерийный процесс может протекать в субклинической, стертой и клинически выраженной формах.
Характер и тяжесть течения шигеллеза определяются и видом возбудителя. Наиболее тяжелым течением с ярко выраженным симптомокомплексом нейротоксикоза и колитиче-ского синдрома отличается дизентерия, обусловленная шигеллами Григорьева—Шиги и Флекснера. Шигеллы Зонне могут вызывать гастроэнтерит, имеющий много общих клинических черт с токсикоинфекциями.
В некоторых случаях болезнь принимает затяжное и хроническое течение. Этому способствуют иммунодефицитные состояния, обусловленные сопутствующими заболеваниями, неблагоприятным преморбидным фоном и др.
Патологоанатомические изменения при шигеллезе наиболее выражены в дистальном отделе толстой кишки. При шигеллезе наблюдаются четыре стадии поражения кишечника:
-
острое катаральное воспаление;
-
фибринозно-некротическое воспаление (рис. 4; см. цв. вклейку);
-
стадия образования язв;
-
заживление язв.
Катаральное воспаление характеризуется отеком, гиперемией слизистой оболочки и подслизистой основы толстой кишки; нередко имеют место мелкие кровоизлияния и эрозии. На поверхности слизистой оболочки и в просвете кишки обнаруживается слизистый или слизисто-геморрагический экссудат.
При микроскопическом исследовании отмечаются сосудистые расстройства — усиление проницаемости капилляров стромы, очаговые или обширные геморрагии. Отек стромы и базальной мембраны приводит к дистрофическим изменениям эпителия, а в тяжелых случаях — к образованию эрозий и язв. Характерна гиперпродукция слизи и в различной степени выраженная лимфоцитарно-плазматическая инфильтрация стромы. При резко выраженном катаральном воспалительном процессе строма может быть инфильтрирована нейтрофилами.
Фибринозно-некротические изменения проявляются в виде грязно-серых плотных налетов на слизистой оболочке кишечника. Некроз может достигать подслизистой основы и мышечного слоя стенки кишки. Под слизистая основа утолщена, инфильтрирована нейтрофильными лейкоцитами и лимфоцитами. Гнойное расплавление и отторжение некротических масс приводят к образованию язв. Язвы при дизентерии чаще поверхностные с плотными краями.
Регенерация эпителия при остром катаральном воспалении начинается рано, на 2—3-й день болезни, однако полное морфологическое и функциональное восстановление даже при легких и стертых формах дизентерии наступает, как правило, не раньше 4—5-й недели. При деструктивных изменениях регенерация происходит медленно. Длительно сохраняются воспалительные явления и сосудистые расстройства.
Морфологические изменения при хроническом шигеллезе характеризуются вялым течением воспалительного процесса с деформацией крипт и участками атрофических изменений слизистой оболочки кишки.
При аутопсии наряду с характерными поражениями кишечника обнаруживают дистрофические изменения клеток подслизистого (мейснерова) и межмышечного (ауэрбахова) сплетений, симпатических узлов, межпозвоночных ганглиев и т. д. В остальных органах и тканях выявляют различной степени дистрофические изменения.
Клиническая картина. Длительность инкубационного периода колеблется от 1 до 7 дней (чаще составляет 2—3 дня).
По течению выделяют острую и хроническую формы ши-геллеза. Острый шигеллез протекает в нескольких вариантах: колитический, гастроэнтероколитический и гастроэнтерити-ческий, каждый из которых может быть представлен в легкой, средней тяжести и тяжелой формах. Хроническая дизентерия имеет рецидивирующее или непрерывное течение и также может протекать в легкой, средней тяжести и тяжелой форме. Отдельно выделяют шигеллезное бактерионосительство (бактериовыделение), которое рассматривают как субклиническую форму инфекционного процесса.
Шигеллез характеризуется цикличностью течения. При этом в течении заболевания можно выделить 4 периода: начальный, разгара, угасания симптомов и выздоровления (остаточных явлений или перехода в хроническую форму).
В клинической картине политического варианта (типичный шигеллез) представлены два основных синдрома — интоксикационный и колитический, гастроэнтероколитический вариант сопровождается, кроме того, симптомами острого гастрита и энтерита. При гастроэнтеритическом варианте колитиче-ской симптоматики в клинической картине заболевания не наблюдается.
В большинстве случаев заболевание начинается остро. Больные жалуются на озноб и жар. Температура тела быстро повышается до максимальных цифр (38—40 °С), держится на этом уровне от нескольких часов до 2—5 дней и снижается обычно по типу ускоренного лизиса. Дизентерия может протекать с субфебрильной температурой, а иногда без ее повышения.
Нервная система поражается очень рано. У большинства больных с самого начала появляются слабость, разбитость, апатия, подавленность настроения, головная боль, которые достигают наивысшей степени на высоте подъема температуры тела.
Определяется лабильность пульса, иногда нарушение ритма сердечных сокращений, снижение артериального и венозного давления. Тоны сердца приглушены, может прослушиваться систолический шум на верхушке. В самых тяжелых случаях как проявление интоксикации может развиться инфекцион-но-токсический шок.
При типичном классическом течении шигеллеза ведущим является симптомокомплекс колита. Больные жалуются на режущие, схваткообразные боли в животе, локализованные в подвздошных областях, больше слева, интенсивность и длительность которых зависят от формы и тяжести болезни. Боли в животе обычно предшествуют каждой дефекации и наслаиваются на нее. Позывы чаще бесплодные, сопровождаются мучительными тянущими болями в области прямой кишки — тенезмами. При пальпации органов брюшной полости определяется спазмированная, тонически напряженная толстая кишка, в более легких случаях лишь ее дистальный отдел — сигмовидная кишка. Последняя пальпируется в виде плотного инфильтрированного, малоподвижного, резко болезненного шнура. Часто пальпация усиливает спазм мышц кишечника и провоцирует позывы к дефекации.
При манифестированных формах шигеллеза наблюдается учащение стула до 20—30 раз в сутки и более. Дефекация, как правило, не приносит облегчения. Несмотря на многократность стула при типичном колитическом варианте течения дизентерии количество каловых масс, выделяемых больными за сутки, невелико, редко превышает 0,5—1,0 л. В первые часы стул довольно обильный, каловый, полужидкий или жидкий, часто слизистый. При его учащении испражнения теряют каловый характер. Практически стул состоит из густой, прозрачной слизи, к которой в дальнейшем присоединяется примесь крови, а позже и гноя («ректальный», или «дизентерийный, плевок»). Испражнения могут приобрести вид мясных помоев, в которых взвешены «саговые» комочки слизи.
При шигеллезе нарушаются функции всех остальных отделов пищеварительного тракта. Угнетается слюноотделение, что обусловливает сухость во рту, изменяется секреция желудочного сока — у большинства больных определяется пониженная кислотность до ахлоргидрии, падает протеолитическая активность желудочного содержимого, извращается моторика желудка. Нарушаются функции тонкого отдела кишечника, его моторика, секреция, страдает мембранный гидролиз и резорбция. В тяжелых случаях появляются незначительная про-теинурия, микрогематурия, цилиндрурия.
Гематологические сдвиги в разгар болезни характеризуются небольшим повышением СОЭ, умеренным лейкоцитозом, сдвигом лейкоцитарной формулы влево, моноцитозом.
Длительность периода разгара болезни колеблется от 1—2 до 8—9 дней. При угасании симптомов болезни стихают проявления интоксикации и колита.
В период реконвалесценции происходит восстановление нарушенных функций органов и систем и освобождение организма от возбудителя. Однако, как показывают прижизненные морфологические исследования, анатомическое «выздоровление» задерживается и отстает от клинического на 2— 3 нед. Поздняя госпитализация, неадекватная терапия, неблагоприятный преморбидный фон могут привести к переходу болезни в хроническую форму и чаще к развитию так называемых постдизентерийных состояний. Они проявляются функциональными нарушениями секреции, резорбции и моторики желудочно-кишечного тракта, астенией. В зависимости от тяжести и характера течения дизентерийного процесса клиническая картина может быть различной.
Острый шигеллез. Колитический вариант с легким течением болезни характеризуется умеренно или слабовыражен-ной интоксикацией. Начинается обычно остро с кратковременным подъемом температуры до 37—38 °С. В первые часы болезни наблюдаются слабость, снижение аппетита, в дальнейшем появляются умеренные боли в животе. Стул от 3—5 до 10 раз в сутки. Испражнения полужидкие или жидкие, часто со слизью, а иногда и с прожилками крови. Больные остаются трудоспособными и часто прибегают к самолечению. При осмотре язык обложен. Сигмовидная кишка болезненная и спазмированная, при ее пальпации отмечается урчание. При ректороманоскопии можно обнаружить катаральный или ка-тарально-геморрагический проктосигмоидит и сфинктерит. Изменения в гемограмме незначительны. Заболевание продолжается 3—5, реже 7—8 дней и заканчивается выздоровлением.
Колитический вариант со средней тяжестью течения обычно начинается остро, с озноба, «ломоты» и разбитости во всем теле. Температура повышается до 38—39 °С и держится на этом уровне 3—5 дней, редко дольше. Часто наблюдаются анорексия, головная боль, тошнота, иногда рвота, резкие схваткообразные боли в животе, тенезмы. Частота стула 10— 20 раз в сутки. Испражнения быстро теряют каловый характер и состоят из слизи, окрашенной кровью. Они могут быть скудными, в виде «ректального плевка», или более обильными, слизистыми. Явления гемоколита наблюдаются у 70—75 % больных. Острые явления на 3—5-й день болезни постепенно ослабевают. В испражнениях уменьшается количество слизи и крови, нормализуется стул, но копрограмма остается патологической. При ректороманоскопии выявляется катарально-эрозивный проктосигмоидит. Клиническое выздоровление наступает к концу 2-й недели болезни.
Тяжелое течение колитического варианта шигеллеза характеризуется острым началом с подъемом температуры до 39 "С и выше, резко выраженной интоксикацией. Могут наблюдаться обморочные состояния, бред, тошнота, рвота. Боли в животе резко выражены и сопровождаются мучительными тенезма-ми и частыми позывами на мочеиспускание. Стул от 20—25 до 50 раз в сутки, скудный, бескаловый, слизисто-кровянистый. Иногда испражнения имеют вид мясных помоев. Больные вялые, адинамичные. Кожа и слизистые оболочки сухие, артериальное давление снижено, отмечается постоянная тахикардия. К концу 1—2-х суток может развиться коллаптоидное состояние. Тенезмы и спазмы кишечника могут сменяться его парезом, вздутием живота, зиянием ануса и непроизвольной дефекацией. В крови наблюдается лейкоцитоз или лейкопения со сдвигом лейкоцитарной формулы влево и токсической зернистостью в лейкоцитах. При пальпации живота обнаруживаются спазмированность, болезненность и урчание толстого отдела кишечника (или только сигмовидной кишки), метеоризм. Тяжелое состояние больных сохраняется в течение 7—10 дней. При ректороманоскопии в случае дизентерии Зонне определяются катарально-геморрагические, катарально-эрозивные, реже язвенные изменения слизистой оболочки (рис. 5; см. цв. вклейку). При тяжелом течении дизентерии Флекснера обнаруживают фибринозно-некротическое, фиб-ринозно-язвенное и флегмонозно-некротическое поражение слизистой оболочки толстой кишки. Заболевание длится 3—6 нед и более.
У лиц с иммунодефицитом различного происхождения может отсутствовать выраженная лихорадка, но поражение толстой кишки носит при этом тотальный характер.
Гастроэнтероколитический вариант шигеллеза протекает по типу пищевой токсикоинфекции с коротким инкубационным периодом, бурным началом болезни. Основным синдромом в начале заболевания является гастроэнтерит, который сопровождается выраженными симптомами интоксикации. В дальнейшем начинают доминировать симптомы энтероколита. Для начального периода типичны рвота, профузный понос, обильные водянистые испражнения без примеси крови и слизи, диффузные боли в животе. В последующем стул становится менее обильным, в нем обнаруживаются примеси слизи и крови. Этот вариант может иметь легкое, средней тяжести и тяжелое течение. При оценке тяжести течения болезни учитывают степень обезвоживания организма.
Гастроэнтеритический вариант близок по течению к начальному периоду гастроэнтероколитического варианта. Его отличие заключается в отсутствии симптомов колита в более поздний период заболевания (после 2—3-го дня болезни). Ведущими являются симптомы гастроэнтерита и признаки дегидратации.
Стертое течение шигеллеза встречается при всех вариантах болезни. Оно характеризуется незначительными болями в животе и кратковременным (в течение 1—2 дней) расстройством функции кишечника. Испражнения полужидкие, без крови и часто без слизи. Температура тела нормальная, но может быть субфебрильной. Нередко при пальпации определяется повышенная чувствительность сигмовидной кишки. В копрограм-ме количество лейкоцитов превышает 20 в поле зрения. При ректороманоскопии выявляется катаральный проктосигмоидит. Диагноз устанавливается после тщательного сбора анамнеза болезни, эпидемиологического анамнеза, а также своевременного лабораторного обследования.
Затяжное течение острого шигеллеза характеризуется сохранением клинических признаков заболевания на протяжении 1,5—3 мес. При этом у большинства больных отмечаются явления вялотекущего воспалительного процесса в кишечнике с отсутствием его функционально-морфологического восстановления в сроки до 3 мес.
Бактериовыделение. Принципиальной является трактовка бактериовыделения как формы шигеллезной инфекции с субклиническим течением. При этом отсутствуют интоксикация и дисфункция кишечника. Однако факт выделения шигелл, а также обследование с использованием всего комплекса современных методов диагностики подтверждают наличие инфекционного процесса.
Случаи, характеризующиеся отсутствием кишечной дисфункции в период обследования и в предшествовавшие ему 3 мес при наличии выделения шигелл с калом, относятся к субклиническому бактериовьщелению. Выделение шигелл после клинического выздоровления называется реконвалесцент-ным бактериовыделением.
Хронический шигеллез. Различают две формы хронического шигеллеза — рецидивирующую и непрерывную.
Рецидивирующая форма встречается значительно чаще непрерывной и характеризуется чередованием ремиссий и рецидивов дизентерии. Длительность каждого нового возврата болезни и светлых промежутков может быть различной. Преобладают симптомы поражения дистального отдела толстой кишки. Однако при системном обследовании больного хронической дизентерией можно выявить признаки вовлечения в патологический процесс желудка, тонкого отдела кишечника, поджелудочной железы, гепатобилиарной системы.
Клиническая картина рецидива сходна с картиной при легком или средней тяжести течении острой дизентерии. Дисфункция кишечника при этом отличается упорством и продолжительностью.
В большей или меньшей степени страдает центральная нервная система. Больные раздражительны, возбудимы, работоспособность их снижена, сон нарушен, часты головные боли. У некоторых из них выражены вегетативные нарушения (чаще встречаются симптомы ваготонии).
При ректороманоскопии обнаруживаются полиморфные изменения слизистой оболочки прямой и сигмовидной кишки. Во время обострения ректороманоскопическая картина напоминает изменения, характерные для острой дизентерии. Однако их интенсивность на различных участках неодинакова. Возможно чередование яркой гиперемии с более бледными участками слизистой оболочки, на которых отчетливо видна расширенная сосудистая сеть. Слизистая оболочка в этих местах истонченная, тусклая, легкоранимая.
В межрецидивный период состояние больных удовлетворительное. Работоспособность сохранена, но почти постоянно беспокоят тупые боли и ощущение распирания в животе, тяжесть в эпигастрии, запоры. При ректороманоскопии в период ремиссии видна бледная, атрофическая слизистая оболочка с выраженной сосудистой сетью.
При непрерывной форме хронического шигеллеза практически отсутствуют светлые промежутки, самочувствие больных постоянно плохое, состояние их ухудшается. Развиваются глубокие нарушения пищеварения, истощение, появляются признаки гиповитаминоза, анемия, присоединяется выраженный дисбактериоз. В настоящее время эта форма встречается редко, главным образом у лиц пожилого и старческого возраста, с тяжелой сопутствующей патологией.
Острая дизентерия сравнительно редко переходит в хроническую (при дизентерии Флекснера в 2—5 %, при дизентерии Зонне — в 1 % случаев).
Осложнения. К грозным, но сравнительно редким осложнениям заболевания относятся токсико-инфекционный и смешанный (у детей токсико-инфекционный + дегидратаци-онный) шоки. Они развиваются в период разгара заболевания и имеют серьезный прогноз. К осложнениям острой дизентерии относятся и ее рецидивы, которые наблюдаются в 5— 15 % случаев. У некоторых больных возникают обострения геморроя, трещины анального сфинктера. У ослабленных больных могут развиться осложнения, связанные с присоединением вторичной флоры: пневмонии, восходящая урогенитадьная инфекция, а также тяжелый дисбактериоз кишечника.
К более редким, но участившимся в последние годы осложнениям относятся прободение язв кишечника с последующим перитонитом, токсическая дилатация кишки, тромбоз мезентериальных сосудов. В отдельные эпидемии (в частности, в 90-е годы прошлого столетия) их частота возрастала до 15 % и более.
Прогноз. При шигеллезе прогноз зависит от возраста больного, тяжести заболевания, сопутствующей патологии, осложнений и своевременного лечения. В целом его можно оценить как благоприятный при дизентерии Зонне, более серьезным надо считать прогноз при дизентерии Флекснера и особенно Григорьева—Шиги.
Диагностика. В типичных случаях диагностика шигеллеза затруднений не вызывает, за исключением атипичного течения болезни. Диагноз устанавливается на основании данных эпидемиологического анамнеза, клинического течения дизентерии, инструментальных и лабораторных исследований.
Ведущим остается бактериологическое исследование. Однако высеваемость возбудителей варьирует от 22 до 80 % и в значительной степени зависит от метода, срока и кратности забора материала, выбора среды и др. Наряду с бактериологическими исследованиями для диагностики дизентерии используется серологический метод — реакция непрямой гемагглютинации с эритроцитарным диагностикумом (РНГА). Положительные ответы РНГА могут быть получены с 5-го дня болезни. На 2-й неделе титры антител нарастают, а с 4—5-й недели наблюдается тенденция к их снижению. Минимальный диагностический титр антител в РНГА 1:200.
В качестве экспресс-диагностики эпидемических вспышек дизентерии используются метод флюоресцирующих антител (МФА), РНГА с иммуноглобулиновыми (антительными) диаг-ностикумами, иммуноферментный анализ (ИФА) и др. В последние годы разработаны серологические методы обнаружения антигенов шигелл, дополняющие, но не заменяющие бактериологическую диагностику шигеллезов.
Простым, повсеместно доступным вспомогательным методом диагностики дизентерии является копрологическое исследование. При копроцитоскопии испражнений больного дизентерией с большим постоянством обнаруживаются слизь, скопление лейкоцитов с преобладанием нейтрофилов (более 30—50 в поле зрения), эритроциты и различное количество измененных эпителиальных клеток.
Ректороманоскопия остается ценным методом, расширяющим диагностические возможности врача и позволяющим следить за ходом выздоровления.
Дифференциальная диагностика. Шигеллез необходимо дифференцировать от сальмонеллеза, эшерихиоза, пищевых токсикоинфекций, холеры, амебиаза, балантидиаза, лямблио-за, трихомониаза кишечника, некоторых гельминтозов, кан-дидоза. Сходные с дизентерией симптомы могут наблюдаться при отравлении грибами и солями тяжелых металлов, уремическом колите, туберкулезе кишечника, хроническом энтероколите, неспецифическом язвенном колите. Нередко возникает необходимость дифференцировать дизентерию от острых хирургических заболеваний (острый аппендицит, тромбоз мезентериальных сосудов, непроходимость кишечника) и острой гинекологической патологии (внематочная беременность, аднексит, пельвиоперитонит). Хорошо собранный анамнез заболевания, эпидемиологический анамнез и тщательное клинико-лабораторное обследование больного позволяют правильно и своевременно распознать дизентерию.
Лечение острого шигеллеза. Основными принципами терапии больных шигеллезом остаются возможно раннее начало лечения, индивидуальный подход к лечебным мероприятиям у каждого больного, комплексность терапии.
Больных шигеллезом можно лечить как на дому, так и в стационаре. Вопрос о госпитализации решается на основании клинико-эпидемиологических данных. Госпитализации подлежат больные со средней тяжести и тяжелым течением дизентерии, лица с тяжелыми сопутствующими заболеваниями, а также больные, представляющие повышенную эпидемиологическую опасность (пищевики и приравненные к ним кон-тингенты).
Принцип комплексности терапии больных шигеллезом включает лечебно-охранительный режим, диету, этиотропную, патогенетическую и иммунорегулирующую терапию
Лечебно-охранительный режим предполагает уменьшение воздействия раздражителей, постельное или полупостельное содержание больных, удлиненный физиологический сон.
Питание больным шигеллезом назначают в зависимости от периода болезни и степени выраженности поражения кишечника. Вначале применяется диета № 4 (или № 46), которая обеспечивает химическое и механическое щажение желудочно-кишечного тракта. После нормализации стула показана диета № 4в с последующим переводом на диету N° 2.
Из этиотропных средств при лечении больных легкой формой шигеллеза наилучший эффект дают препараты нитрофу-ранового ряда. Фуразолидон (фуразолин, фурадонин, фура-гин, эрсефурил) назначают по 0,1—0,15 г 4 раза в сутки после еды в течение 5—7 дней. Другой группой препаратов при лечении легкой формы дизентерии являются производные хи-нолина. Хлорхинальдол назначают внутрь по 0,2 г 4 раза в день после еды, интетрикс — по 2 капсулы 3 раза в день во время еды, интерикс по 1—2 таблетки 3 раза в день. Длительность курса 5—7 дней. Нитрофурановые препараты и производные хинолина не только оказывают угнетающее действие на шигелл, но и способствуют сохранению нормальной кишечной флоры, что чрезвычайно важно для лиц, перенесших дизентерию.
Для лечения больных шигеллезом средней тяжести используют препараты группы сульфаметоксазола (бактрим, септрин, бисептол-480, гросептол) по 2 таблетки 2 раза в день (утром и вечером после еды) или производные фторхинолона: ципро-флоксацин (ципробай, цифран) по 0,25—0,5 г 2 раза в сутки, офлоксацин (таривид) по 0,2—0,4 г 2 раза в день, норфлокса-цин (нолицин) по 0,4 г 2 раза в течение дня. Больным с тяжелой сопутствующей патологией, нарушениями питания, пожилым людям наряду с хинолонами назначают антибиотики, предпочтительно из группы аминогликозидов (гентамицина сульфат, сизомицина сульфат, тобрамицин, амикацина сульфат), которые вводят парентерально.
При тяжелом течении заболевания наилучший эффект достигается при парентеральном назначении фторхинолонов (например, офлоксацин по 200 мг 2 раза внутривенно капельно) в сочетании с аминогликозидами (например, гентамицина сульфата по 80 мг 3 раза в день внутримышечно), а также комбинации этих препаратов с цефалоспоринами.
Патогенетическая терапия больных тяжелой, а иногда и средней тяжести дизентерией должна включать дезинтоксика-ционные средства. Применяют изотонические солевые растворы (раствор Рингера, растворы «Трисоль», «Ацесоль», «Лактасоль»), которые вводят внутривенно в объеме 1—2 л. Наряду с кристаллоидами при тяжелом течении заболевания назначают коллоидные растворы (гемодез, реополиглюкин и др.) в суточной дозе 400—800 мл, а иногда и глюкокортико-стероиды (короткий курс).
С дезинтоксикационной целью используется и метод энте-росорбции. Из энтеросорбентов назначают полифепан, лигно-сорб, полисорб, энтеросорб, энтерокат М, энтеродез, смекту в обычных дозах.
Видное место в лечении больных шигеллезом занимает витаминотерапия, которая способствует ускорению процессов регенерации и дезинтоксикации. Кроме того, введение витаминов необходимо для покрытия их дефицита при дизентерии, особенно в условиях антибактериальной терапии и кишечного дисбактериоза. Следует применять сбалансированные витаминные комплексы (декамевит, комплевит, глутаме-вит и т. п.).
Применение синтетических препаратов пиримидиновых оснований пентоксила и метилурацила (метацил) обусловлено их влиянием на процессы тканевого обмена. Пентоксил назначают внутрь по 0,2—0,4 г, метилурацил — по 1,0 г 3—4 раза в сутки.
Для устранения кишечного дисбактериоза применяется ко-либактерин (сухой, жидкий, в таблетках, в капсулах), бифи-думбактерин, комбинированный препарат бификол или лак-тобактерин и им подобные. Назначают их через 24—48 ч после прекращения терапии антибактериальными средствами. Курс лечения 2—4 нед. Восстановление микробного биоценоза в кишечнике ускоряет ассоциация лиофилизированного колибактерина с протейным бактериофагом. Использование указанных препаратов предупреждает рецидивы болезни, развитие бактериовыделительства, а также переход острой дизентерии в затяжную или хроническую.
Местное лечение в острый период шигеллеза должно проводиться очень осторожно. В период реконвалесценции применяют средства, усиливающие регенерацию слизистой оболочки толстой кишки. К ним относятся растительные масла, рыбий жир, винилин (бальзам Шостаковского) по 30—50 мл на клизму. Предложен метод орошения прямой и сигмовидной кишки полиглюкином, повышающим резистентность эпителиоцитов. Орошение проводят в течение 5 дней ежедневно или через день (в дозе 50 мл препарата на процедуру).
Учитывая неблагоприятное влияние на течение и исход шигеллеза сопутствующих заболеваний, проводят соответствующее лечение. В случае выявления глистной инвазии дегельминтизация обязательна.
В целях коррекции и компенсации нарушенных функций желудочно-кишечного тракта используют полиферментные препараты (абомин, панкреатин, ораза, панзинорм форте, по-лизим, фестал, мезим форте и др.). При выраженных нарушениях моторной функции кишечника, особенно в острый период дизентерии, показаны спазмолитические средства. Лучшими из них являются метацин, спазмолитин, а также атропин и другие препараты красавки, дающие и обезболивающий эффект. Но-шпа и папаверина гидрохлорид дают заметно меньший результат.
Не утратили своего значения вяжущие, обволакивающие, антисептические и адсорбирующие средства, в том числе лекарственные травы и плоды (цветки ромашки аптечной, трава зверобоя, плоды черемухи, листья и плоды черники, корневища лапчатки прямостоячей, корневище кровохлебки лекарственной и др.).
Лечение хронического шигеллеза проводится на основе общих принципов терапии больных острым шигеллезом: обеспечение максимального щажения желудочно-кишечного тракта, купирование острых явлений, меры по нормализации функций кишечника, иммунорегулирующие мероприятия.
Течение и исход инфекционного процесса в этом случае во многом определяются воздействием факторов специфической и неспецифической защиты Из специфических средств, повышающих резистентность организма и обладающих выраженным лечебным эффектом, в прошлом широко использовалась спиртовая лечебная вакцина Чернохвостовой, а в дальнейшем — энтеральная живая вакцина (иммуноген).
Пирогенал, продигиозан и другие липополисахариды бактериального происхождения оказывают неспецифическое стимулирующее действие — способствуют регенераторным процессам, стимулируют фагоцитоз, активизируют систему гипофиз — кора надпочечников.
Профилактика. Успешная борьба с шигеллезом обеспечивается комплексом лечебно-профилактических и санитарно-гигиенических, а также противоэпидемических мероприятий.
Мероприятия, направленные на источник инфекции, включают раннее выявление, обязательную регистрацию всех больных с острыми кишечными инфекциями и их лечение. Особое значение имеет своевременное распознавание стертых, субклинических форм дизентерии. Поиски источника инфекции осуществляются в очагах дизентерии, при плановом и внеплановом обследовании декретированных профессиональных групп, а также детских коллективов. В очаге дизентерии проводится текущая дезинфекция, а после госпитализации больного осуществляется заключительная дезинфекция. Реконвалесцентов выписывают после полного клинического выздоровления при отрицательных результатах бактериологического исследования. После выписки из больницы реконвалесценты подлежат диспансерному наблюдению в кабинете инфекционных заболеваний в поликлинике.
В профилактике шигеллеза большое значение имеют санитарно-гигиенические мероприятия, направленные на разрыв механизма передачи возбудителей: санитарный контроль за источниками водоснабжения, пищевыми предприятиями, проведение санитарно-просветительной работы среди населения.
В отношении третьего звена эпидемического процесса, т. е. восприимчивых контингентов, меры направлены на повышение их неспецифической резистентности. Вакцинация населения не проводится в связи с отсутствием эффективных прививочных препаратов.
КИШЕЧНАЯ КОЛИ-ИНФЕКЦИЯ
Син. — эшерихиоз
Кишечная коди-инфекция — острое заболевание, вызываемое некоторыми типами кишечных палочек, протекающее с синдромом гастроэнтерита или гастроэнтероколита.
Исторические сведения. Кишечная палочка под названием Bacterium coli commune открыта в 1886 г. австрийским ученым Т. Эшери-хом, в честь которого получила наименование Escherichia coli. Им же было высказано предположение о возможной роли кишечной палочки в происхождении детских поносов. В 1894 г. Г. Н. Габричевский путем экспериментальных исследований выявил у Е. coli способность к токсинообразованию и подтвердил ее этиологическую роль в инфекционной патологии кишечника. В 1927 г. А. И. Доброхотова провела опыт самозаражения культурой кишечной палочки, выделенной от детей, умерших от диспепсии. Этим опытом она доказала, что культуры некоторых кишечных палочек вызывают выраженный токсикоз. В дальнейшем А. Адам подробно изучил свойства кишечной палочки и дифференцировал на этой основе ее патогенные типы. Разработанный Ф. Кауфманом (1942—1945) метод серологического анализа положен в основу современной классификации Е. coli.
Этиология. Возбудители кишечных коли-инфекций Е. coli — кишечные палочки, относящиеся к роду Escherichia, семейству Entero-bacteriaceae. Эшерихии — небольшие грамотрицательные палочковидные бактерии размером (0,4—0,6) х (2—3) мкм. Они хорошо растут на обычных питательных средах. Имеют сложную антигенную структуру. Эшерихии содержат соматический О-антиген, жгутиковый Н-антиген и поверхностный соматический К-антиген. В настоящее время у Е. coli изучено около 170 О-антигенов, из которых более 80 выделены у патогенных для человека эшерихии. На основании различий в О-ан-тигене эшерихии разделены на соответствующее число О-групп. Внутри каждой группы бактерии различаются по Н- и К-антигенам. В обычной практике ограничиваются указанием на принадлежность возбудителя к той или иной О-серогруппе: Ol, 025, 0152 и т. д.
В настоящее время принято подразделять патогенные для человека Е. coli на 5 групп: энтеропатогенные (ЭПКП), энтероинвазивные (ЭИКП), энтеротоксигенные (ЭТКП), энтерогеморрагические (ЭГКП) и энтероаггрегативные (ЭАггКП) кишечные палочки.
ЭПКП являются причиной заболеваний с преимущественным поражением тонкого отдела кишечника у грудных детей (колиэнтериты детей раннего возраста) во многих районах мира. Чаще всего они обусловлены ЭПКП 026, 044, 055, 086, ОИ1, ОП4, ОП9, 0125, 0126, 0127, 0142 и 0158. Описание колиэнтеритов детей раннего возраста, вызываемых ЭПКП, в настоящий учебник, посвященный инфекционным заболеваниям взрослых, не вошло.
ЭИКП обладают способностью инвазировать эпителий кишечника и вызывать заболевания, патогенез и клиническая картина которых подобны шигеллезу (дизентериеподобный эшерихиоз). Они имеют много общих О-антигенов с шигеллами. ЭИКП включают следующие О-группы: 028ас, ОИ2ас, 0124, 0129, 0136, 0143, 0144, 0151, 0152, 0164. На территории нашей страны у больных наиболее часто выделяется ЭИКП 0124.
ЭТКП способны продуцировать энтеротоксины и часто являются причиной диареи у детей и взрослых в развивающихся странах, а также у лиц, посетивших эти страны («диарея путешественников»). Среди ЭТКП различают штаммы, продуцирующие термолабильный (ТЛ) энтеротоксин, иммунологически близкий энтеротоксину холерных вибрионов; штаммы, вырабатывающие термостабильный (ТС) неантигенный энтеротоксин, и, наконец, штаммы, образующие оба (ТЛ/ТС) энтеротоксина. В состав ЭТКП входят следующие О-группы; Ol, Об, 08, 015, 025, 027, 078, ОП5, 0148. 0159 и др. Заболевание, которое они вызывают, нередко именуют холероподобным эшерихиозом.
ЭГКП описаны в 1982 г. в США в ходе двух вспышек кишечных инфекций с развитием геморрагического энтероколита. Изолированная ЭГКП получила код 0157:Н7. В дальнейшем выделены подобные шигеллы, способные продуцировать SLT (Shiga like toxin), отнесенные к группе ЭГКП. Среди заболевших преобладают дети.
ЭАггКП выделены в отдельную группу несколько позже. Их отличает способность вызывать кишечную инфекцию преимущественно у лиц с ослабленной резистентностью организма, как взрослых, так и детей.
Эпидемиология. Основным источником инфекции являются больные эшерихиозом (чаще стертой формой заболевания); меньшее значение имеют бактериовыделители.
Механизм передачи фекально-оральный. Среди путей распространения инфекции ведущая роль принадлежит пищевому, причем основными факторами передачи выступают молоко и молочные продукты. Вторым по значению является водный путь передачи инфекции. В некоторых случаях, особенно при заболеваниях, вызванных ЭПКП, имеет место контактно-бытовой путь распространения заболевания.
Восприимчивость к эшерихиозам значительно выше в детском возрасте. Более того, ЭПКП вызывают заболевания лишь у детей в возрасте до 2 лет.
ЭИКП вызывают как спорадические, так и групповые заболевания. Сезонный подъем заболеваемости дизентериеподобным эшерихиозом приходится на летне-осенние месяцы. Преобладающий путь передачи инфекции, вызванной ЭИКП, пищевой (алиментарный).
ЭТКП часто являются причиной острых кишечных заболеваний в развивающихся странах и относительно редко — в экономически развитых странах. Исключение составляют районы с плохими санитарно-гигиеническими условиями. Заболеваемость, вызываемая ЭТКП, в развивающихся странах наиболее высока среди детей до 2 лет. Частота случаев заболевания быстро снижается к 4-летнему возрасту и остается на низком уровне во всех последующих возрастных группах, свидетельствуя о развитии иммунитета. Установлено, что ЭТКП служат причиной диареи у 60—70 % путешественников из промышлен-но развитых стран, посещающих развивающиеся страны.
ЭТКП вызывают как спорадические, так и групповые заболевания. Сезонный подъем холероподобного эшерихиоза приходится на летне-осенние месяцы. Доминирует водный путь передачи возбудителей.
Патогенез. Основные патогенетические звенья при дизен-териеподобном эшерихиозе (вызываемом ЭИКП и ЭГКП) аналогичны таковым при дизентерии. Наибольшее значение среди них имеет инвазия бактерий в эпителиал ьные клетки кишечника и продукция ими токсинов.
Возбудители холероподобного эшерихиоза — ЭТКП — способностью к инвазии не обладают. После проникновения бактерий в тонкую кишку происходит их адгезия к эпителиальным клеткам. Дальнейшее развитие патологического процесса обусловлено действием выделяемых эшерихиями энтероток-синов. Установлено, что диарея, вызываемая ТЛ-штаммами, как и при холере, обусловлена активацией цАМФ, тогда как диарея, вызываемая ТС-штаммами, связана с активацией цГМФ. Продукция обоих видов энтеротоксина ТЛ/ТС-штаммами бактерий приводит к активации цАМФ и цГМФ. Достоверных сведений об инфекциях, вызванных ЭАггКП, пока мало.
Клиническая картина. Наиболее полно изучена клиническая картина дизентериеподобного эшерихиоза, вызываемого ЭИКП 0124. Продолжительность инкубационного периода составляет 1—3 дня. Заболевание начинается остро. В большинстве случаев признаки интоксикации выражены незначительно. Однако у некоторой части больных (около 20 % случаев) температура тела быстро поднимается до 37,5—38 °С, иногда до 39 "С, сопровождаясь ознобом. Больные жалуются на головную боль, слабость, иногда головокружение, схваткообразные боли в животе. Спустя несколько часов от начала болезни появляется понос. Частота дефекаций увеличивается до 3—5, редко до 10 раз в сутки, стул становится жидким, с примесью слизи, иногда с кровью. В некоторых случаях испражнения теряют каловый характер, становятся слизисто-кровя-нистыми. Могут наблюдаться тенезмы, но они менее характерны для эшерихиоза, чем для дизентерии. Рвота при дизен-териеподобном эшерихиозе бывает редко.
Язык влажный, обложен белым или сероватым налетом. Живот при пальпации мягкий, как правило, несколько вздут. Пальпация толстой кишки обычно болезненна во всех отделах, нередко определяется ее спазм. Довольно часто выявляется болезненность вокруг пупка по ходу петель тонкой кишки, а также урчание. При ректороманоскопии определяются симптомы катарального, реже катарально-геморрагического или язвенного проктосигмоидита. Заболевание обычно протекает легко и заканчивается выздоровлением через 5—7 дней. Реже встречаются формы средней тяжести, и лишь в 5—7 % случаев заболевание принимает тяжелое течение.
Еще более легко протекают другие этиологические варианты дизентериеподобного эшерихиоза.
Клиническая картина холероподобного эшерихиоза, вызываемого ЭТКП, напоминает легкое течение холеры. Инкубационный период обычно не превышает 1—3 дней. Заболевание начинается остро. Больные жалуются на недомогание, слабость, тошноту. Затем появляются схваткообразные боли в эпи- и мезогастрии, сопровождающиеся усилением тошноты и появлением рвоты и поноса. У части больных заболевание протекает без болей в животе. Рвота, как правило, повторная. Стул жидкий, водянистый, без примеси слизи и крови, частый (5—10 раз и более в сутки) и обильный. Вследствие значительной потери жидкости с испражнениями и рвотными массами обычно развиваются симптомы дегидратации. Важнейшая клиническая особенность холероподобного эшерихиоза — отсутствие в большинстве случаев лихорадки. Указанная особенность нашла отражение в характеристике холероподобного эшерихиоза как афебрильного гастроэнтерита. Длительность дисфункции кишечника редко превышает 3—4 дня.
Прогноз. При эшерихиозах обычно благоприятный.
Диагностика. Наряду с клинико-эпидемиологическими данными в диагностике эшерихиоза важная роль принадлежит лабораторной диагностике. Наибольшее значение имеет бактериологический метод. Исследуемым материалом служат испражнения и рвотные массы.
Другие методы лабораторной диагностики, в том числе и серологический (РНГА), большого практического значения в настоящее время не имеют. Основная причина этого — антигенная общность между эшерихиями, шигеллами и некоторыми другими бактериями.
Дифференциальная диагностика. Эшерихиоз дифференцируют от дизентерии, сальмонеллеза, пищевых токсикоинфек-ций, острых кишечных заболеваний вирусной этиологии. Само название «холероподобный эшерихиоз» диктует необходимость дифференциации его от холеры. Решающее значение в этих случаях приобретает оценка эпидемиологической ситуации и результатов бактериологического исследования.
Лечение. Принципы и способы лечения больных дизенте-риеподобным эшерихиозом те же, что и дизентерией. При хо-лероподобном эшерихиозе главным терапевтическим мероприятием является восстановление водно-электролитного баланса. Оно достигается путем пероральной регидратации глю-козо-электролитными растворами, а в тяжелых случаях — внутривенным введением полиионных растворов. Больным назначаются также кишечные антисептики (нитрофурановые, хинолоны).
Профилактика. Системы профилактических мероприятий для эшерихиоза и других острых кишечных инфекций одинаковы. Специфическая профилактика дизентериеподобного и холероподобного эшерихиоза не разработана. Этиотропная терапия инфекции, вызванной ЭГКП, остается трудной проблемой. Некоторые авторы сообщают, что препараты типа бактерии, гросептол, биссептол и т. п. могут ухудшить течение заболевания.
ХОЛЕРА
Холера — вызываемая холерными вибрионами антропоноз-ная острая кишечная инфекция, протекающая с развитием водянистой диареи и рвоты, приводящих к дегидратации, деминерализации и нередко к дегидратационному шоку. В связи со склонностью к тяжелому течению и способностью к развитию пандемий холера входит в группу болезней, на которые распространяются Международные медико-санитарные Правила (карантинные инфекции).
Исторические сведения. Холера известна с незапамятных времен, она указана в санскритской литературе, в трудах Гиппократа (греч. cholera, от chole— желчь и rheo— течь, истекать). Первое научное описание эпидемии болезни сделано в 1563 г. португальским врачом Гарсия дель Хуэрто в Индии. До 1817 г. болезнь наблюдалась лишь в исторических очагах инфекции в Южной Азии (бассейны рек Брах-мапутры и Ганга).
В 1817—1926 гг. наблюдалось распространение холеры по всем континентам, с развитием 6 пандемий, унесших миллионы человеческих жизней. В этот период были изучены этиология и основные эпидемиологические закономерности болезни.
Приоритет открытия возбудителя под названием «холерный вибрион» принадлежит флорентийскому патологу Ф. Пачини (1854), указавшему на основной, водный, путь передачи инфекции, наличие которого предполагал лондонский врач Д. Сноу еще в 1849 г. В 1872—1874 гг. возбудитель холеры был описан Э. Недзвецким в России, в 1883—1885 гг. холерный вибрион был подробно изучен и выделен в чистой культуре Р. Кохом в Египте. В 1906 г. Ф. и Е. Гот-шлихи на карантинной станции El Тог (западное побережье Синайского полуострова в Красном море) из кишечника погибшего паломника выделили вибрионы El-Tor, сходные с классическими вибрионами, но длительное время считавшиеся непатогенными.
Разработка международных карантинных и иных противоэпидемических мероприятий ограничила на 35 лет распространение болезни в ее исторических очагах на Индийском субконтиненте. Однако с 1961 г. возникла (о. Сулавеси в Индонезийском архипелаге) и быстро охватила все континенты, за исключением Антарктиды, вызванная новым биоваром возбудителя, Vibrio cholerae biovar El-Tor, 7-я пандемия холеры, продолжавшаяся почти 30 лет и отличавшаяся более доброкачественным течением болезни с большим числом субклинических форм инфекции.
С октября 1992 г. получил распространение обнаруженный в 1990 г. в Бангладеш новый вариант холерного вибриона — серовар 0139, или вибрион «Bengal», что стало расцениваться как начало 8-й пандемии холеры.
Этиология. Возбудитель — Vibrio cholerae относится к семейству Vibrionaceae, роду Vibrio, представлен двумя биоварами: Vibrio cholerae biovar cholerae («классический») и Vibrio cholerae biovar El-Tor, и сероваром Vibrio cholerae 0139 Bengal. Патогенные вибрионы обладают сходными морфологическими, тинкториальными и культуральны-ми свойствами, являются подвижными грамотрицательными слегка изогнутыми микроорганизмами размером (1,5—3,0) х (0,2—0,6) мкм, на одном из концов имеют жгутик (иногда 2 жгутика), обеспечивающий подвижность бактерий, спор не образуют, у V. cholerae 0139 имеется капсула. Вибрионы хорошо окрашиваются анилиновыми красителями.
Холерные вибрионы являются факультативными аэробами, гало-фильными (щелочелюбивыми) микроорганизмами, хорошо размножаются на содержащих натрий простых и щелочных (рН 7,8—8,0) жидких и твердых питательных средах, обладают способностью разжижать желатину, разлагать крахмал и многие углеводы.
Классический и El-Tor биовары вибрионов относятся к серологической группе Ol, так как они агглютинируются холерной Ol-анти-сывороткой, V. cholerae 0139 Bengal относится к неагглютинирую-щимся 01-сывороткой (НАГ) вибрионам и агглютинируются специфической 0139-антисывороткой.
Холерные вибрионы обладают термолабильным жгутиковым Н-антигеном и термостабильным липополисахаридным 01-соматическим антигеном, включающим группоспецифический А и типоспе-цифические В и С антигены. В зависимости от свойств последних у классического и El-Tor вибрионов различают серовары: Ogawa (А, В антигены), Inaba (А, С антигены) и Hikojima (А, В, С антигены). V. cholerae 0139 Bengal не имеют 01 антигена, но в отличие от предыдущих биоваров образуют полисахаридную капсулу.
Патогенные свойства холерных вибрионов обусловлены наличием у них ряда токсинов: связанного с бактериальной клеточной мембраной термостабильного липополисахарида (ЛПС), обладающего свойствами эндотоксина и индуцирующего синтез вибриоцидных антител, термолабильного экзотоксина (холерного энтеротоксина, или холерогена), обусловливающего ведущий клинический синдром дегидратации, и группы ферментов, способствующих реализации эффекта холерогена — нейраминидазы (инвазии), липазы, протеазы и др. Различают антигенные варианты холерного энтеротоксина (ХЭТ) — ХЭТ-1, синтезируемый V. cholerae var. cholerae и V. cholerae var. El-Tor, и ХЭТ-2, продуцируемый V. cholerae 0139 Bengal.
Вибрионы быстро погибают при высушивании и в кислой среде (при рН 4,5 и ниже), при УФ-облучении и воздействии хлорсодержа-щих дезинфектантов, мгновенно — при кипячении и через 30 мин при нагревании до 56 °С. Вместе с тем вибрионы могут длительно сохраняться в открытых водоемах (несколько месяцев в морской воде), в организме гидробионтов (устрицы, лягушки, ракообразные и др.) и в условиях низких температур. На пищевых продуктах при комнатной температуре они выживают в течение 2—5 дней, на незатенен-ных от солнца овощах и фруктах—до 8 ч. Устойчивость вибрионов El-Тог выше, чем классических холерных вибрионов.
Эпидемиология. Холера — кишечный антропоноз, склонный к пандемическому распространению.
Резервуар возбудителей и источник инфекции — больной манифестной или субклинической формами человек, выделяющий холерные вибрионы с испражнениями во внешнюю среду. Наиболее интенсивным источником инфекции являются больные манифестными формами холеры, которые в первые 4—5 дней болезни выделяют до 10—20 л жидких испражнений, содержащих в 1 мл до 10*—109 вибрионов. Больные стертыми и субклиническими формами (вибрионо-носители) выделяют меньшее количество вибрионов, но, оставаясь в коллективах, они играют важную эпидемиологическую роль. Рекон-валесценты холеры могут выделять до 102—10" вибрионов в 1 г фекалий (реконвалесцентное вибрионовыделение) в течение 2—4 нед, транзиторные носители — 10—14 дней.
Механизм заражения холерой — фскально-оральный, реализуемый посредством водного, алиментарного и контактно-бытового путей передачи возбудителей. Ведущим служит водный путь передачи вибрионов, обеспечивающий эпидемическое, эксплозивное распространение холеры. Заражение происходит как при питье инфицированной воды (открытые водоемы, повреждение систем водоснабжения и др.), так и при ее использовании для хозяйственных целей — мытье овощей, фруктов, зелени — и при заглатывании во время купания.
Вследствие интенсивного загрязнения водоемов в процессе урбанизации и недостаточного уровня очистки и обеззараживания сточных вод многие поверхностные водоемы могут стать дополнительным временным резервуаром вибрионов, на основании чего многие исследователи относят холеру к группе сапронозов. Установлено длительное сохранение V. cholerae var. El-Tor в иле и слизи канализационных систем, систем водоснабжения, а также в организме многих гидробионтов (моллюски, ракообразные, лягушки, рыбы и др.), что приводит к накоплению возбудителей в открытых водоемах, приобретающих важное эпидемиологическое значение.
Алиментарный путь инфицирования реализуется при употреблении в пищу зараженных продуктов (овощей, фруктов, молока, устриц, креветок и других гидробионтов), не подвергавшихся достаточной термической обработке. Для пищевых вспышек характерен взрывной тип заболеваемости среди ограниченного крута лиц, связанных с употреблением зараженных пищевых продуктов.
Контактно-бытовой путь передачи вибрионов наблюдается реже и реализуется при несоблюдении гигиенических правил во время прямого контакта с больным или вибрионовыделителями. Возбудитель заносится в рот инфицированными руками через посуду и другие предметы обихода. Определенную эпидемиологическую роль играют бытовые насекомые (мухи, тараканы и др.), являющиеся механическими переносчиками вибрионов. Заболевания, обусловленные контактно-бытовым заражением, характеризуются медленным распространением среди ограниченного круга лиц.
Холере, как и всем кишечным инфекциям, свойственно сезонное повышение заболеваемости в теплый период года в связи с активизацией ведущих путей и факторов передачи вибрионов (употребление большого количества воды, снижающей желудочный кислотный барьер, более частое употребление сырых овощей и фруктов, «мушиный фактор», купание, оптимальные температурные условия для обитания вибрионов в водоемах и др.).
Восприимчивость к холере всеобщая, но большему риску заболевания подвержены люди с нарушенной барьерной функцией желудка (больные с гипоацидными состояниями), дети (кроме детей, находящихся на грудном вскармливании) и люди преклонного возраста. В эпидемических очагах заболевание чаще возникает у мужчин трудоспособного возраста, в разгар эпидемии половые различия заболеваемости не выражены.
В связи со склонностью холеры к эпидемическому и пандемическому распространению каждый случай болезни в течение 24 ч подлежит регистрации в ВОЗ. В настоящее время заболевания холерой наблюдаются более чем в 30 странах, преимущественно в Африке (более 70 % мировой заболеваемости) и Азии. В странах Америки и Европы, в том числе в России, выявляются завозные случаи холеры.
Патогенез и патологоанатомическая картина. Холера — циклический (самоограничивающийся) инфекционный процесс, характеризующийся развитием выраженной дегидратации и деминерализации вследствие специфического повреждения ферментных систем энтероцитов холерным энтеротоксином (ХЭТ).
Заглоченные с водой или пищей и преодолевшие желудочный барьер холерные вибрионы попадают в благоприятные для их размножения условия (щелочная среда тонкой кишки и оптимальная температура) и быстро колонизируют просвет и поверхность слизистой оболочки тонкой кишки. Продуцируемый вибрионами ХЭТ с помощью ферментов (инвазии и др.) моделирует клеточные рецепторы энтероцитов —
GMl-ганглиозиды, связывается с ними посредством В-фраг-мента и обеспечивает последующее проникновение в энтеро-цит А-фрагмента ХЭТ. Под действием внутриклеточного глу-татиона происходит высвобождение активного компонента ХЭТ А-1, который посредством переноса АДФ-рибозы с ни-котинамид-аденин-динуклеотида (NAD) на гуанозин 5'-три-фосфатсвязывающий регуляторный белок изменяет регуляцию системы аденилатциклазы, «переключая» ее на повышенное образование циклического 3'—5'-аденозинмонофосфата (цАМФ). Под влиянием большого количества цАМФ нарушается функция трансмембранного электролитного насоса энтероцитов с усилением секреции в просвет кишки ионов хлора. Изменение вследствие этого осмотического и электрического градиента приводит к значительно усиленному поступлению в просвет тонкой кишки ионов натрия, калия, хлора, гидрокарбоната (в меньшей степени других электролитов) и воды в постоянном соотношении — 140 ммоль натрия, 13 ммоль калия, 32 ммоль гидрокарбоната и 92 ммоль хлора в 1 л воды.
Быстрое увеличение объема тонкокишечного содержимого, превышающего резорбтивную способность слизистой оболочки кишечника, вызывает появление большеобъемной водянистой диареи секреторного типа и рвоты с потерей до 10—30 л жидкости в сутки, развитие изоосмолярной интерстициальной дегидратации и деминерализации. Прогрессирование болезни может сопровождаться развитием гиповолемии со сгущением крови, дегидратационного шока, нарушением перфузии тканей и их гипоксии, клеточной дегидратации, деминерализации с метаболическим ацидозом и респираторным алкалозом, возникновением полиорганной недостаточности. У нелеченых больных или при неадекватной терапии метаболические нарушения становятся несовместимыми с жизнью.
При аутопсии погибших от холеры демонстративны признаки обезвоживания в виде сморщенное™ кожи туловища и конечностей, сухости слизистых оболочек, западения глазных яблок, отмечается диффузный цианоз. Мышечный гипертонус придает телам погибших «позу бойца или боксера».
В кровеносных сосудах обнаруживаются желеобразные массы крови, количество цереброспинальной жидкости уменьшено. Выявляются цианоз и неравномерное кровенаполнение внутренних органов, распространенные дистрофические изменения в миокарде и паренхиматозных органах.
В просвете тонкой кишки обнаруживается большой объем мутной желтоватой жидкости. Морфологические повреждения эпителиальных клеток тонкой кишки или воспалительные процессы в кишечной стенке не развиваются, а в прижизненных биоптатах слизистой оболочки тонкой кишки определяется выраженная экссудация.
Бактериальные липополисахариды индуцируют синтез специфических иммуноглобулинов классов IgA, IgM и IgG, обладающих свойствами антитоксических антител, препятствующих взаимодействию ХЭТ с рецепторами энтероцитов, и виб-рионоцидных антител, блокирующих подвижность вибрионов и вызывающих их гибель. Пик продукции антител отмечается на 8—10-й день болезни. У реконвалесцентов холеры формируется иммунитет, но нередко отмечаются повторные заболевания, возможно вызванные другим вариантом возбудителей.
Клиническая картина. Инкубационный период продолжается от 6 ч до 5 дней, в среднем около 48 ч. Клинические проявления болезни, вызванной различными биоварами холерных вибрионов, сходны.
Различают типичную форму холеры, протекающую в зависимости от степени дегидратации в легкой, средней тяжести и тяжелой формах, и атипичные: стертая, молниеносная и «сухая» формы холеры. При холере, вызванной V. cholerae var. El-Тог и V. cholerae 0139 Bengal, преобладают средней тяжести, легкие и стертые формы болезни (более 80 % случаев).
В соответствии с классификацией ВОЗ, легкой форме холеры соответствует дегидратация I степени (потеря жидкости менее 5 % от массы тела), форме средней тяжести — дегидратация II степени (6—9 % массы тела), тяжелой форме — дегидратация III степени (10 % массы тела и более). В России распространена классификация В. И. Покровского, выделяющая 4 формы тяжести холеры в соответствии со степенью обезвоживания: I степень — потеря жидкости в объеме менее 3 % массы тела, II степень — в объеме 4—6 % массы тела, III степень — в объеме 7—9 % массы тела, ГУ степень — в объеме 10 % и более.
Типичная форма холеры начинается остро, часто внезапно: в ночное время или утром у больных возникают повторные императивные позывы на дефекацию без тенезмов или болей в животе, но нередко сопровождающиеся дискомфортом в околопупочной области, переполнением и переливанием жидкости в кишечнике.
Стул быстро утрачивает каловый характер, становится обильным, приобретает водянистый вид, иногда окрашен желчью и содержит плавающие хлопья. В последующем стул становится похожим на рисовый отвар, утрачивает каловый запах, сменяющийся нередко запахом рыбы или сырого тертого картофеля.
При
легкой
форме болезни
частота дефекаций составляет от 3 до
10 раз в день и сопровождается умеренно
выраженными жаждой и мышечной слабостью.
При осмотре больных отмечаются
нормальная температура тела, небольшая
сухость языка, незначительная
тахикардия, западение передней брюшной
стенки. Физико-химические свойства
крови не изменяются. При своевременной
терапии диарея прекращается в течение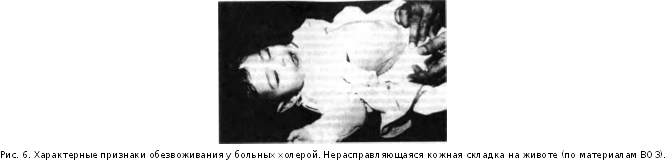
нескольких часов или 1—2 дней, наступает клиническое выздоровление больных.
В случаях холеры средней тяжести частота дефекаций достигает 15—20 раз в сутки, нередко возникает повторная рвота «фонтаном»; рвотные массы, как и испражнения, напоминают рисовый отвар и часто прокрашиваются желчью. В этих случаях становятся более выраженными клинические признаки дегидратации: выраженная жажда, не купируемая приемом воды, резкая мышечная слабость, кратковременные тонические судороги мышц предплечий, кистей, голеней и стоп, уменьшается мочеотделение.
При обследовании пациентов выявляются сухость слизистых оболочек и кожи, снижение звучности голоса, подчеркивание черт лица, тахикардия в сочетании с умеренной артериальной гипотонией. Передняя брюшная стенка западает, тур-гор кожи слегка понижен, но кожная складка на животе быстро расправляется (менее 1 с).
В гемограмме может отмечаться небольшое увеличение числа эритроцитов, повышается относительная плотность крови (1,026—1,029, в норме 1,026) и увеличиваются показатели гематокрита (0,51—0,54, в норме 0,40—0,50). Может выявляться увеличение относительной плотности мочи.
Адекватная терапия обеспечивает клиническое выздоровление таких больных в течение 2—3 дней.
Для тяжелой формы холеры характерны короткий инкубационный период, многократный обильный водянистый стул и неукротимая рвота «фонтаном», приводящие в течение нескольких часов к потере 7—9 % массы тела (дегидратация III степени).
Состояние больных быстро ухудшается, их беспокоят выраженная мышечная и психическая слабость, некупируемая жажда, частые и продолжительные тонические судороги скелетных мышц. Физическое обследование выявляет сухость кожи и слизистых оболочек, затрудняющую смыкание губ и век, осиплость голоса, заострение черт лица с западением глазных яблок («facies cholerae*, или «лицо Гиппократа»), цианоз дис-тальных частей тела. У грудных детей западает большой родничок. Кожная складка на животе расправляется медленно (в течение 1—2 с) (рис. 6), на пальцах кисти кожа может собираться в складки («рука прачки»). Температура тела нормальная или немного пониженная, артериальное давление стойко понижено, частота пульса и дыхания увеличена, выражена олигоурия.
В гемограмме определяется увеличение количества гемоглобина, числа эритроцитов и лейкоцитов, замедление СОЭ. Плотность крови повышена до 1,030—1,035, показатели гематокрита увеличены до 0,55—0,65, определяются гипокалие-мия, гипонатриемия, метаболический ацидоз, снижение р02 и увеличение рС02, увеличение в крови содержания лактата и азотистых метаболитов. Плотность мочи повышена. ЭКГ выявляет снижение вольтажа, признаки миокардиодистро-фии.
При несвоевременной или недостаточно активной терапии заболевание, как правило, прогрессирует с развитием крайне тяжелой (ГУ степени) степени дегидратации (дефицит жидкости — 10 % массы тела и более) и декомпенсированного де-гидратационного шока.
При особо тяжелых, молниеносных (фульминантных) формах холеры неукротимые диарея и рвота могут привести к развитию дегидратационного шока в течение первых 10—12 ч заболевания. Для этой формы болезни характерны общее тяжелое состояние и психическая угнетенность больных, афония, почти непрекращающиеся тонические мышечные судороги, икота. Кожная складка на животе не расправляется более 2 с, кожа в области суставов нередко собирается в складки, веки не смыкаются (симптом «заходящего солнца»), рот полуоткрыт, язык сухой.
Отмечается диффузный кожный цианоз с багровым прокрашиванием кончика носа, ушных раковин, кончиков пальцев. Температура кожи снижается до 34—35 °С («холерный ал-гид», от греч. algus — холодный). Пульс нитевидный, частый, АД не определяется, дыхание частое и поверхностное, мочеотделение отсутствует. В этот период выделение испражнений и рвотных масс может прекратиться, что служит мрачным прогностическим признаком.
Лабораторное исследование выявляет гематологические признаки сгущения крови, повышение ее относительной плотности до 1,038—1,050, показателей гематокрита — до 0,60—0,70, выраженную гипоксемию, декомпенсированный метаболический ацидоз в сочетании с респираторным алкалозом, гипоэлектролитемию, высокое содержание в крови лак-тата, азотистых метаболитов.
В этой стадии болезни терапия оказывается эффективной менее чем у 20 % больных.
К атипичным формам болезни относится сухая холера («cholera sicca»), которая протекает с быстро нарастающими признаками гиповолемического шока: артериальная гипотония, анурия, тахипноэ, цианоз, судороги, энцефалопатия, приводящими к гибели больных еще до появления характерных водянистой диареи и рвоты.
Стертая и субклиническая формы холеры распознаются в процессе специфического обследования контактных лиц в очагах инфекции или по эпидемиологическим показаниям.
У детей первых 4 лет жизни холера отличается наклонностью к тяжелому течению с быстрым развитием выраженной дегидратации.
Прогноз. В современных условиях летальность от холеры в Азии, Америке и Европе не превышает 1 %, в странах Африки достигает 3—5 %, при неадеватной терапии может повышаться до 25-30 %.
Диагностика. Клиническое распознавание холеры основывается на возникновении острой водянистой диареи бескаловыми массами с последующей рвотой при отсутствии болей в животе и лихорадочной реакции у пациента из неблагополучного по холере региона.
Дифференциальный диагноз проводят с пищевыми токси-коинфекциями, сальмонеллезом, эшерихиозами, вызванными энтеротоксигенными Е. coli (ЕТКП), вирусными диареями, токсическим поражением кишечника ядохимикатами, солями тяжелых металлов и ядовитыми растениями.
Диагноз холеры требует обязательного подтверждения специфическими методами лабораторных исследований, из которых первостепенное значение имеет выделение в первые дни болезни культуры холерных вибрионов из испражнений и рвотных масс больного или содержимого отрезков тонкой кишки погибших лиц. У реконвалесцентов холеры и вибрио-ноносителей исследуют дуоденальное содержимое. Патологический материал от больных следует брать до применения антибактериальных препаратов и не ранее 24—36 ч после прекращения их приема (забор жидких выделений осуществляют с помощью стерильных трубочек, реже — тампонов).
Ориентировочное значение может иметь прямая микроскопия окрашенных фуксином испражнений или рвотных масс, в которых обнаруживаются скопления подвижных вибрионов в виде «стайки рыб».
Для изоляции холерных вибрионов используют классические методы культивирования возбудителей на жидких (1 % щелочная пептонная вода, 1 % таурохолаттеллуритная вода и др.) и твердых средах (1 % щелочной агар и другие среды), на средах-консервантах, позволяющие идентифицировать вибрионы в течение 24—36 ч. Разработаны ускореные методы изоляции холерных вибрионов в течение 6—18 ч. Важное диагностическое значение, особенно при распознавании первых случаев холеры, имеют экспрессные методы обнаружения вибрионов — иммунофлюоресцентное исследование, ИФА (ответ через 1,5—2 ч), реакция иммобилизации вибрионов противохолерной 07-сывороткой с применением фазово-кон-трастной микроскопии (ответ через несколько минут) и др. Положительные результаты экспрессных методов не исключают обязательного изучения культуры холерных вибрионов.
Разработаны методы обнаружения холерных вибрионов с помощью ПЦР.
Серологические методы исследования (реакция нейтрализации, ИФА и др.), направленные на обнаружение вибрионо-цидных и антитоксических антител, приобретают диагностическое значение в более поздние сроки болезни.
Лечение. Терапия всех форм холеры, а также лечение больных с предположительным диагнозом холеры проводится в условиях инфекционного или специализированного стационара.
Терапевтические мероприятия направлены в первую очередь на купирование или профилактику синдрома дегидратации (регидратационная терапия), а также на элиминацию вибрионов (этиотропная антибактериальная терапия).
Регидратационная терапия осуществляется в 2 этапа: 1-й этап — восстановление имеющегося дефицита воды и электролитов (начальная, или первичная, регидратация), 2-й этап — компенсация продолжающихся водноэлектролитных потерь (компенсаторная регидратация).
Проведение первичной регидратации должно начинаться с момента выявления больного еще на догоспитальном этапе.
У большинства больных легкой и средней тяжести формами холеры (80—90 % случаев) высокоэффективным является метод оральной регидратации с помощью глюкозо-солевых растворов: разработанного ВОЗ стандартного орального солевого раствора (ORS), более стойкого при хранении «Регидро-на» и других аналогичных вариантов («Цитроглкжосолан» и др.). При отсутствии готовых глюкозосолевых смесей для начала терапии в домашних условиях может быть использован раствор поваренной соли и пищевого сахара в соответствующих пропорциях. Объем и ритм проведения оральной регидратации зависят от степени дегидратации и возраста пациента.
Первичная оральная регидратация проводится в течение первых 4 ч с назначением ORS. Растворы применяют дробно, детям по 1 чайной ложке в 1 мин, взрослым по 1 столовой ложке в 1 мин. В ряде случаев детям регидратаци-онные растворы вводят через назогастральный зонд. Объем используемых оральных регидратационных растворов достигает 200, иногда 350 мл/кг/сут.
В случаях тяжелой степени дегидратации или при невозможности приема ORS из-за частой рвоты применяют ин-фузионный метод первичной регидратации с помощью стандартного солевого раствора «Трисоль» (раствор Фил-липса № 1, раствор «5-4-1») или других солевых растворов: «Дисоль», «Ацесоль», «Хлосоль», «Квартасоль», «Лактосоль».
Для детей рекомендуются солевые растворы, включающие глюкозу: Рингера-лактат, Гартмана и др. Температура используемых регидратационных растворов 37—38 °С. В связи с необходимостью постоянного и длительного проведения инфу-зионной регидратации целесообразно осуществлять катетеризацию центральных или периферических вен.
Первичная инфузионная регидратация детям в возрасте до
-
года проводится в объеме 100 мл/кг в течение 6 ч (30 мл/кг в первый час и 70 мл/кг за остальные 5 ч). Детям старше 1 года и взрослым регидратационные растворы вводят по 100 мл/кг в течение 3 ч (30 мл/кг в первый час и 70 мл/кг за остальные
-
ч). Инфузии проводят с постояным получасовым контролем пульса (частота, наполнение) и АД для своеврменной коррекции скорости введения растворов. При появлении возможности глотания инфузионную терапию дополняют оральной ре-гидратацией в объеме 5 мл/кг/ч.
По окончании первичной регидратации (через 6 ч у грудных детей и 3 ч у остальных больных) проводят всесторонний контроль состояния больного.
Компенсаторная регидратация осуществляется с учетом продолжающихся потерь жидкости с кишечным и желудочным содержимым путем назначения ORS. Продолжительность регидратационной терапии в большинстве случаев ограничивается 2—3 сут с использованием у взрослых до 20—30 л полиионных растворов. По показаниям проводят коррекцию электролитного баланса дополнительным введением препаратов калия и других ионов.
Регидратационная терапия сочетается с этиотропным лечением, которое, в соответствии с рекомендациями ВОЗ, включает применение антибактериальных препаратов, из которых препаратом выбора у взрослых (за исключением беременных) и детей старше 8 лет является доксициклин. Высокий эффект оказывает тетрациклин. Эффективным альтернативным препаратом, особенно у детей, является ко-тримокса-зол. При непереносимости сульфаниламидных препаратов и тетрациклина, а также беременным рекомендуется применять фуразолидон.
В регионах с распространением устойчивых к тетрациклину холерных вибрионов рекомендуется применять альтернативные антибиотики — эритромицин или левомицетин в возрастных дозах.
Антибактериальные препараты назначают в основном пер-орально, лишь при неспособности больного глотать антибиотики применяют парентерально. На фоне этиотропного лечения вдвое снижается потребность в полиионных растворах.
Антибактериальная терапия также показана больным стертыми и субклиническими формами холеры, за исключением пациентов с однократным выделением копрокультуры холерных вибрионов.
Больные холерой получают щадящее питание спустя 3—4 ч после завершения регидратации, грудное вскармливание детей не прекращается, однако проводится с сокращением длительности и увеличением частоты кормлений.
Выписка реконвалесцентов производится после полного клинического выздоровления и получения отрицательных результатов трехкратного бактериологического исследования испражнений, взятых не ранее 24—36 ч после окончания антибактериального лечения, и однократного бактериологического исследования желчи (первое исследование испражнений проводят после дачи солевого слабительного — 30 г магния сульфата).
В России за реконвалесцентами холеры устанавливается диспансерное наблюдение в течение 1 года с регулярным бактериологическим исследованием испражнений: ежедекадно в течение 1-го месяца, ежемесячно в последующие 5 мес, ежеквартально до конца года.
Профилактика. Мероприятия по предупреждению холеры проводятся в соответствии с Международными медико-санитарными Правилами. За лицами, прибывающими из неблагополучных по холере очагов, устанавливается медицинское наблюдение в течение 5 дней с однократным бактериологическим исследованием испражнений.
В эпидемических очагах холеры наряду с госпитализацией больных и вибриононосителей осуществляется изоляция контактных лиц с трехкратным их бактериологическим обследованием в течение 5 дней, в очаге проводится дезинфекция хлорсодержащими препаратами.
В предупреждении холеры важную роль играют совершенствование системы водоснабжения, контроль за продовольствием, повышение уровня санитарно-гигиенического образования и обеспечения населения.
Специфическая профилактика холеры возможна с помощью холерогена-анатоксина, оральных противохолерных вакцин. Однако в связи с кратковременностью поствакцинального иммунитета (3—6 мес) после использования современных вакцин, создающих «ложную уверенность в защищенности от болезни», в настоящее время ВОЗ не рекомендует широкое применение вакцинопрофилактики холеры. Изучается эффективность более совершенных противохолерных вакцин, создаваемых на основе генноинженерных технологий.
САЛЬМОНЕЛЛ ЕЗ
Сальмонеллез (Salmonellosis) — острая кишечная зоонозная инфекция, вызываемая многочисленными бактериями из рода сальмонелл, характеризующаяся преимущественным поражением желудочно-кишечного тракта и протекающая чаще всего в виде гастроинтестинальных, реже — генерализованных форм.
Исторические сведения. Заболевания, эпидемиологически и клинически подобные сальмонеллезу, известны врачам давно. В 1885 г. Д. Е. Сальмон и Дж. Смит выделили В. suipestifer—возбудителя, как они считали, чумы свиней. В 1888 г. А. Гертнер в органах умершего человека и мясе, употреблявшемся в пищу, обнаружил микроб, близкий по свойствам В. suipestifer, обосновав тем самым бактериальную этиологию сальмонеллеза у людей и животных.
В дальнейшем стали появляться сообщения о выделении ряда микроорганизмов, сходных по морфологическим и биохимическим свойствам с бактериями Сальмона и Гертнера. Все они были объединены в группу паратифозных микробов и в 1934 г. получили название сальмонелл.
Этиология. Возбудители сальмонеллеза относятся к роду Salmonella, семейству кишечных бактерий Enterobacteriaceae. Морфологически сальмонеллы представляют собой палочки с закругленными концами размером (1,0—3,0) х (0,2—0,8) мкм. Они, за небольшим исключением, подвижны, имеют жгутики по всей поверхности клетки (перитрихи). Спор и капсул не образуют, грамотрицательны. Растут на обычных питательных средах.
Сальмонеллы способны продуцировать экзотоксины. Среди них — энтеротоксины (термолабильный и термостабильный), усиливающие секрецию жидкости и солей в просвет кишки, и цитотоксин, нарушающий белковосинтетические процессы в клетках слизистой оболочки кишечника и воздействующий на цитомембраны.
При разрушении бактерий выделяется эндотоксин, что обусловливает развитие интоксикационного синдрома.
Антигенная структура сальмонелл сложна. Они содержат О- и Н-антигены. О-антитен связан с соматической субстанцией клетки, термостабилен, одним из его компонентов является Vi-антиген;
Н-антиген обладает жгутиковым аппаратом, термолабилен. Антигенная структура положена в основу Международной серологической классификации сальмонелл (схема Кауфмана—Уайта). Различия в строении О-антигенов позволили выделить серологические группы А, В, С, D, Е и др. На основании различий в строении Н-антигенов внутри каждой группы установлены серологические варианты. Описано более 2200 серологических вариантов сальмонелл, из них у человека более 700. Наиболее часто встречаются следующие сальмонеллы: S. typhimurium, S. heidelberg, S. enteritidis, S. anatum, S. derby, S. london, S. panama, S. newport.
Сальмонеллы относительно устойчивы к воздействию различных факторов внешней среды, некоторые из них не погибают при замораживании до —82 "С и хорошо переносят высушивание. На различных предметах при комнатной температуре они сохраняются 45—90 дней, в сухих испражнениях животных — до 3—4 лет. В воде, особенно при низком рН, сальмонеллы выживают 40—60 дней. В молочных и готовых мясных продуктах сальмонеллы не только сохраняются до 4 мес, но и размножаются, не изменяя органолептических свойств и внешнего вида продуктов. Сальмонеллы устойчивы к солению, копчению и действию кислот. Для разрушения бактерий требуется качественно проводимая термическая обработка. Так, для полной инактивации сальмонелл, находящихся в куске мяса массой 400 г, необходимо варить его не менее 2,5 ч.
Эпидемиология. Источником инфекции могут быть животные и люди, причем роль животных в эпидемиологии является основной. Сальмонеллез у животных встречается в формах клинически выраженного заболевания и бактериовыделительства. Будучи внешне здоровыми, они могут выделять возбудителей с мочой, калом, молоком, носовой слизью, слюной. Длительность бактериовыделительства у животных может быть различной и нередко исчисляется месяцами и годами. Наибольшую эпидемиологическую опасность представляет инфицирование крупного рогатого скота, свиней, овец, лошадей. Сальмонеллезное бактериовыделительство выявлено также у собак, кошек, домовых грызунов (мыши и крысы), у многих видов диких животных: лис, бобров, волков, песцов, медведей, тюленей, обезьян и др.
Значительное место в эпидемиологии сальмонеллеза занимают птицы (часто бройлерные куры) и особенно водоплавающие, которые служат мощным резервуаром различных типов сальмонелл. Сальмонеллы обнаруживают не только в мясе и внутренних органах птиц, но и в яйцах. Инфицированные яйца по внешнему виду, запаху и вкусовым качествам не отличаются от нормальных. В связи с этим не рекомендуется употребление в пищу сырых яиц, особенно утиных и гусиных. Сальмонеллы обнаружены и в продуктах, приготовленных из сырых яиц (яичный порошок). Заболевание сальмонел-лезом и выделение возбудителей отмечаются также среди голубей, воробьев, чаек и других видов птиц. Имеются данные о выделении сальмонелл у ящериц, черепах, змей, лягушек, рыб, раков и крабов.
Источниками сальмонеллеза могут быть больные сальмонеллезом люди или бактериовыделители, но их эпидемиологическую роль надо оценить как второстепенную. Наибольшее значение в этом случае имеют лица, относящиеся к категории пищевиков.
Механизм передачи возбудителей — фекально-оральный. Основной путь передачи инфекции — пищевой. Факторами передачи сальмонелл являются пищевые продукты. К ним относится мясо животных или птиц. Инфицирование мяса происходит эндогенно (при жизни животного во время его болезни), а также экзогенно, в процессе транспортировки, переработки, хранения. Нередко инфицирование продуктов питания происходит при их неправильной кулинарной обработке, приготовлении пищи на загрязненных столах и с использованием инфицированной посуды.
В определенных условиях (тесное общение с больным человеком или животными) при несоблюдении элементарных санитарно-гигиенических норм может реализоваться контактно-бытовой путь передачи. Этот путь отмечается, например, при внутрибольничных вспышках сальмонеллеза, вызываемых, как правило, S. typhimurium. Заболевание регистрируется преимущественно у детей до 1 года. Возможны водный и в редких случаях пылевой (при заглатывании пыли) пути передачи инфекции.
Наиболее восприимчивы к сальмонеллезу дети в возрасте до 1 года и лица с различными видами иммунодефицита. Последнее объясняет большую частоту развития сальмонеллеза у людей с тяжелой соматической патологией и служит предпосылкой для вспышек заболевания среди госпитализированных больных. В этом случае сальмонеллез рассматривается как внутрибольничная инфекция. Возбудители последних отличаются некоторыми биологическими особенностями, в первую очередь высокой полирезистентностью к химиотера-певтическим средствам. Такие штаммы (клоны) сальмонелл получили название госпитальных.
Сальмонеллез встречается в течение всего года, но чаще — в летние месяцы, что можно объяснить ухудшением условий хранения пищевых продуктов. Наблюдается как спорадическая, так и групповая заболеваемость этой инфекцией.
Патогенез и патологоанатомическая картина. При попадании в желудочно-кишечный тракт сальмонеллы преодолевают эпителиальный барьер тонкого отдела кишечника и проникают в толщу тканей, где захватываются макрофагами. Внутри макрофагов бактерии не только размножаются, но и частично погибают с освобождением эндотоксина, поражающего нервно-сосудистый аппарат кишечника и повышающего проницаемость клеточных мембран. Это способствует дальнейшему распространению сальмонелл по лимфатическим путям и проникновению их в мезентериальные лимфатические узлы.
Наряду с местным действием, эндотоксин обусловливает развитие симптомов общей интоксикации организма. В этой стадии инфекционный процесс, приобретая локализованную (гастроинтестинальную) форму, может завершиться. Однако даже при локализованных формах инфек ции возбудитель может поступать в кровь, правда, бактериемия при этом бывает кратковременной.
При глубоком нарушении барьерной функции лимфатического аппарата кишечника происходит генерализация процесса и возникает длительная бактериемия, что клинически соответствует развитию генерализованной формы сальмонеллеза.
В результате бактериемии сальмонеллы заносятся в различные внутренние органы, вызывая в них дистрофические изменения или формирование вторичных гнойных очагов (септико-пиемический вариант).
В основе повышения секреции жидкости в кишечнике лежит механизм активации аденилциклазы и гуанилциклазы энтероцитов сальмонеллезным энтеротоксином с последующим нарастанием внутриклеточной концентрации биологически активных веществ (цАМФ, цГМФ и др.). Это влечет за собой поступление в просвет кишечника большого количества жидкости, калия, натрия и хлоридов. У больных возникают рвота и понос. Развиваются симптомы дегидратации и деминерализации организма, в сыворотке крови снижается уровень натрия, хлоридов и калия. Дегидратация приводит к гипоксии тканей с нарушением клеточного метаболизма, что в сочетании с электролитными изменениями способствует развитию ацидоза. В тяжелых случаях появляются олигурия и азотемия. Эти патологические явления особенно выражены при развитии дегидратационного (чаще), инфекционно-токсического и смешанного шоков.
Патоморфологические изменения при сальмонеллезах разнообразны, зависят от формы, степени тяжести и длительности заболевания. Выраженность патологоанатомических изменений не всегда соответствует тяжести течения болезни.
При гастроинтестинальной форме заболевания морфологически преобладают катаральное воспаление во всех отделах желудочно-кишечного тракта. Макроскопически в кишечнике обнаруживают резкое полнокровие с кровоизлияниями различной величины, отек слизистой оболочки, иногда с поверхностными некрозами и нежным отрубевидным налетом. Лимфатический аппарат кишечника может быть не изменен, селезенка не увеличена. Во всех остальных органах наблюдаются резкое полнокровие и дистрофические изменения. Микроскопически в кишечнике выявляются сосудистые изменения с кровоизлияниями в слизистую оболочку и подслизистую основу. В подслизистой основе отмечается нарушение микроциркуляции с реактивной лейкоцитарной реакцией и выраженным отеком тканей.
При генерализованной форме заболевания с септическими проявлениями в желудочно-кишечном тракте наблюдаются небольшое полнокровие и мелкие кровоизлияния. Во внутренних органах могут быть множественные метастатические гнойники. Выражены диффузия и очаговая пролиферация клеток ретикулоэндотелиальной системы. Из пиемических абсцессов высевают сальмонеллы, нередко в ассоциации с другими микроорганизмами (стафилококки, протей).
При тифоподобном течении сальмонеллеза увеличены селезенка, брыжеечные лимфатические узлы. В кишечнике — набухание, полнокровие и кровоизлияния в слизистой оболочке нижнего отдела тонкой кишки, особенно в групповых лимфатических фолликулах.
Клиническая картина. Инкубационный период при сальмо-неллезе в среднем составляет 12—24 ч. Иногда он укорачивается до 6 ч или удлиняется до 2 дней. Выделяют следующие формы и варианты течения инфекции:
I. Гастроинтестинальная форма:
1) гастритический вариант; 2) гастроэнтеритический вариант; 3) гастроэнтероколитический вариант.
II. Генерализованная форма:
1) тифоподобный вариант; 2) септикопиемический вариант.
III. Бактериовыделение:
1) острое; 2) хроническое; 3) транзиторное.
Гастроинтестинальная форма встречается наиболее часто. При этой форме заболевание может протекать с клинической картиной гастрита, гастроэнтерита и гастроэнте-роколита.
Сальмонеллезный гастрит развивается редко, клинически сопровождается умеренными явлениями интоксикации, болями в эпигастральной области, тошнотой, повторной рвотой. Поноса при этом варианте течения болезни не бывает.
Гастроэнтеритический вариант — наиболее частый клинический вариант сальмонеллезной инфекции. Начало заболевания острое. Почти одновременно появляются симптомы интоксикации и признаки поражения желудочно-кишечного тракта, которые быстро, в течение нескольких часов, достига-' ют максимального развития. Тошнота и рвота отмечаются у многих больных. Рвота редко однократная, чаще повторная, обильная, иногда неукротимая. Стул жидкий, обильный, как правило, сохраняет каловый характер, зловонный, пенистый, коричневого, темно-зеленого или желтого цвета. Иногда испражнения теряют каловый характер и могут напоминать рисовый отвар. Живот обычно умеренно вздут, при пальпации болезнен в эпигастрии, вокруг пупка, в илеоцекальной области; могут выявляться урчание, «переливание» в области петель тонкой кишки.
Гастроэнтероколитический вариант сальмонеллеза может начаться как гастроэнтерит, но затем все более отчетливо в клинической картине выступает симптомокомплекс колита. В этом случае сальмонеллез по своему течению напоминает острую дизентерию. Заболевание начинается остро, с подъема температуры тела и появления других симптомов интоксикации. С первых дней болезни стул частый, жидкий, с примесью слизи и иногда крови. Могут быть тенезмы и ложные позывы. При ректороманоскопии у таких больных выявляются воспалительные изменения различной интенсивности: катаральные, катарально-геморрагические, катарально-эрозивные.
При гастроинтестинальной форме сальмонеллеза не удается определить какого-либо характерного типа температурной кривой. Встречается постоянный, реже ремиттирующий или интермиттирующий тип лихорадки. Иногда заболевание протекает при нормальной или субнормальной температуре. В патологический процесс при гастроинтестинальной форме сальмонеллеза часто вовлекается поджелудочная железа. Повышается активность амилазы в крови и моче. Иногда появляются клинические симптомы панкреатита. При сальмонеллезе рано возникает поражение печени, особенно в период максимальной токсинемии. У части больных выявляют увеличение печени, иногда субиктеричность склер. Симптомы поражения поджелудочной железы и печени носят, как правило, преходящий характер.
Нередко поражается нервная система, что обусловлено действием эндотоксина сальмонелл, биологически активных веществ (типа гистамина). Отмечаются головная боль, головокружение, обморочное состояние. Поражение вегетативной нервной системы проявляется симптомами гипермоторной (спастической) дискинезии желудка и кишечника.
Нарушения сердечно-сосудистой деятельности развиваются у большинства больных. Степень ее поражения зависит от выраженности общего токсикоза. Изменяются частота, наполнение и напряжение пульса, снижается артериальное давление. В тяжелых случаях наступает коллапс, иногда очень быстро, в первые часы болезни, еще до развития обезвоживания. В результате интоксикации и сосудистой недостаточности происходят дистрофические изменения в мышце сердца. Тоны сердца приглушенные или глухие, появляется систолический шум, могут возникать аритмии (чаще всего экстрасистолия). Особенно часто эти симптомы выражены у лиц пожилого возраста, что связано со снижением у них адаптационной способности сердечно-сосудистой системы.
Токсическое поражение почечной паренхимы проявляется, как правило, протеинурией, микрогематурией, цилиндрурией. В очень тяжелых случаях, в условиях выраженной интоксикации, падения сердечно-сосудистой деятельности, развития коллапса и значительных электролитных расстройств возникает острая почечная недостаточность.
Картина периферической крови при гастроинтестинальной форме сальмонеллеза различна. При большой потере жидкости развивается сгущение крови и возможен эритроцитоз. Изредка развивается симптоматическая тромбоцитопения. Количество лейкоцитов может быть различным — нормальным, сниженным, но чаще повышенным, особенно при тяжелом течении сальмонеллеза. Лейкоцитоз обычно умеренный, редко превышает 20 * 109/л. С большим постоянством выявляется сдвиг лейкоцитарной формулы влево. СОЭ в пределах нормы или несколько увеличена. В разгар болезни возможны нарушения водно-солевого обмена, приводящие к дегидратации и деминерализации организма. Обнаруживаются сдвиги в кислотно-основном балансе, однако выявляются они лишь в самых тяжелых случаях.
По течению гастроинтестинальная форма сальмонеллеза может быть легкой, средней тяжести и тяжелой. При легком течении интоксикация умеренная, отмечаются недомогание, небольшая слабость, познабливание. Температура тела кратковременно повышается до субфебрильных цифр. Рвоты может не быть или она однократная, боли в животе незначительные или отсутствуют, стул кашицеобразный или жидкий 1—3 раза в сутки, быстро нормализуется.
Средней тяжести течение сопровождается интоксикацией, температура тела повышается до 39—40 °С. Отмечаются слабость, головная боль, головокружение, обморочное состояние, судороги в конечностях. Больные жалуются на боли в животе, локализация которых зависит от степени выраженности гастрита, энтерита или колита. Рвота мучительная, многократная, вначале съеденной пищей, затем желчью или мутной жидкостью. Стул до 10 раз в сутки, обильный, при гастроэнтероко-литическом варианте — слизистый. Спустя 2—4 дня состояние больного улучшается, боли в животе исчезают, температура тела и функции желудочно-кишечного тракта нормализуются.
При тяжелом течении симптомы интоксикации достигают максимального развития в первые же часы заболевания. Температура тела быстро повышается до 39—40 °С и сопровождается ознобом. Лихорадка чаще всего носит постоянный характер с незначительными суточными колебаниями; реже она принимает ремиттирующий характер. В очень тяжелых случаях развивается гипер- или гипотермия, что особенно неблагоприятно в прогностическом отношении, так как свидетельствует о возникновении резко выраженного нейротоксикоза или острой сосудистой недостаточности. Одновременно с развитием симптомов интоксикации или несколько позже появляются сильные режущие боли в животе, мучительная тошнота, затем обильная, повторная, иногда неукротимая рвота. Стул 10—20 раз в сутки, обильный, водянистый, зловонный, иногда по виду напоминает рисовый отвар. При вовлечении в процесс толстой кишки стул может быть со слизью, редко с кровью. Развиваются симптомы дегидратации, деминерализации и связанного с ними ацидоза. Больные выглядят обессиленными. Кожные покровы бледные, с синюшным оттенком, сухие, лицо осунувшееся, голос слабый, бывают судороги (от тянущих болей в крупных мышцах до тотальных клониче-ских), возможны олигурия и анурия. При таком состоянии необходимы реанимационная дезинтоксикационная терапия, быстрая регидратация и реминерализация.
Тифоподобный вариант генерализованной формы сальмонеллеза обычно начинается с поражения желудочно-кишечного тракта, но может с самого начала протекать без дисфункции кишечника. Клинически он весьма напоминает брюшной тиф и особенно паратифы. Синдром интоксикации резко выражен и сопровождается угнетением центральной нервной системы. Больные жалуются на головную боль, извращение сна (сонливость днем и бессонница ночью), вялость, резкую слабость. В тяжелых случаях они становятся безразличными, адинамичными, сознание помрачено, возможны бред и галлюцинаторный синдром. Лихорадка с температурой, достигающей 39—40 °С, часто носит постоянный характер. Длительность лихорадочного периода колеблется от 6—10 дней до 3—4 нед.
Кожные покровы больных обычно бледные, может появляться сыпь. Она, как правило, плохо заметна и представлена единичными мелкими бледными розеолами на коже живота и туловища. Пульс чаще замедлен. Артериальное давление снижено. В ряде случаев появляется кашель, изредка развиваются бронхиты и пневмонии. К концу 1-й недели заболевания заметно увеличение печени и селезенки. В периферической крови находят лейкопению, анэозинофилию с нейтрофиль-ным сдвигом влево, но может наблюдаться и умеренный лейкоцитоз.
Септикопиемический вариант сальмонеллеза с самого начала развивается как сальмонеллезный сепсис. Но иногда у больного гастроинтестинальной формой сальмонеллеза дисфункция кишечника прекращается, однако нарастает интоксикация. Заболевание теряет цикличность, температурная кривая принимает неправильный, ремиттирующий характер, появляются потрясающий озноб и профузный пот —сальмонеллез принимает септическое течение. Клиническая картина зависит от локализации метастатических гнойных очагов, которые могут возникать во всех органах. Всегда выявляется увеличение печени и селезенки. Типично длительное тяжелое течение. Лечение представляет значительные трудности, возможен неблагоприятный исход.
Бактериовыделение как следствие перенесенного сальмонеллеза может быть острым или хроническим. Острое бактериовыделение, при котором возбудитель продолжает выделяться до 3 мес после клинического выздоровления, встречается значительно чаще, чем хроническое.
При хроническом бактериовыделении возбудитель обнаруживается в испражнениях более 3 мес после клинического выздоровления.
Транзиторное бактериовыделение диагностируется в тех случаях, когда имеется лишь одно-двукратное выделение сальмонелл с последующими многократными отрицательными результатами бактериологического исследования кала и мочи. Кроме того, необходимыми для диагностики транзиторного бактериовыделения условиями являются отсутствие каких-либо клинических проявлений болезни в момент обследования и на протяжении предшествующих 3 мес, а также отрицательные результаты серологического исследования, выполненные в динамике.
Осложнения. Осложнения сальмонеллеза многочисленны и разнообразны. При гастроинтестинальной форме заболевания возможно развитие сосудистого коллапса, гиповолемического шока, острой сердечной и почечной недостаточности. Больные сальмонеллезом склонны к септическим осложнениям, из которых встречаются гнойные артриты, остеомиелиты, эндокардиты, абсцессы мозга, селезенки, печени и почек, менингиты, перитониты, аппендициты. Кроме того, могут возникнуть пневмонии, восходящая инфекция мочевыводящих путей (циститы, пиелиты), инфекционно-токсический шок. При всех клинических формах заболевания возможно развитие рецидивов.
Прогноз. При гастроинтестинальной форме и тифоподоб-ном варианте сальмонеллеза благоприятный, особенно в случаях ранней диагностики и правильного лечения. Прогноз при септикопиемическом варианте всегда крайне серьезный.
Диагностика. Диагностика сальмонеллеза проводится на основании эпидемиологических, клинических и лабораторных данных. Лабораторное обследование больных — важное звено в диагностике, особенно если учесть полиморфизм клинических проявлений. Применяют бактериологические и серологические методы исследования. Бактериологическому исследованию подвергают рвотные массы, промывные воды желудка, испражнения, дуоденальное содержимое, кровь, мочу, в редких случаях гной из воспалительных очагов и цереброспинальную жидкость. Материал у больного следует брать по возможности в более ранние сроки и до ндчала лечения.
При серологических исследованиях (7—8-й день болезни) применяют реакции агглютинации (РА) и чаще непрямой гемагглютинации (РНГА).
РА считается положительной при разведении сыворотки не менее чем 1:200. Особенно важное диагностическое значение имеет нарастание титра антител в динамике заболевания. РНГА более чувствительна и дает положительные результаты с 5-го дня болезни. За диагностический принимают титр антител в РНГА 1:200.
При групповых заболеваниях сальмонеллезом используют методы экспресс-диагностики: МФА РНГА с антительными диагностикумами и др.
Для определения антител, относящихся к различным классам иммуноглобулинов (М, G), широко используют иммуно-ферментные методы. Разработаны методы обнаружения антигенов сальмонелл в крови (агрегатгемагглютинации и иммуно-ферментный) и иммуноферментный метод выявления антигенов этих возбудителей в моче.
Дифференциальная диагностика. Зависит от клинической формы заболевания. Наиболее часто гастроинтестинальную форму приходится дифференцировать от других острых кишечных инфекций — дизентерии, пищевых токсикоинфекций, эшерихиозов, холеры. Нередко возникает необходимость дифференцировать эту форму от острых хирургических заболеваний — острого аппендицита, панкреатита, холецистита, тромбоза мезентериальных сосудов и острой гинекологической патологии — внематочной беременности и аднексита; из терапевтической патологии — от инфаркта, обострений хронического гастрита, энтероколита, язвенной болезни. Встречаются затруднения также при дифференциальной диагностике гастроинтестинальной формы сальмонеллеза и отравлений неорганическими ядами, ядохимикатами, грибами, некоторыми растениями.
Генерализованную форму сальмонеллеза следует дифференцировать от других бактериемических инфекций, сепсиса различной природы, гриппа, пневмонии, малярии, острого пиелонефрита, туберкулеза, лимфогранулематоза.
Лечение. Сложность патогенетических механизмов при сальмонеллезе, многообразие клинических форм болезни диктуют необходимость индивидуального подхода к лечению.
В настоящее время неизвестны достаточно эффективные химиотерапевтические препараты (в том числе антибиотики) для лечения гастроинтестинальной формы сальмонеллезной инфекции. При этой форме заболевания основными являются способы патогенетической терапии. Главными направлениями патогенетической терапии сальмонеллеза являются следующие: 1) дезинтоксикация: 2) нормализация водно-электролитного обмена; 3) борьба с гипоксемией, гипоксией, метаболическим ацидозом; 4) поддержание на физиологическом уровне гемодинамики, а также функций сердечно-сосудистой системы и почек.
Всем больным с гастроинтестинальной формой сальмонеллеза в первые часы болезни показано промывание желудка. Для быстрейшего купирования диареи используют препараты кальция (кальция глюконат, лактат, глицерофосфат) в качестве активатора фосфодиэстеразы — фермента, препятствующего образованию цАМФ. Доза кальция глюконата (лактата, глицерофосфата) — до 5 г в сутки — принимается за один прием. Из других средств, купирующих секреторную диарею, применяют нестероидные противовоспалительные средства, например индометацин до 50 мг 3 раза в течение 12 ч. Одновременно с ними для защиты слизистой оболочки кишечника назначают цитопротекторы типа полисорба МП.
Больные с легким течением болезни не нуждаются в широком комплексе терапевтических мероприятий. Следует ограничиться назначением им диеты (№ 4) и обильного дробного питья. Для пероральной регидратации могут быть использованы глюкозо-электролитные растворы «Оралит», «Цитраглюко-солан», «Регидрон». Их дают пить небольшими порциями в количестве, соответствующем потерям жидкости.
При средней тяжести течения гастроинтестинальной формы сальмонеллеза, но без выраженных нарушений гемодинамики и редкой рвоте, также проводится пероральная регидратация. Однако при нарастании обезвоживания, выраженных нарушениях гемодинамики, частой (неукротимой) рвоте полиионные растворы вводят внутривенно. После возмещения первоначальных потерь жидкости и при отсутствии рвоты пероральная регидратация может быть продолжена.
При тяжелом течении болезни лечение проводят в режиме интенсивной терапии и реанимации. Для осуществления указанных выше принципов патогенетической терапии обязательным является внутривенное введение полиионных растворов. Объем их зависит от количества жидкости, теряемой с испражнениями, рвотными массами и мочой, а также от степени интоксикации, составляя в сутки от 4 до 8 л. В инфузи онной терапии используются растворы «Трисоль», «Ацесоль», «Лактасоль», «Квартасоль», «Хлосоль» и др.
При развитии дегидратационного шока проводят реанимационную терапию, как при тяжелых формах холеры.
При возникновении инфекционно-токсического шока, кроме полиионных, вводят коллоидные растворы (гемодез, реополиглюкин) и глюкокортикостероиды.
В комплексе патогенетических мероприятий, особенно при затяжном течении болезни, большое значение имеет стимулирующая терапия. Такие препараты, как поливитамины, ме-тилурацил, калия оротат, повышают резистентность организма к инфекции, способствуют регенерации тканей, стимулируют выработку иммунитета.
Антибактериальная терапия, включающая антибиотики, сульфаниламидные и другие химиопрепараты, малоэффективна. Одной из главных причин этого является преимущественно внутриклеточное расположение микроорганизмов, свойственное гастроинтестинальной форме сальмонеллеза.
При генерализованной форме наряду с патогенетической терапией показано этиотропное лечение, включающее антибиотики. Курс лечения назначается индивидуально, в зависимости от формы и тяжести болезни. Применяют сочетания антибиотиков группы аминогликозидов (гентамицина сульфат, сизомицина сульфат, амикацина сульфат, тобрамицин и др.) и хинолонов (ципрофлоксацин, офлоксацин и т. п.), цефалоспорины. При возможности проводят хирургическую санацию очагов.
Нерешенной проблемой является лечение больных с длительным выделением сальмонелл. Как правило, штаммы возбудителя, вызвавшие бактериовыделение, резистентны практически ко всем антибиотикам. В ряде случаев удается получить эффект при лечении больных хинолоновыми препаратами, особенно в сочетании с инъекциями продигиозана или другого бактериального липополисахарида (3—5 инъекций на курс).
В комплексном лечении больных сальмонеллезом применяется также поливалентный сальмонеллезный бактериофаг.
Особое внимание при лечении больных сальмонеллезом необходимо уделять сопутствующей патологии, а также санации хронических очагов инфекции.
Профилактика. Профилактика сальмонеллеза включает ве-теринарно-санитарные, санитарно-гигиенические и противоэпидемические мероприятия. Ветеринарно-санитарные мероприятия направлены на предупреждение распространения сальмонеллеза среди домашних млекопитающих и птиц, а также на организацию санитарного режима на мясокомбинатах и молочных предприятиях. Цель санитарно-гигиенических мероприятий — предупреждение обсеменения сальмонеллами пищевых продуктов при их обработке, транспортировке и продаже. Большое значение в борьбе с сальмонеллезом имеет правильная кулинарная и оптимальная термическая обработка пищевых продуктов. Противоэпидемические мероприятия направлены на предупреждение распространения заболевания в коллективе. При возникновении спорадических заболеваний и эпидемических вспышек необходимо выявить пути передачи инфекции и подвергнуть бактериологическому обследованию подозрительные пищевые продукты, рвотные массы, промывные воды, кровь и испражнения заболевших. В очагах заболевания проводится текущая и заключительная дезинфекция. Больных госпитализируют по клиническим и эпидемиологическим показаниям. Переболевших выписывают после клинического выздоровления и отрицательных контрольных бактериологических исследований испражнений.
В случае возникновения внутрибольничной вспышки сальмонеллеза устанавливается особый режим работы лечебно-профилактического учреждения, который регламентируется соответствующими инструкциями. Важнейшую роль в преодолении внутрибольничного сальмонеллеза играют согласованные действия эпидемиологической службы, администрации стационара, врачей, всего медицинского персонала и бактериологической лаборатории.
ПИЩЕВЫЕ ТОКСИКОИНФЕКЦИИ
Пищевые токсикоинфекции (ПТИ) — это острые, кратковременные заболевания, вызываемые условно-патогенными бактериями, способными продуцировать экзотоксины вне организма человека (в продуктах питания) и протекающие с симптомами поражения верхних отделов желудочно-кишечного тракта (гастрит, гастроэнтерит) и нарушениями водно-солевого обмена.
Исторические сведения. Еще в древности было известно, что употребление пищевых продуктов в ряде случаев может явиться причиной заболеваний, сопровождающихся рвотой и поносом. Предполагалось, что в основе этого лежат несовместимость пищевых продуктов, болезнетворные природные свойства или содержание в них ядовитых веществ. В позапрошлом веке было подмечено, что некоторые «пищевые отравления» связаны с употреблением мяса бол>ных животных [Пекин М., 1812; Боллингер О., 1876, и др.]. В дальнейшем было установлено, что подобные заболевания могут вызывать инфицированные условно-патогенными бактериями и их токсинами продукты питания животного и неживотного происхождения. Одно из первых описаний клинической картины стафилококковой пищевой интоксикации принадлежит П. Н. Лащенкову (1901). К настоящему времени имеется большое количество сведений о роли условно-патогенной микрофлоры и продуцируемых ею экзотоксинов в развитии пищевых отравлений. Эти данные позволяют считать, что в отличие от других инфекционных заболеваний для возникновения пищевых отравлений обязательными условиями являются не только присутствие в пищевых продуктах микроорганизмов, но, главное, накопление в них достаточной дозы экзотоксинов, продуцируемых бактериями.
Бактериальные пищевые отравления подразделяются на токсикоинфекции и токсикозы (интоксикации). К последним относятся заболевания, вызываемые CI. botulinum и энтеротоксигенными штаммами St. aureus. Из-за выраженного отличия в механизме действия токсина (нейроплегический эффект), выделяемого CI. botulinum, и своеобразия клинической картины ботулизм описывается отдельно. Стафилококковая же интоксикация, близкая по клинической картине пищевым токсикоинфекциям, представлена в данном разделе.
Этиология. К возбудителям ПТИ относят многие виды условно-патогенных бактерий, способных продуцировать экзотоксины в период своей жизнедеятельности вне организма человека в различных пищевых продуктах. Среди экзотоксинов — энтеротоксины (термолабильный и термостабильный), усиливающие секрецию жидкости и солей в просвет желудка и кишки, и цитотоксин, повреждающий мембраны эпителиальных клеток и нарушающий в них белковосин-тетические процессы.
Наиболее частыми возбудителями пищевых токсикоинфекции, способными продуцировать энтеротоксины, являются Clostridium perfringens, Proteus vulgaris, Proteus mirabilis, Bacillus cereus. Энтеротоксины образуются также возбудителями пищевых отравлений, принадлежащими к родам Klebsiella, Enterobacter, Citrobacter, Serratia, Pseudomonas, Aeromonas, Edwardsjella, Vibrio. В большинстве своем энтеротоксины возбудителей пищевых отравлений являются термолабильными.
Выраженными термостабильными свойствами отличается энтеротоксин St. aureus. Он не инактивируется при кипячении до 30 мин (по некоторым данным, до 2 ч) и сохраняет способность в отсутствии самих бактерий вызывать клиническую картину заболевания.
Среди возбудителей ПТИ способностью продуцировать цитотоксин обладают Klebsiella pneumoniae, Enterobacter cloacae, Aeromonas hidrophila, Clostridium perfringens типа G и Clostridium difficile, Vibrio parahaemolyticus, St. aureus и ряд других микроорганизмов.
Следует отметить, что далеко не каждый штамм вышеуказанных бактерий способен к образованию экзотоксинов. Поэтому употребление пищи, содержащей большое число бактерий, еще не ведет само по себе к развитию ПТИ. Заболевание возникает лишь при инфицировании пищи токсинопродуцирующими штаммами бактерий.
Эпидемиология. Возбудители ПТИ широко распространены в природе и встречаются повсюду: в испражнениях людей и животных, в почве, воде, воздухе, на различных предметах; обычно установить источник ПТИ не удается. Однако в некоторых случаях, когда источниками являются лица, работающие в пищевой промышленности и страдающие различными гнойничковыми заболеваниями кожи (пиодермия, панариций, гнойные раны и др.) или ангинами, ринофарин-гитами, ларинготрахеобронхитами, пневмониями, их выявление не только необходимо, но и возможно. Среди зоонозных источников ПТИ могут быть выявлены больные маститом животные — коровы, козы, овцы и др. Механизм передачи этой группы заболеваний — фе-калы ю-оральный.
ПТИ распространяются алиментарным путем. Среди факторов передачи возбудителей — твердые (колбасы, студни, яйца, мясные и рыбные консервы и др.) и жидкие (суп, молоко, соки, компоты, кисели, квас, лимонад, пиво, коктейли и др.) пищевые продукты, являющиеся для бактерий питательной средой. Стафилококковая интоксикация чаще всего связана с употреблением в пищу инфицированного молока и молочных продуктов, кондитерских кремов, мясных, рыбных и овощных блюд. Протей и клостридии хорошо размножаются в белковых продуктах (мясо, рыба, в том числе консервированные, колбаса, молоко). Вас. cereus весьма неприхотлива, бурно размножается в различных пищевых продуктах: овощных салатах и супах, пудингах, мясных и рыбных блюдах.
Восприимчивость к этой группе заболеваний высока. Нередко заболевает 90—100 % людей, употреблявших инфицированный продукт. Характерным для ПТИ является не только групповой, но и эксплозивный (взрывной) характер заболеваемости, при котором в короткое время (за несколько часов) заболевают все участники вспышки.
Заболеваемость ПТИ регистрируется на протяжении всего года, но чаще в теплое время, так как в этот период труднее осуществить безукоризненное хранение приготовленных пищевых продуктов.
Патогенез и патологоанатомическая картина. При пищевых токсикоинфекциях (и интоксикациях) к моменту поступления пищи в желудок в ней, кроме бактерий, содержится значительное количество экзотоксина. Это обусловливает развитие самого короткого в инфекционной патологии инкубационного периода. От момента воздействия токсинов на слизистую оболочку желудка до развития клинической симптоматики в ряде случаев проходит не более 30 мин (чаще 2—6 ч).
Патогенез и клиническая картина ПТИ во многом зависят от вида и дозы экзотоксина, а также других токсичных веществ бактериального происхождения, содержащихся в продукте питания.
Энтеротоксины (термолабильный и термостабильный), связываясь с эпителиальными клетками желудка и кишечника, воздействуют на ферментативные системы эпителиоцитов, не вызывая в этих органах морфологических изменений. Среди активируемых энтеротоксинами ферментов — аденилцик-лаза и гуанилциклаза, повышающие образование в клетках слизистой оболочки биологически активных веществ — цАМФ и цГМФ. Под воздействием токсинов увеличивается также скорость образования простагландинов, гистамина, кишечных гормонов и др. Все это приводит к повышению секреции жидкости и солей в просвет желудка и кишечника и развитию рвоты и поноса.
Цитотоксин повреждает мембраны эпителиальных клеток и нарушает в них белковосинтетические процессы. Это может увеличивать проницаемость кишечной стенки для разного рода токсичных веществ (липополисахариды, ферменты и др.) бактериального происхождения, а в некоторых случаях и самих бактерий. Все это приводит к развитию интоксикации, нарушению микроциркуляции и местным воспалительным изменениям слизистой оболочки.
Таким образом, клинические проявления ПТИ, вызванных возбудителями, способными к продукции лишь энтеротокси-нов, менее тяжелы, заболевания в большинстве случаев протекают без гипертермии и каких-либо значительных воспалительных изменений слизистой оболочки желудка и кишечника. Те же случаи, когда в продуктах питания происходит накопление и энтеротоксинов, и цитотоксинов, протекают несравненно тяжелее, с кратковременной, но высокой лихорадкой, воспалительными изменениями слизистой оболочки желудочно-кишечного тракта
Кратковременный характер течения ПТИ связан с непродолжительным пребыванием их возбудителей в организме человека. Действие же токсинов, связывающихся с эпителиальными клетками желудка и кишечника, прекращается после десквамации этих клеток. Несвязанные молекулы токсина инактивируются протеазами.
Только при определенных условиях, когда в результате предшествующих заболеваний нарушена система антибактериальной зашиты тонкой кишки, возбудители ПТИ могут более длительно находиться в кишечнике. В ряде случаев, как это бывает, например, у больных с недостаточностью питания, после гастрэктомии, при синдроме слепой петли, заселение тонкой кишки CI. perfringens типа С ведет к тяжелому некротическому энтериту.
Патологоанатомическая картина при ПТИ изучена мало. В редких случаях смерти находят отек, гиперемию слизистой оболочки желудка и тонкой кишки, иногда десквамацию эпителия. В остальных органах обнаруживаются дистрофические изменения различной степени, развившиеся в результате интоксикации и нарушения гемодинамики.
Клиническая картина. Инкубационный период продолжается от 30 мин до 24 ч (чаще 2—6 ч). Клиническая картина ПТИ, вызванных различными возбудителями, имеет много общего и представлена сходной симптоматикой. Начало заболевания острое. Появляется тошнота, к которой присоединяется рвота. Рвота редко бывает однократной, чаще она повторная, иногда неукротимая, мучительная, изнуряющая, почти одновременно со рвотой начинается понос. Стул жидкий, водянистый, от I до 10—15 раз в сутки, обычно имеет энтеритный характер и не содержит слизи и крови. У значительной части больных заболевание не сопровождается сколько-нибудь сильными болями в животе и повышением температуры тела. Вместе с тем немалое число случаев ПТИ протекает со схваткообразными болями в эпи- и мезогастрии и кратковременной гипертермией. В клинической картине этих заболеваний, помимо желудочно-кишечной симптоматики, наблюдаются озноб, повышение температуры тела, умеренная головная боль, слабость, недомогание. Повышение температуры до максимума (38—39 °С) происходит в первые часы болезни, а через 12—24 ч она, как правило, снижается до нормы.
Объективно у больных находят бледность кожных покровов, иногда цианоз их, похолодание конечностей. Язык обложен бело-серым налетом. Живот при пальпации мягкий, болезненный в эпигастрии, реже вокруг пупка. Закономерно страдает сердечно-сосудистая система: определяется бради-кардия (при гипертермии—тахикардия), артериальное давление снижено, на верхушке сердца выслушивается систолический шум, тоны сердца глухие. В некоторых случаях развиваются обмороки, кратковременные коллаптовдные состояния. При многократной рвоте и обильном поносе могут появиться симптомы дегидратации, деминерализации и ацидоза. Возможны судороги в мышцах конечностей, снижение диуреза, понижение тургора кожи и т. д. При своевременной адекватной терапии эти явления быстро купируются. Печень и селезенка не увеличены. В гемограмме: лейкоцитоз, нейтрофилез, умеренное повышение СОЭ.
Заболевание в большинстве случаев длится 1—3 дня.
Проявления ПТИ мало зависят от вида возбудителя, однако в отдельных случаях можно обнаружить некоторое этиологически обусловленное своеобразие клинической картины заболевания.
Так, диапазон клинических проявлений болезни, вызванной CI. perfringens, довольно широк. Наряду с легко протекающими заболеваниями, в клинической картине которых доминируют симптомы гастрита или гастроэнтерита, встречаются и тяжелые формы болезни, сопровождающиеся развитием некротического энтерита и анаэробного сепсиса.
При ПТИ, вызванной протеем, испражнения имеют резкий зловонный запах. У некоторых больных возникают кратковременное снижение остроты зрения и другие его нарушения.
Стафилококковая интоксикация нередко протекает без диареи. В клинической картине доминируют симптомы гастрита в виде повторной рвоты, схваткообразных болей в эпига-стральной области. Отмечаются признаки сосудистой дисто-нии. Температура тела у большинства больных нормальная или субфебрильная.
Осложнения. К осложнениям ПТИ относятся дегидратаци-онный шок и острая сердечная недостаточность, связанная с нарушениями электролитного (гипокалиемия) обмена. Другие осложнения (в том числе септического характера) встречаются редко и во многом зависят от неблагоприятного преморбид-ного состояния больного.
Прогноз. Обычно благоприятный. Смертельные исходы наблюдаются редко и обусловлены такими осложнениями, как дегидратационный шок, острая сердечная недостаточность, некротический энтерит, анаэробный сепсис.
Диагностика. Наибольшее значение в диагностике ПТИ имеют следующие клинико-эпидемиологические данные: 1) острое начало и доминирование в клинической картине симптомов гастрита (или гастроэнтерита); 2) отсутствие гипертермии или ее кратковременный характер; 3) короткий инкубационный период и непродолжительность самого заболевания; 4) групповой характер заболеваемости и ее связь с употреблением одного и того же пищевого продукта; 5) эксплозивный (взрывной) характер заболеваемости.
В лабораторной диагностике ПТИ большое значение имеет бактериологический метод, включающий изучение токсиген-ных свойств выделенных возбудителей. Материалом для исследования служат рвотные массы, промывные воды желудка, испражнения больного, остатки несъеденной пищи и др. При ПТИ выделение у больного того или иного микроорганизма еще не позволяет считать его возбудителем болезни. Необходимо доказать его идентичность со штаммами, которые были выделены у одновременно заболевших, а также с теми, которые получены из загрязненного продукта.
Серологический метод в диагностике ПТИ самостоятельного значения не имеет, так как доказательным является лишь нарастание титра антител к аутоштамму выделенного микроорганизма.
Дифференциальная диагностика. ПТИ следует дифференцировать от острых кишечных инфекций и обострений хронических заболеваний органов желудочно-кишечного тракта, других видов отравлений, хирургических заболеваний органов брюшной полости, гинекологической патологии, инфаркта миокарда, заболеваний ЦНС.
Лечение. При установлении клинико-эпидемиологического диагноза ПТИ необходимо произвести тщательное и многократное промывание желудка до получения чистых промывных вод. Промывание осуществляется 2—4 % раствором натрия гидрокарбоната или 0,1 % раствором калия пермангана-та. При выраженной диарее назначают активированный уголь или другие адсорбенты (полифепан, карбонат кальция). В случае отсутствия стула делают встречную высокую клизму типа сифонной. Ускоряют купирование диареи препараты кальция (глюконат, лактат, глицерофосфат) по 5,0 г на прием.
Дальнейшая терапия производится с учетом степени дегидратации организма больного. При обезвоживании I—II степени (потеря массы тела до 3—6 %) и отсутствии неукротимой рвоты проводится пероральная регидратация глюкозо-элек-тролитными растворами (см. «Холера»). В тяжелых случаях заболевания при дегидратации III—IV степени (потеря массы тела более 6 %) показано внутривенное введение полиионных растворов «Квартасоль», «Ацесоль», «Лактасоль», «Трисоль» и др.
Назначение антибиотиков, сульфаниламидных и других хи-миопрепаратов при неосложенном течении ПТИ нецелесообразно.
Во время заболевания и в период реконвалесценции важное значение имеет дието- и витаминотерапия.
Профилактика. Залогом успешной борьбы с ПТИ является широкое проведение государственных мероприятий: создание современных, механизированных и автоматизированных предприятий пищевой промышленности, разработка и внедрение в практику новых методов консервирования и хранения скоропортящихся продуктов.
Большое значение имеют усиление требований к качеству пищевых продуктов, действенная и повсеместно существующая санитарная служба на предприятиях пищевой промышленности, общественного питания и торговли.
Важнейшей профилактической мерой при стафилококковой интоксикации является отстранение от работы лиц с гнойничковыми заболеваниями кожи, ангинами и т. д., соприкасающихся с продуктами питания (работники пищевых предприятий, столовых, продовольственных магазинов). Большая ответственность лежит на ветеринарной службе, осуществляющей надзор за здоровьем молочного скота.
БОТУЛИЗМ
Син.: аллантиазис, ихтиизм
Ботулизм (Botulismus) — тяжелое токсико-инфекционное заболевание, характеризующееся поражением ботулотокси-ном нервной системы, преимущественно продолговатого и спинного мозга, протекающее с преобладанием офтальмо-плегического и бульбарного синдромов.
Исторические сведения. Название болезни происходит от латинского слова botulus —колбаса. Первое клинико-эпицемиологическое описание заболевания было сделано врачом и поэтом Ю. Кернером в 1820 г. В России эта болезнь неоднократно описывалась в XIX в. под названием «ихтиизм» и связывалась с употреблением соленой и копченой рыбы. В 1896 г. Э. Ван-Эрменгем выделил из остатков ветчины и из кишечника погибшего больного возбудитель и назвал его Bacillus botulinum.
Этиология. Возбудитель ботулизма CI. botulinum относится к роду Clostridium, семейству Bacillacea. Это анаэробная, подвижная вследствие наличия жгутиков, спорообразуюшая палочка размерами (4—9) х (0,6—0,9) мкм. Известно 7 типов возбудителя — А, В, С (Сц и Ср), D, Е, F, G, различающихся по антигенной структуре выделяемого токсина. В России встречаются преимущественно типы А, В, Е.
Возбудители ботулизма широко распространены в природе, обитают в почве. Наиболее благоприятная среда для размножения и ток-синообразования — трупный материал. Ботулотоксин вырабатывается вегетативными формами. Строгие анаэробные условия для токсино-образования требуются не всегда, особенно для серотипа Е. Споровые формы клостридий выдерживают температуру 6 "С в течение нескольких месяцев, 100 °С — в течение нескольких часов, 120 "С —в течение 30 мин.
Вегетативные формы бактерий малоустойчивы во внешней среде, погибают при температуре 60 °С. Ботулотоксин—один из наиболее сильных природных ядов (летальная доза для человека — 5—50 нг/кг массы тела), представляет собой токсический комплекс, состоящий из собственно нейротоксина, гемагглютинина и нетоксичного белка с неизученными биологическими свойствами. Разрушается при температуре 80 "С в течение 30 мин, при температуре 100 °С—в течение 10 мин; хорошо нейтрализуется в щелочной среде.
Эпидемиология. Ботулизм относят к сапрозоонозам. Основным резервуаром возбудителя ботулизма являются травоядные животные и реже холоднокровные (рыбы, моллюски, ракообразные), поглощающие споры CI. botulinum с ведой и кормом. Плотоядные животные обычно резистентны к данному возбудителю.
Человек заражается ботулизмом при употреблении в лишу инфицированных спорами продуктов. Большая часть случаев ботулизма связана с употреблением продуктов домашнего консервирования — грибов, овощей, рыбы, мяса, сала и др. В редких случаях встречаются раневой ботулизм и ботулизм грудных детей.
Патогенез и патологическая анатомия. Вегетативные формы возбудителя и ботулотоксин попадают в организм человека при употреблении инфицированных пищевых продуктов. Действие токсина усиливается в желудке под влиянием проте-олитических ферментов. Люди наиболее чувствительны к токсинам серотипов А, В, Е. Одномоментное воздействие ботуло-токсина нескольких серотипов приводит к суммированию токсического эффекта.
Ботулотоксин, всосавшийся через слизистую оболочку желудка и кишечника в кровь, вызывает парез гладкой мускулатуры, сужение кровеносных сосудов с последующим их парезом и повышением ломкости капилляров. Особой чувствительностью к ботулотоксину обладают мотонейроны спинного и продолговатого мозга, что проявляется развитием бульбарного и паралитического синдромов. Резко угнетается парасимпатическая нервная система при практической интактности симпатической нервной системы. Ботулотоксин блокирует освобождение ацетилхолина в окончаниях холинергических нервов, что обусловливает развитие периферических параличей.
В патогенезе ботулизма ведущую роль играет гипоксия — гипоксическая, гистотоксическая, гемическая и циркулятор-ная. Развитие прогрессирующей острой дыхательной недостаточности обусловлено угнетением активности больших мотонейронов, иннервирующих дыхательную мускулатуру. Гипоксическая гипоксия при ботулизме утяжеляется возможностью обтурации бронхов аспирационными рвотными массами, слюной и пищей, что связано с парезами мышц гортани, глотки и надгортанника. Токсинемия вызывает угнетение ферментов пентозофосфатного шунта, ингибирование К—Na насоса и обусловливает развитие гемической гипоксии. Механизм развития раневого ботулизма и ботулизма младенцев отличается тем, что заражение происходит спорами, которые в анаэробных условиях раны или вследствие особенностей флоры и ферментов кишечника грудных детей прорастают в вегетативные формы, продуцирующие токсины.
Патологоанатомические изменения при ботулизме име ют неспецифический характер и определены глубокой гипоксией: полнокровие внутренних органов, отек головного мозга, точечные кровоизлияния в слизистую оболочку желудочно-кишечного тракта.
Клиническая картина. Инкубационный период болезни колеблется от 2—12 ч до 7 сут, составляя в среднем 18—24 ч.
Ведущие синдромы при ботулизме: паралитический, гастроинтестинальный и интоксикационный. Начало болезни, как правило, острое. Больных беспокоят боли в эпигастральной области, тошнота, рвота, редко непродолжительный понос. Рвота тоже непродолжительна, является следствием токсине-мии. Температура тела остается нормальной, редко бывает субфебрильной. Рано отмечаются быстрая утомляемость, прогрессирующая мышечная слабость. Спустя 3—4 ч от начала болезни развиваются симптомы поражения ядер черепных нервов и паралитические нарушения иннервации различных органов, характеризующиеся симметричностью поражений.
Первыми типичными признаками ботулизма нередко являются сухость во рту и офтальмоплегические симптомы. Больные жалуются на ослабление зрения, «сетку» или «туман» перед глазами. Чтение затруднено или невозможно из-за пареза аккомодации и двоения. Отмечается мидриаз со снижением или отсутствием реакции на свет, ограничение движения глазных яблок вплоть до полной неподвижности (парез взора), опущение верхних век (птоз), страбизм (косоглазие), горизонтальный нистагм. Может быть легкая анизокория.
Наряду с глазными симптомами рано появляются нарушения глотания и речи в связи с поражением ядер IX и XII пар черепных нервов. У больных отмечаются осиплость голоса, невнятность, смазанность речи, носовой оттенок голоса, иногда афония. Вследствие пареза мышц глотки, надгортанника и мягкого неба у больных возникают затруднение глотания, по-перхивание, жидкая пища выливается через нос.
Ботулизм сопровождается функциональными расстройствами сердечно-сосудистой системы. Определяется расширение границ сердечной тупости и значительное приглушение тонов сердца с акцентом II тона на легочной артерии.
Нарушения функций пищеварительной системы проявляются сухостью слизистых оболочек рта, мучительной жаждой, ощущениями распирания вследствие застоя содержимого в желудке, вздутием живота, запором, парезом кишечника.
Вовлечение больших мотонейронов шейнцх и грудных отделов спинного мозга приводит к развитию парезов и параличей скелетных мышц. Вдох совершается с большим трудом, больной жалуется на сдавление и сжатие в грудной клетке, принимает вынужденное положение, способствующее включению вспомогательной дыхательной мускулатуры. Исчезает кашлевой рефлекс. Расстройство и остановка дыхания являются одной из ведущих причин смерти при ботулизме. Развитие аспирационных пневмоний усугубляет дыхательную недостаточность.
В терминальный период прогрессируют явления мионейро-плегии: миастения, адинамия. Мышцы приобретают тестообразную консистенцию. Выздоровление наступает медленно, в течение 1—1,5 мес. Неврологическая симптоматика ликвидируется в обратной последовательности: сначала восстанавливаются дыхание и глотание. Головная боль, гнусавость, глазные симптомы, сердечно-сосудистая недостаточность сохраняются длительно, астения держится до полугода. Выздоровление после перенесенного ботулизма полное, но наступает медленно.
Типичными осложнениями ботулизма являются аспираци-онная пневмония, вторичная инфекция, связанная с инвазив-ными методами лечения (интубация, ИВЛ, катетеризация мочевого пузыря и т. п.).
В гемограмме отмечается умеренный лейкоцитоз с нейтро-фильным сдвигом влево.
Прогноз при ботулизме всегда серьезный. При отсутствии адекватной терапии летальность составляет около 25 %.
Диагностика. Осуществляется на основании клинической картины, эпидемиологических данных и результатов лабораторных исследований- Лабораторная диагностика основывается на выявлении ботулотоксина и возбудителя ботулизма в материалах, взятых от больных (кровь, рвотные массы, промывные воды желудка, испражнения), а также в подозрительных пищевых продуктах. Кровь берут из вены в объеме 8—10 мл до введения лечебной сыворотки. Ботулотоксин выявляют в реакции нейтрализации (биологическая проба на мышах), возбудителя заболевания — путем посева на питательные среды (пепсин—пептон, среда Китта—Тароцци, бульон Хоттингера).
Дифференциальная диагностика. Ботулизм следует дифференцировать от пищевых токсикоинфекции другого происхождения, отравлений ядовитыми грибами, белладонной и атропином, дифтерии, полиомиелита и различных заболеваний ЦНС.
Лечение. Больные с подозрением на ботулизм подлежат обязательной госпитализации в инфекционный стационар. Всем больным проводят промывание желудка и назначают высокие сифонные клизмы с 5 % раствором натрия гидрокарбоната объемом до 10 л.
Для нейтрализации свободно циркулирующего в крови ботулотоксина применяют лечебные моновалентные противобо-тулинические сыворотки, что наиболее эффективно в 1—3-й сутки болезни. Одна лечебная доза составляет по 10 ООО ME антитоксинов типов А, С и Е, 5000 ME — типа В и 3000 ME — типа F. В случае, когда неизвестен тип токсина, вызвавшего заболевание, необходимо введение трех типов антитоксической противоботулинической сыворотки (А, В, Е) по одной лечебной дозе при легкой и средней тяжести формах и по две лечебные дозы при тяжелой форме ботулизма. Лечебные сыворотки вводят после специфической гипосенсибилизации. При положительной внутрикожной пробе антитоксическую сыворотку вводят по жизненным показаниям после десенсибилизации путем подкожного введения разведенной лошадиной сыворотки с интервалами в 20 мин под прикрытием десенсибилизирующей терапии (глюкокортикостероидные препараты). При тяжелых формах первые дозы сыворотки вводят внутривенно, в остальных случаях — внутримышечно. При необходимости сыворотки вводят повторно через 6—8 ч. Дозы и частота введения лечебных сывороток определяются тяжестью заболевания и динамикой симптомов болезни, продолжительность серотерапии в среднем составляет 3—4 дня.
Перспективными средствами специфической антитоксической терапии могут быть лечебная нативная гомологичная плазма и человеческий противоботулинический иммуноглобулин.
Для воздействия на вегетативные формы возбудителя показано использование левомицетина, ампициллина и препаратов тетрациклинового ряда в обычных дозах.
Дезинтоксикационные мероприятия включают введение кристаллоидов и коллоидов, диуретических средств, применяются сердечно-сосудистые средства, витамины.
Важное место в терапии ботулизма занимает борьба с расстройствами дыхания и гипоксией. С этой целью используют гипербарическую оксигенацию. При нарастании асфиксии вследствие паралитического закрытия верхних дыхательных путей делают трахеостомию. В случаях расстройств дыхания вследствие паралича дыхательных мышц используют искусственную вентиляцию легких. При развитии пневмонии показана антибактериальная терапия. При расстройствах глотания обеспечивают зондовое питание. При атонии кишечника в восстановительный период применяют ацетилхолинэстераз-ные препараты (прозерин).
Профилактика. Соблюдение санитарно-гигиенических правил при обработке, транспортировке, хранении и приготовлении пищевых продуктов исключает возможность накопления в них ботулотоксина. Необходим строгий контроль при стерилизации и хранении консервированных продуктов. Большое значение имеет разъяснение населению правил заготовки и консервирования продуктов в домашних условиях, в первую очередь мясных, рыбных, грибных и овощных. Кипячение в течение 10—15 мин перед употреблением таких продуктов позволяет полностью нейтрализовать ботулотоксин.
ДИАРЕИ ВИРУСНЫЕ
Син. — гастроэнтерит вирусный
Диареи вирусные (Diarrhoea viralis) — полиэтиологическая группа острых инфекций, проявляющихся симптомами интоксикации, преимущественным поражением желудочнокишечного тракта в виде гастроэнтерита и энтерита и в ряде случаев катаральным воспалением верхних дыхательных путей.
Исторические сведения. Первые сообщения о вирусных поражениях желудочно-кишечного тракта относятся к 20-м годам XX в., когда возникли крупные вспышки кишечных инфекций, получивших названия «эпидемический понос», «невибрионная холеропсдобная болезнь» и др.
В 50-е годы описана большая группа энтеровирусов и доказана способность некоторых представителей этой группы вызывать диарею у взрослых и детей. Многие исследователи, однако, выражают сомнения относительно этиологической роли энтеровирусов в развитии кишечных инфекций из-за широкого распространения здорового вирусоносительства.
В 1973 г. Р. Бишоп методом электронной микроскопии обнаружил в биоптатах слизистой оболочки двенадцатиперстной кишки больных диареей детей вирус из семейства реовирусов, получивших название «ротавирус». Через год вирус был выделен и из фекалий больных. В настоящее время считается, что ротавирусы играют основную роль в происхождении гастроэнтеритов у детей до двух лет жизни. Однако описаны крупные вспышки ротавирусной инфекции и среди взрослых.
По данным ВОЗ, 20—40 % тяжелых диарей в мире связаны с ротавирусной инфекцией, ежегодно от нее умирает не менее 1—2 млн человек.
В дальнейшем были описаны и другие вирусные агенты — возбудители острых кишечных инфекций (астро-, калици-, мини-ротави-русы).
К настоящему времени установлено, что наиболее часто острые кишечные инфекции вирусной этиологии вызываются ротавирусами, агентом Norwalk и близким к нему агентом вирусного гастроэнтерита Снежной горы SMA. Менее значительна роль в этиологии кишечных инфекций эитеральных аденовирусов 40, 41, энтеровирусов Коксаки и ECHO, коронавирусов.
Ротавирусная инфекция
Этиология. Возбудитель — Rotavirus из семейства Reoviridae. На данное время описано 9 сероваров ротавирусов учеловека выделены 1— 4 и 8—9. Ротавирусы животных (5—7) для человека непатогенны. Около 70 % случаев заболеваний вызваны сероваром II. Ротавирусы устойчивы к действию кислот и растворителей жиров.
Эпидемиология. Источник инфекции — больной человек или носитель вируса.
Механизм передачи — фекально-оральный, но допускается и воздушно-капельный путь рассеивания возбудителя.
Восприимчивы к ротавирусной инфекции все лица со сниженным иммунитетом. Наиболее часто заболевание выявляется у новорожденных и детей 6—24 мес жизни; значительна заболеваемость и в возрастных группах 1—3 года. Однако имеются многочисленные указания о вовлечении в эпидемический процесс взрослых, среди которых группами риска являются лица пожилого возраста и больные с тяжелой сопутствующей патологией.
Заболеваемость преимущественно в виде водных и пищевых вспышек, большая часть которых зарегистрирована в холодное время года (зимне-весенний период). Описаны внутрибольничные вспышки. Спорадические случаи инфекции выявляются в течение всего года. Заболевание регистрируется повсеместно.
Патогенез и патологоанатомическая картина. Возбудитель ротавирусной инфекции относится к энтеротропным вирусам. Он поражает наиболее дифференцированные адсорбирующие функционально активные клетки апикальных отделов ворсинок тонкой кишки. Гибель этих клеток сопровождается их замещением незрелыми кубовидными клетками крипт, что приводит к снижению основных функций кишечника (переваривания и всасывания). Снижение активности ря да ферментов щеточной каймы и гипермоторика кишечника приводят к диарее осмотического характера.
Морфологические изменения слизистой оболочки желудка представлены застойным полнокровием, умеренным серозным отеком и слабо выраженной инфил ьтрацией лимфоцитами и эозинофильными лейкоцитами. Эпителий тонкой кишки обычно сохранен. Выявляется инфил ьтрация собственно слизистой оболочки плазматическими клетками, лимфоцитами, в меньшей степени эозинофилами, капилляростаз и застойное полнокровие, нередко — плазморрагии в кишечных ворсинках. Около отдельных кишечных желез развиваются перива-скулярные инфильтраты.
Клиническая картина. Инкубационный период варьирует от 15 ч до 3—5 сут. Начало острое, иногда внезапное, течение нередко бурное. Первый и ведущий синдром инфекции — гастроэнтерит. Более чем у половины больных заболевание начинается рвотой. Рвота однократная, реже повторная, но в бол ь-шинстве случаев прекращается уже в первые сутки болезни.
У части больных рвота возникает одновременно с поносом. Позывы к дефекации внезапны, часты, императивны, испражнения носят выраженный энтеритный характер (жидкие, водянистые, зловонные, пенистые), ино гда зеленоватого и желто-зеленого цвета. У отдельных больных наблюдается примесь нежной слизи в кале. В самых легких случаях стул кашицеобразный, 1—2 раза в сутки, в тяжелых слу чаях — холероподоб-ный. Некоторые авторы сообщают о возможном вовлечении в патологический процесс толстой кишки, вплоть до гемоколи-та. В таких случаях следует особенно тщательно исключать микстинфекцию.
У большинства больных возникают несильные ноющие или схваткообразные боли с локализацией в эпи- и мезогаст-рии. Как и при других энтеритах, больных беспокоит громкое, слышное на расстоянии урчание в животе.
К синдрому гастроэнтерита присоединяются симптомы интоксикации, среди которых доминирует слабость, не соответствующая выраженности кишечных симптомов, тем более высоте температуры тела, которая наблюдается лишь у 20—30 % больных и редко превышает субфебрильные цифры. Вместе с тем некоторые больные ощущают познабливание и даже озноб, не сопровождающийся лихорадкой. Возможны головокружение, редко обмороки.
При объективном обследовании выявляется сухость слизистых оболочек из-за большой потери жидкости со стулом, язык обложен. Живот мягкий, слегка болезненный при пальпации вокруг пупка; при глубокой пальпации — грубое урчание в основном в области растянутой жидким содержимым слепой кишки. Другие отделы толстой кишки безболезненны.
Важнейшей особенностью ротавирусного гастроэнтерита, отличающей его от бактериальных кишечных инфекций, является сочетание у значительного числа больных симптомов гастроэнтерита и интоксикации с поражением верхних дыхательных путей в виде ринита, ринофарингита, фарингита.
В гемограмме в подавляющем большинстве случаев изменений нет, СОЭ нормальная. В первые сутки болезни у некоторых больных возможны небольшой лейкоцитоз и нейтрофи-лез, в последующем — лейкопения, относительный лимфо- и моноцитоз, иногда — эозинофилия.
Течение заболевания обычно благоприятное, редко продолжается дольше 5—7 дней. Летальность, по данным зарубежных авторов, составляет 1—4 %.
Приводим краткую клинико-эпидемиологическую, характеристику некоторых других вирусных диарей, имеющих не только много общего с ротавирусной инфекцией, но и определенные отличия.
Парвовирусная инфекция
Основной возбудитель — вирус Norwalk* диаметром 66 нм. Известны также в качестве возбудителей заболевания у человека агент вирусного гастроэнтерита Снежной горы SMA (агент Сноу Маунтин) и другие парвовирусы. Всего описано 7 морфологических и 4 серологических типа парвовирусов.
* Некоторые исследователи относят агент Norwalk к калшивирусам.
Эпидемиология. Источник инфекции — больной человек. Относительно механизма передачи единого мнения пока не выработано: одни авторы ведущим считают аэрогенный механизм и преобладающим воздушно-капельный путь, другие — фекально-оральный механизм с водным и контактно-бытовым путями перздачи возбудителя. Восприимчивы люди всех возрастов. Наблюдаются спорадические и групповые случаи заболевания. Регистрируется главным образом в холодное время года (отсюда одно из названий заболевания — «болезнь зимней рвоты»).
Клиническая картина. Заболевание протекает обычно нетяжело. Инкубационный период в среднем составляет 2—3 дня с колебаниями от 24 ч до 7 дней. Начало острое, повышение температуры тела необязательно (наблюдается примерно у 30 % больных), но многие пациенты ощущают познабливание или озноб без лихорадки. Больные жалуются на сильную слабость, адинамию, не коррелирующие по тяжести с другими симптомами болезни. Самыми частыми признаками парвови-русной инфекции являются тошнота и рвота, сопровождающиеся анорексией и головокружением. Многие больные жалуются на боли в мышцах. Понос развивается менее чем у половины заболевших и носит характер энтеритного. В тяжелых случаях описано холероподобное течение с развитием гипово-лемического шока.
Боли в животе отмечают далеко не все больные. Как правило, они несильные, ноющие или схваткообразные с локализацией в верхней половине живота. Живот немно го вздут, при пальпации ощущается громкое и грубое урчание. Печень и селезенка не увеличены.
В гемограмме — лейкопения, нейтропения, относител ьный лимфоцитоз, моноцитопения, иногда эозинофилия. Общая длительность заболевания от 12—24 ч до 2—3 дней. Прогноз благоприятный.
Пикорнавирусная инфекция
К пикорнавирусам относятся энтеровирусы — возбудители полиомиелита, Коксаки и ECHO. К этой группе принадлежат и недавно описанные калицивирусы. Среди энтеровирусов гастроэнтериты могут вызывать вирусы Коксаки А 18, 20, 21, 22, 24; ECHO 11, 14, 18; возможно, Коксаки В 2, 3, 4 и др.
Эпидемиология. Источник инфекции — больной человек и виру-соносители; число последних чрезвычайно велико, особенно среди детей дошкольного возраста. Во внешнюю среду возбудители поступают с фекалиями и носоглоточным секретом, обеспечивая широкое инфицирование воды, предметов домашнего обихода, продуктов питания и др.
Вопрос о ведущем механизме передачи дискутируется. Актуальны и фекально-оральный, и аэрогенный (в рамках последнего — воздушно-капельный путь) механизмы.
Контагиозность энтеровирусной инфекции высока, отмечается склонность к большим эпидемическим вспышкам, хотя возможна и спорадическая заболеваемость. Болеют лица всех возрастов, чаще дети.
Клиническая картина. Включает в себя синдром интоксикации, сопровождающийся внезапным повышением температуры тела до 38—39 °С, и синдром гастроэнтерита (несильные боли в животе, тошнота, рвота, нечастый, но обильный водянистый стул без патологических примесей, нередко со зловонным запахом и зеленоватого цвета, обычно не чаще 4—6 раз в сутки). При пальпации живота определяются небольшое вздутие, урчание. У 1/3 больных увеличивается печень.
Течение в подавляющем большинстве случаев нетяжелое, общая продолжительность заболевания 1—3 дня.
Прогноз. Благоприятный.
Энтеровирусная инфекция часто протекает без кишечных проявлений в форме серозных менингитов, энцефалитов, миокардитов и миокардиодистрофий, эпидемической миал-гии, герпангины и др.
Калицивирусная инфекция описана впервые в 1980 г. в Японии как причина гастроэнтерита у детей. В последующем появились сведения о вспышках этого заболевания и у взрослых.
Контагиозность инфекции высокая. Инкубационный период 24—48 ч. Течение непродолжительное, представлено симптомами гастроэнтерита, завершается быстрым выздоровлением.
Диагностика вирусной диареи. Диагноз острых кишечных инфекций вирусной природы базируется на клинической картине заболевания (особенно важно сочетание синдрома гастроэнтерита и поражения верхних дыхательных путей), учете эпидемиологических данных и исключении бактериальной природы заболевания.
Для подтверждения вирусной этиологии заболевания проводят следующие вирусологические и серологические исследования:
-
обнаружение вируса или вирусного антигена в фекалиях с помощью электронной, в том числе иммуноэлектрон-ной микроскопии; методом иммуноэлектроосмофореза;
-
выделение вируса в культуре клеток из различных биологических субстратов (смывы из зева, фекалии);
-
серологические исследования с целью обнаружения специфических противовирусных антител и нарастания их титра в динамике болезни (реакция нейтрализации вируса, реакция подавления гемагглютинации, реакция связывания комплемента, ИФМ, латекс-агглютинация).
Лечение. Лечение больных вирусной диареей принципиально не отличается от комплексной терапии больных другими острыми кишечными инфекциями. Основой лечения являются лечебное питание и коррекция ферментной недостаточности желудочно-кишечного тракта. С этой целью назначают полиферментные препараты (полизим, абомин, фестал, пан-зинорм форте, панкреатин, мезим форте, дигестал и др.). Необходима также соответствующая диетотерапия с исключением, а затем ограничением приема молока.
При обезвоживании проводят пероральную регидратацию стандартным глюкозо-электролитным раствором, содержащим бикарбонат. В тяжелых случаях дегидратации проводят регид-ратационную терапию путем внутривенного введения полиионных растворов в объеме до 3—4 л под контролем содержания электролитов в плазме крови и функции почек. При этом учитывают продолжающиеся потери жидкости и солей.
Ввиду неэффективности антибактериальных препаратов при вирусных заболеваниях их назначение нецелесообразно, если нет доказательств присоединения бактериальных осложнений.
Профилактика. Специфическая профилактика вирусных диарей в нашей стране не разработана. Общие меры профилактики совпадают с таковыми при других кишечных инфекциях и дополняются мерами предупреждения распространения инфекции воздушно-капельным путем.
ЭНТЕРОВИРУСНЫЕ ИНФЕКЦИИ
Энтеровирусные инфекции (Enteroviroses) — группа острых антропонозных заболеваний, характеризующихся разнообразными клиническими проявлениями поражения кожи, мышц, верхних дыхательных путей, кишечника, центральной нервной системы, миокарда и вызываемых вирусами Коксаки, ECHO (неполиомиелитные энтеровирусные инфекции) и полиовирусами (полиомиелит).
Полиомиелит
Син.: болезнь Гейне—Медина, детский инфе'кционный паралич, детский эпидемический полиомиелит
Полиомиелит (Poliomyelitis) — острая вирусная антропоноз-ная инфекция, характеризующаяся поражением нервной системы с развитием вялых параличей и парезов, воспалительными изменениями слизистой оболочки кишечника и носоглотки.
Исторические сведения. Болезнь известна с древних времен, археологические раскопки указывают на ее наличие в странах Древнего Востока. Гиппократ описал в Греции вспышку заболевания, напоминающего паралитический полиомиелит. Первые его научные описания сделаны в XIX в. немецким ортопедом Гейне (1840). Шведский педиатр Медин (1890) описал эпидемию заболевания в Стокгольме и назвал инфекцию «эпидемическим детским полиомиелитом». В 1908 г. Ландштейнер и Поппер доказали вирусную природу заболевания и воспроизвели его в эксперименте.
Крупные эпидемии полиомиелита были известны с конца XIX в. и зарегистрированы в середине XX в. в экономически развитых регионах — США, Англии, других европейских странах. Вместе с тем в странах тропического и субтропического климата с низким санитарным уровнем жизни и высокой частотой фекального заражения, например в странах Южной Америки и Африки, отмечалось эндемическое распространение полиомиелита. Вирусы интенсивно циркулировали среди населения и заражали значительную часть детей в возрасте первых месяцев или лет жизни, что объясняет отсутствие крупных эпидемий в этих регионах.
Новый этап в изучении полиомиелита начался в 50-х годах XX столетия, когда была разработана лабораторная диагностика заболевания и предложены эффективные профилактические мероприятия. Впервые безопасная убитая вакцина против полиомиелита была создана Солком (США) в 1953 г., затем широкое применение получила живая вакцина, приготовленная по способу Сейбииа. Система мероприятий по борьбе с полиомиелитом была создана русскими учеными М. П. Чумаковым и А. А. Смородинцевым.
В 1988 г., когда в мире было зарегистрировано 35 тыс. случаев полиомиелита, Всемирная Ассамблея Здравоохранения приняла резолюцию о ликвидации полиомиелита в мире к 2000 г. Глобальная программа ликвидации полиомиелита проводится успешно; так, уже в 1994 г. Американский регион был сертифицирован ВОЗ как свободный от полиомиелита. Вместе с тем до настоящего времени инфекция продолжает регистрироваться во многих странах мира.
Этиология. Возбудитель — Poliovirus рода Enterovirus семейства Pi-cornaviridae, является мелким (22—30 нм) сферической формы вирусом, геном которого представлен РНК. Различают PI, Р2 и РЗ серо-типы Poliovirus.
Возбудитель устойчив к воздействию различных физических и химических факторов, длительно выживает в фекалиях, сточных водах, на овощах, в молоке. Вирус инактивируется при кипячении, воздействии 2—3 % раствора хлорамина и 1 % раствора калия перманга-ната.
Эпидемиология. Источник инфекции — больной человек или ви-русовыделитель. Большую роль в распространении инфекции играют больные инаппарантными, легкими и стертыми формами, представляющие наибольшую опасность в первые 7—10 дней болезни.
Механизм передачи инфекции — фекально-оральный, который реализуется алиментарным путем. Не исключается и возможность воздушно-капельного пути передачи возбудителя.
Естественная восприимчивость к вирусу низкая. Только у 0,2— 1 % заразившихся развивается паралитическая форма инфекции. В возрастной структуре преобладают дети дошкольного возраста, к 7—9 годам большинство детей имеют антитела ко всем трем типам вируса полиомиелита. После введения вакцинопрофилактики отмечается увеличение доли подростков и взрослых среди заболевших.
Патогенез и патологоаиатомическая картина. Вирус полиомиелита проникает в организм человека через рот и локализуется на слизистых оболочках ротоглотки и кишечника, в регионарных лимфатических узлах. У подавляющего большинства заразившихся дальнейшего распространения инфекции не происходит и развиваются бессимптомные или абортивные формы заболевания.
Репликация и накопление вируса во входных воротах инфекции могут привести к вирусемии. Нейротропность возбудителя закономерно обеспечивает поражение нервных клеток. Примерно у 1 % от числа инфицированных вирус преодолевает гематоэнцефалический барьер и поражает ЦНС — нервные клетки преимущественно передних рогов серого вещества спинного мозга, ядра продолговатого мозга и моста головного мозга (варолиев мост), где развиваются дистрофические, часто необратимые процессы. На месте гибели нейронов образуются пролиферативно-клеточные инфильтраты. В зависимости от основной локализации поражения нервной системы развиваются вялые параличи мышц конечностей, туловища, межреберной мускулатуры с их атрофией, расстройства дыхания.
Перенесенная инфекция независимо от клинической формы обеспечивает стойкий, длительный типоспецифический иммунитет.
Клиническая картина. Инкубационный период составляет в среднем 6—20 дней (от 3 до 35 дней). Клиническая классификация предусматривает выделение форм полиомиелита без поражения и с поражением нервной системы.
Непаралитический полиомиелит представлен инаппарант-ной, абортивной и менингеальной формами.
Паралитический полиомиелит разделяют на формы по локализации патологического процесса: спинальная, бульбар-ная, понтинная, смешанная, с выделением препаралитиче-ской, паралитической, восстановительной, резидуальной стадий.
Выделяют легкую, средней тяжести и тяжелую формы.
Инаппарантная форма представляет собой вирусоноситель-ство без каких-либо клинических проявлений заболевания, диагностируется только на основании результатов лабораторного обследования. Эта форма имеет важное эпидемиологическое значение как основной источник инфекции, кроме того, в результате перенесенного инаппарантного полиомиелита вырабатывается стойкий иммунитет.
Абортивная форма («малая болезнь») протекает как острая кратковременная инфекция, продолжительностью до 7—10 дней. Начинается обычно внезапно с повышения температуры тела и признаков умеренно выраженной интоксикации. Характерен гриппоподобный симптомокомплекс. Больных беспокоят недомогание, головная боль, снижение аппетита. У части пациентов развиваются симптомы катарального воспаления верхних дыхательных путей, сопровождающиеся болями в горле, гиперемией слизистых оболочек ротоглотки. Возможны признаки дисфункции кишечника, тошнота, рвота. Неврологические симптомы отсутствуют.
Менингеалъная форма (непаралитическая) развивается остро, сопровождается повышением температуры тела, головной болью, рвотой, умеренно выраженными менингеальными знаками (ригидность затылочных мышц, симптомы Кернига, Брудзинского). При этом характерны спонтанные боли в спине и конечностях, гиперестезия кожи, положительные симптомы напряжения корешков нервов (Нери, Ласега, Вассер-мана), боли по ходу нервных стволов, т. е. признаки менинго-радикулярного синдрома. Больные вялые, адинамичные, в положении сидя вынуждены опираться на руки (симптом «треножника»). Часто возникает горизонтальный нистагм. В цереброспинальной жидкости обнаруживается умеренный лим-фоцитарный цитоз, содержание белка и глюкозы нормальное или несколько повышенное (признаки серозного менингита). В периферической крови изменения минимальные, иногда отмечается умеренный лейкоцитоз. Течение менингеальной формы благоприятное.
Паралитические формы протекают более тяжело и имеют худший прогноз. В их развитии выделяют 4 стадии.
Препаралитическая стадия продолжается 3—5 дней. Начинается остро с повышения температуры тела, общей слабости, недомогания, нередко катаральных и диспепсических проявлений, сходных с признаками абортивной формы. Затем состояние больного ухудшается, усиливается головная боль, появляются боли в спине и конечностях. Характерны сонливость, мышечные подергивания. Признаки поражения нервной системы соответствуют менингорадикулярному синдрому. При осмотре выявляют умеренно выраженные менингеальные знаки, вегетативные расстройства — потливость, пятнистую эритему на коже.
Паралитическая стадия. Протекает в разных формах в зависимости от локализации поражения нервной системы.
Спинальная форма развивается при поражении мотонейронов в передних рогах спинного мозга. Параличи формируются бурно на 1—6-й день болезни, преимущественно в проксимальных отделах конечностей, чаще ног. Вялые параличи с низким мышечным тонусом, гипо- и арефлексией имеют асимметричный, мозаичный характер распределения, при этом атрофия одних групп мышц и «спазм» мышц-антагонистов приводят к образованию функциональных, а позднее и органических контрактур. Наиболее тяжелые проявления имеют спинальные формы с поражением межреберных мышц и диафрагмы, что сопровождается развитием дыхательной недостаточности, присоединением вторичной инфекции. Продолжительность этой стадии от нескольких дней до 2 нед.
Бульбарная форма протекает тяжело, с нарушением жизненно важных функций. На фоне остро нарастающей общей интоксикации — высокой лихорадки, головной боли, рвоты — появляются неврологические симптомы: нистагм горизонтальный крупноразмашистый и ротаторный. Поражение ядер IX и X черепных нервов сопровождается нарушением глотания (фарингеальный паралич) и фонации (ларингеаль-ный паралич). Больные жалуются на нарушение глотания, по-перхивание, попадание жидкой пищи в нос. Речь становится смазанной, голос глухим, хриплым. В результате усиления секреции слизи дыхание становится клокочущим, возникают инспираторная одышка, цианоз. Резко ухудшается состояние больных при поражении дыхательного и сосудодвигательного центров. Дыхание становится аритмичным, артериальное давление резко снижается, конечности становятся холодными, усиливается потоотделение. Больные тревожны, мечутся, затем впадают в сопор и кому. Бульбарная форма часто приводит к летальному исходу. В случаях стабилизации состояния больных восстановление происходит медленно.
Понтинная форма характеризуется изолированным поражением ядра лицевого нерва (VII пара), течение ее менее тяжелое. Возникает полная или частичная утрата мимических движений на одной половине лица (асимметрия). Глазная щель не смыкается (лагофтальм), сглажена носогубная складка, угол рта опущен. Восстановление начинается с 10—14-го дня болезни и происходит неравномерно.
Тяжело протекают смешанные формы — бульбоспиналь-ная, понтоспинальная.
Восстановительная стадия. Отличается медленным и неравномерным восстановительным процессом в разных группах мышц. Тенденция к обратному развитию параличей глубоко пораженных мышц отсутствует, неравномерность и мо-заичность поражения мышц приводят к деформации костного скелета и развитию контрактур. Активно процесс восстановления идет в течение первых 3—6 мес, затем замедляется и может продолжаться еще 1—1,5 года.
Резидуальная стадия. Характеризуется стойкими остаточными вялыми парезами, отставанием конечностей в росте, ос-теопорозом, резкими атрофиями, иногда деформацией конечностей и туловища.
Осложнениями полиомиелита являются пневмонии, ателектазы легких, интерстициальный миокардит, при бульбарных формах — острое расширение желудка, образование язв желудка с перфорацией и(или) кровотечением.
Прогноз наиболее серьезный для жизни при формах полиомиелита с нарушением дыхания. Стойкие вялые параличи с атрофией мышц приводят к инвалидности.
Диагностика. Диагноз основан на клинико-эпидемиологи-ческих и лабораторных данных и наиболее труден при инап-парантной, абортивной и менингеальной формах.
Выделение вируса производят из фекалий и носоглоточных смывов в течение первой недели болезни (на культурах тканей). С помощью молекулярно-биологических методов выделенный вирус дифференцируют от вакцинальных штаммов.
Для подтверждения диагноза используют РСК и реакцию преципитации (нейтрализации) со специфическим антигеном в парных сыворотках, взятых с интервалом 3—4 нед.
Дифференциальная диагностика проводится с серозными менингитами (энтеровирусными, паротитным, туберкулезным и др.), полирадикулоневритом, миелитом, полиомиелитопо-добными заболеваниями, костно-суставной патологией, стволовым энцефалитом, невритом лицевого нерва.
Лечение. Объем терапевтических мероприятий зависит от клинической формы полиомиелита. При непаралитических формах используют патогенетические и симптоматические средства — постельный режим, дезинтоксикационные в сочетании с диуретическими препаратами, анальгетики, витамины группы В.
При паралитических формах в начальном периоде требуются абсолютный покой и тепловой комфорт.
Имеется опыт использования в разные сроки болезни человеческого иммуноглобулина. Антибиотики назначают лишь при развитии бактериальных осложнений. По показаниям при бульбарной форме в желудок вводят зонд, постоянно санируют дыхательные пути, при критическом снижении жизненной емкости легких используют ИВЛ. Для предупреждения контрактур больного укладывают на жесткий матрац, стопы фиксируют в нормальном положении шиной. Важно систематически проводить профилактику пролежней.
В восстановительном периоде широко используют тепловые процедуры, применяют курсы прозерина, дибазола, глута-миновой кислоты, витаминов группы В. В этой фазе болезни используют глюкокортикостероидные препараты, анаболические гормоны. Важное место в лечении занимают физиотерапия и массаж.
Профилактика. Больных полиомиелитом изолируют не менее чем на 3 нед.
Основные профилактические мероприятия проводят путем плановой вакцинации живой вакциной (трехвалентной), начиная с двухмесячного возраста троекратно с интервалом в 1,5 мес. Последующая ревакцинация проводится в возрасте 1 года, 2 и 7 лет.
Энтеровирусные неполиомиелитные инфекции
Син.: полиомиелитоподобные заболевания, Коксаки- и ЕСНО-инфекции
Неполиомиелитные энтеровирусные инфекции — острые ан-тропонозные заболевания, вызываемые кишечными вирусами Коксаки и ECHO, с разнообразными клиническими проявлениями.
Исторические сведения. История энтеровирусных инфекций началась задолго до открытия их возбудителей. Первое описание вспышки «плевродинии» в Исландии приходится на 1856 г., впоследствии инфекция была названа болезнью Борнхольма (по названию датского острова Борнхольм). Вспышки серозного менингита наблюдались в Париже в 1910—1913 гг., в Скандинавских странах—в 1922— 1934 гг.
Вирусы Коксаки впервые выделены от больных в 1948 г. Далдорф и Сикклес в г. Коксаки (США). По патогенному действию на зараженных мышей-сосунков они разделены на группы А (24 серотипа) и В (6 серотипов).
В 1946—1948 гг. были описаны эпидемические вспышки заболевания у детей под названием «трехдневная лихорадка», в дальнейшем была установлена роль вирусов Коксаки В в их возникновении.
Вирусы ECHO выделены Эндерсом в 1951 г. Они названы Enteric cytopathogenic human orphan (ECHO) — кишечные цитопатогенные человеческие вирусы-сиротки, так как вначале их роль в патологии человека была неясна.
В последние годы происходит эволюция энтеровирусных инфекций. Выявляются новые типы энтеровирусов, имеющие клиническое значение. В 1971—1973 гг. были выделены энтеровирусы-68 и -69; во время вспышек геморрагического конъюнктивита в странах Европы, Азии и Африки был изолирован его возбудитель — энтеровирус-70.
Этиология. Возбудители энтеровирусных инфекций — вирусы Коксаки и ECHO относятся к семейству Picornaviridae, poxy Enterovirus. Это РНК-содержащие вирусы небольшого размера (15—35 нм). Все 6 типов вирусов Коксаки В патогенны для человека. Идентифицированы 34 серотипа вирусов ECHO, 2/3 из которых патогенны для человека. Известны еще 4 энтеровируса человека (68—71).
Вирусы устойчивы к замораживанию, действию эфира, 70 % спирта, 5 % лизола, сохраняют активность при комнатной температуре в течение нескольких дней; инактивируются под действием формалина, хлорсодержащих средств, при нагревании, высушивании, ультрафиолетовом облучении.
Эпидемиология. Источниками инфекции служат больной человек и(или) вирусовьщелитель. Носительство энтеровирусов широко распространено.
Механизм передачи инфекции фекально-оралъный и аэрозольный, пути передачи — водный, алиментарный, контактно-бытовой, воздушно-капельный. Известна передача инфекции от матери к плоду.
Инфекция высококонтагиозна, восприимчивость к ней велика, особенно в детском возрасте (до 8—10 лет). Взрослые болеют относительно редко. Заболевания распространены повсеместно, встречаются в виде как спорадических случаев, так и локальных вспышек, крупных эпидемий. В странах умеренного климата пик заболеваемости приходится на период с августа по октябрь.
В последние десятилетия заболевания приобрели широкое эпидемическое распространение во многих странах мира.
Патогенез и патологоаиатомическая картина. После проникновения через желудочно-кишечный тракт или дыхательные пути вирусы внедряются в слизистые оболочки нижних отделов кишечника или ротоглотки, затем — в регионарные лимфатические узлы, где они накапливаются. В месте внедрения вирусов может быть воспаление слизистых оболочек. Кратковременная первичная вирусемия приводит к диссеми-нации возбудителя в органы и ткани, где вирусы реплицируются и оказывают повреждающее действие. Энтеровирусы отличаются тропизмом к нервной, мы шечной тканям, эпителиальным клеткам. При большинстве энтеровирусных инфекций в процесс одновременно вовлекаются центральная нервная система и другие органы. Прекращение вирусемии совпадает с появлением в крови спе цифических антител. После перенесенного заболевания формируется стойкий типоспе пифический иммунитет.
Патоморфологические изменения изучены при тяжелых формах энтеровирусных инфекций. Вирусы Коксаки В вызывают миокардиты и менингоэнцефалиты. Воспалительная инфильтрация обнаруживается в миокарде, причем возможны как очаговые, так и диффузные поражения. Мышечные волокна могут некротизироваться без предварительной клеточной инфильтрации. Нередко выявляются признаки воспаления эпикарда и перикарда. В головном мозгу чаще воспаление имеет очаговый характер. У больных плевродинией с помощью прижизненной биопсии скелетных мы шц обнаруживают массивную воспалительную инфильтрацию и дегенерацию мышечных волокон
Клиническая картина. Клинические проявления энтеровирусных инфекций отличаются значительным многообразием, при этом общими чертами различных клинических форм являются короткий инкубационный период, острое бурное начало заболевания, в большинстве случаев короткое доброкачественное течение, склонность к рецидивам. Именно рецидивы определяют типичную для этих заболеваний волнообразную лихорадку.
Инкубационный период продолжается 2—7 дней, чаще 2— 4 дня.
Заболевание обычно начинается с быстрого подъема температуры тела до 38—40 "С, что сопровождается признаками интоксикации — головной болью, головокружением, распространенными болями в мышцах, общей слабостью, недомоганием, расстройством сна. Нередко отмечаются тошнота и рвота. Обращают на себя внимание характерная гиперемия лица, инъекция сосудов склер — внешний вид «лихорадящего» больного. Часто у больных появляется кратковременная полиморфная сыпь. Как правило, умеренно гиперемированы слизистые оболочки ротоглотки, увеличены шейные лимфатические узлы, при этом микрополилимфаденит встречается редко. Тоны сердца приглушены. Живот может быть несколько вздут, при пальпации в мезогастрии обнаруживаются урчание и болезненность. Печень и селезенка обычно не увеличены.
Изменения гемограммы незначительны. Небольшое увеличение количества лейкоцитов в периферической крови в начале заболевания после 4—5-го дня сменяется умеренной лейкопенией.
Клинические формы энтеровирусных инфекций выделяют по преобладающему симптомокомплексу.
Серозный (асептический, абактериальный) менингит — частая форма энтеровирусных инфекций, вызываемых всеми типами вирусов Коксаки и ECHO. Начинается остро, с высокой лихорадки и общей интоксикации. На 1—2-й день болезни появляется отчетливо выраженный менингеальный синдром — сильная упорная головная боль, повторная рвота, нередко отмечаются вялость и сонливость, иногда — возбуждение и беспокойство. Кроме того, возможны жалобы на кашель, насморк, боли в горле и боли в животе. Часто у больных появляются кожная гиперестезия, повышенная чувствительность к раздражителям. При осмотре выявляются положительные симптомы Кернига, Брудзинского, ригидность затылочных мышц, признаки выраженного гипертензионного синдрома. При спинномозговой пункции прозрачная бесцветная цереброспинальная жидкость вытекает под давлением. Цитоз повышен (несколько десятков или сотен клеток в 1 мм3), преобладают лимфоциты, содержание белка, глюкозы и хлоридов нормальное. Температура тела нормализуется через 3—5 дней, иногда появляется вторая волна лихорадки.
Эпидемическая миалгия (болезнь Борнхольма, эпидемическая плевродиния) вызывается всеми серотипами Коксаки В, реже — другими энтеровирусами. Начало заболевания сопровождается ознобом, высокой лихорадкой, сильнейшими приступообразными болями, локализующимися в разных группах мышц: груди, живота, спины, реже — конечностей. Интенсивность болей различная, иногда они становятся мучительными и сопровождаются вегетативными реакциями — обильным потоотделением. Боли возникают внезапно, часто имеют спастический характер, усиливаются при малейшем движении и кашле. Во время болевого приступа кожные покровы бледнеют, дыхание учащается и становится поверхностным. Больные описывают боли «как удар ножа». При локализации миалгий в мышцах брюшного пресса пальпация живота становится резко болезненной, но симптомы раздражения брюшины отсутствуют. Миалгий продолжаются 5—10 мин и повторяются через 30—60 мин. Возможно сочетание мышечных болей с другими проявлениями энтеровирусных инфекций — экзантемой, рвотой, диареей, болями в горле. Заболевание может протекать волнообразно с рецидивами, сопровождающимися новым подъемом температуры тела и возобновлением болей в мышцах.
Герпангина вызывается вирусами Коксаки А, реже — В и ECHO. На фоне общих симптомов энтеровирусных инфекций появляются умеренно выраженные боли в горле. При осмотре обращает на себя внимание легкая гиперемия слизистых оболочек ротоглотки с единичными, четко отграниченными мелкими (1—2 мм) папулезными элементами, быстро превращающимися в пузырьки, которые могут увеличиться до 5 мм в диаметре. Энантема преимущественно локализуется на передних дужках, небе, язычке, передней поверхности небных миндалин, стенках глотки и слизистой оболочке щек. Через 1—2 дня на их месте образуются поверхностные эрозии с сероватым налетом и узкой каймой яркой гиперемии. Эрозии могут сливаться, что приводит к увеличению их размеров. Поражение слизистых оболочек сопровождается незначительными болями и повышенным слюнотечением. Закономерно увеличиваются подчелюстные лимфатические узлы. К 4—7-му дню болезни дефекты слизистой оболочки заживают без следа.
Энтеровирусная лихорадка («малая болезнь», летний грипп, неопределенная лихорадка, неспецифическая лихорадка, трехдневная лихорадка, Коксаки- и ЕСНО-лихорадка) вызывается вирусами Коксаки и ECHO и характеризуется кратковременной лихорадкой (1—3 дня) без выраженных локальных проявлений с умеренно выраженным синдромом интоксикации — общей слабостью, разбитостью, мышечными болями, у детей младшего возраста — анорексией, выраженность которых соответствует уровню температуры тела. При обследовании редко выявляют видимые изменения со стороны органов и систем. Заболевание протекает легко.
Энтеровирусная экзантема (бостонская лихорадка, эпидемическая экзантема, инфекционная экзантема, кореподобная и краснухоподобная экзантема) чаще вызывается вирусами ECHO, реже — Коксаки. На фоне лихорадки и умеренно выраженной интоксикации, которая сохраняется 1—7 дней, появляется сыпь на туловище, конечностях, лице, чаще пятнистая и пятнистопапулезная (краснухо- и кореподобная), реже — скарлатиноподобная и петехиальная. Через 3—4 дня экзантема угасает.
Вариантом инфекции, вызванным вирусом Коксаки А, является своеобразное заболевание с локализацией сыпи на кистях, стопах и в полости рта. Экзантема представлена везикулами (1—3 мм в диаметре), окруженными венчиком гиперемии. На языке и слизистой оболочке щек образуются единичные афтозные элементы. Течение заболевания доброкачественное.
Энтеровирусная диарея (кишечная форма энтеровирусной инфекции, гастроэнтеритическая форма) встречается как у детей, так и у взрослых. Диспепсические явления относятся к типичным признакам энтеровирусных инфекций. Частыми симптомами являются диарея, рвота, боли в животе, метеоризм. Характерен жидкий стул, в среднем 2—7 раз в сутки, без патологических примесей, редко — водянистый. Боли в животе бывают разной интенсивности, чаще локализуются в области пупка. Интоксикация мало выражена, нередко отмечаются, наряду с признаками поражения желудочно-кишечного тракта, явления катарального воспаления верхних дыхательных путей.
Респираторная (катаральная) форма вызывается многими типами энтеровирусов. Кратковременная, обычно фебрильная лихорадка сопровождается фарингитом, назофарингитом и(или) ларингитом. Характерны боли в горле, насморк, сухой кашель, может быть рвота и(или) диарея, головная боль и боли в мышцах, у детей младшего возраста — анорексия. Отмечается гиперемия слизистых оболочек ротоглотки, как правило, без налетов. Инфекция в среднем продолжается 3—6 дней.
Эпидемический геморрагический конъюнктивит. Заболевание вызывается энтеровирусом-70. Больные жалуются на внезапно возникшие боли в глазах, светобоязнь, слезотечение. Сначала поражается один глаз, затем процесс распространяется на другой. Появляется отек век, покраснение конъюнктив, кровоизлияния под конъюнктивы, скудное серозное или слизисто-гнойное отделяемое. Выздоровление обычно наступает через 1—2 нед.
Миелит (полиомиелитоподобная форма, паралитическая форма) вызывается разными типами энтеровирусов. Заболевание проявляется синдромами, характерными для спинальной, понтинной форм полиомиелита, однако отличается от них более доброкачественным течением с относительно быстрым обратным развитием параличей и парезов и восстановлением двигательных функций. Вместе с тем известны тяжелые формы заболевания с серьезным прогнозом. При заражении многими типами энтеровирусов встречается синдром Гийена— Барре.
Энцефаломиокардит новорожденных вызывается вирусами Коксаки В (тип 2—5). Это редкое заболевание, которое возникает в виде небольших вспышек в родильных домах. Инфекция отличается тяжелым течением и высокой летальностью. Основными признаками заболевания являются лихорадка, рвота, диарея, одышка, цианоз, тахикардия, нарушение ритма сердца, тонико-клонические судороги. Нередко отмечают вялость, отказ от еды. Объективно определяются увеличение печени, селезенки, желтуха, отеки, расширение границ сердца, артериальная гипотензия, напряжение родничков, лимфоци-тарный плеоцитоз в цереброспинальной жидкости. Течение обычно бурное, быстро прогрессирующее.
Известны другие клинические проявления Коксаки- и ЕСНО-инфекции, такие как энцефалиты, миокардиты, перикардиты, безжелтушные гепатиты и др.
Диагностика. При ряде клинических форм во время эпидемических вспышек диагноз может быть поставлен на основании характерной симптоматики. Из лабораторных методов используют вирусологические и серологические. Проводят вирусологическое исследование методом тканевых культур смывов из носоглотки, фекалий, цереброспинальной жидкости. Используют метод иммунофлюоресценции. Следует учитывать, что выделение вирусов из фекалий может быть у вирусоноси-телей, что требует обязательного дополнительного обследования.
Для серологической диагностики применяют РН, РП, РТГА, РСК в парных сыворотках: первая исследуется в первые дни заболевания, вторая — через 2 нед, учитывают нарастание титров антител в 4 раза и более.
Дифференциальную диагностику проводят с менингитами другой этиологии, острыми кишечными инфекциями, острыми респираторными заболеваниями, гингивитом и афтозным стоматитом, конъюнктивитами, полиомиелитом. Эпидемическую миалгию дифференцируют с заболеваниями, сопровождающимися болевым синдромом (аппендицит, острый панкреатит, холецистит, острая кишечная непроходимость, плеврит и др.).
Лечение. Этиотропного и специфического лечения нет. В соответствии с клинической формой используют патогенетические и симптоматические средства. При тяжелом течении инфекции применяют препараты интерферона и глюкокорти-костероидов.
Профилактика. Больные подлежат изоляции в течение 14 дней. Специфическая профилактика не разработана. Перспективно профилактическое использование интерферона и интерфероногенов. Детям, бывшим в контакте с больными, рекомендуется введение донорского иммуноглобулина.
ВИРУСНЫЕ ГЕПАТИТЫ
Вирусные гепатиты (Hepatites virosae) — группа антропо-нозных, вызванных различными гепатотропными вирусами болезней с множественными механизмами инфицирования, проявляющихся признаками преимущественного по-
ражения
печени с нарушением ее функций,
интоксикационным и диспепсическим
синдромами, гепатомегалией и нередко
желтухой.
Исторические сведения. Указания на «эпидемии желтух» имеются в литературных памятниках древности (труды Гиппократа, V в. до н. э.). В самостоятельную форму болезнь была выделена С. П. Боткиным в 1888 г. («катаральная желтуха»), указавшим на ее связь с циррозом и «острой желтой атрофией» печени. По предложению А. А. Киселя в 1898 г. болезнь получила название «болезнь Боткина».
В XIX—XX вв. наблюдались эпидемии и пандемии болезни Боткина, связанные, как правило, с войнами и социальными катаклизмами. Вирусная природа болезни была установлена G. Findley, McCallum (1937) и Е. М. Тареевым и соавт. (1940—1945). А в 1962— 1965 г. В. Blumberg описал так называемый австралийский антиген, связанный с сывороточным гепатитом и оказавшийся поверхностным антигеном (HBsAg) вируса гепатита В, описанного D. Dane (1970). Эти исследования позволили разработать в США в 1975 г. вакцину против гепатита В.
Вирус гепатита А (инфекционного, эпидемического) был открыт в 1973 г. S. Feinstone. Гепатит А соответствует «военной желтухе» средних веков, в настоящее время остается широко распространенным заболеванием. Выделение вируса, а затем доказательство возможности его репродукции в первичных и перевиваемых линиях клеток человека и обезьян обеспечило базу для получения культурально-го антигена, требующегося для создания диагностических тест-систем и разработки вакцины. В 1990-е годы созданы первые лицензионные вакцины.
В 1977 г. М. Rizzeto и соавт. открыли «дельта-антиген» в ядрах ге-патоцитов, получивший название «вирус D». Этот уникальный вирус (дефектный, безоболочечный вироид) способен к репликации вирио-нов исключительно у лиц, инфицированных вирусом гепатита В.
В 70-х годах прошлого столетия было установлено наличие группы вирусных гепатитов, объединенных условным названием <гепати-ты ни А ни В». Из них были обособлены гепатиты с фекально-ораль-ным механизмом заражения (в дальнейшем — вирусный гепатит Е) и парентеральными путями инфицирования — гепатит С.
Гепатит Е выделен в самостоятельный тип только в 80-е годы, однако есть основания полагать, что инфекция существовала значительно раньше. Это наиболее часто встречающийся острый вирусный гепатит среди взрослого населения в гиперэндемичных регионах тропической Азии и Африки. Ретроспективный анализ эпщеми-ческих вспышек гепатита в XIX—XX столетиях позволяет предполагать их связь с гепатитом Е. Известны крупнейшие водные вспышки гепатита Е в Индии в 1955—1956 гг. (35 тыс. человек) и в Китае в 1986 г. (120 тыс. человек). Важным фактором, подтверждающим самостоятельность вируса гепатита Е, явился опыт с самозаражением, проведенный М. С. Балаяном (1983) и позднее А. С. Chauhan и др. (1993). В 1990 г. удалось методом молекулярной гибридизации получить вирусспецифический клон, близкий выделяемому из фекалий больных во время эпидемических вспышек в разных регионах Азии. В стадии разработки находится рекомбинантная вакцина против гепатита Е.
С 1990-х годов во всем мире проводится изучение и активное накопление данных о гепатите С. В результате многолетних исследований М. Houghton и соавт. удалось разработать первую тест-систему для индикации специфических антител к вирусу гепатита С (ИФА) на основе получения искусственного рекомбинантного антигена вируса. В последующие годы удалось разработать информативные тест-системы новых поколений, диагностику с применением методов молекулярной биологии.
В мире инфицировано вирусом гепатита С 10 % всей популяции. Большая часть инфицированных переносит инфекцию в субклинической (латентной) форме. До настоящего времени вирус гепатита С называют «ласковым убийцей», так как гепатит С обладает наиболее высоким хрониогенным потенциалом. Именно эта инфекция является основной причиной формирования всей группы хронических болезней печени — хронического гепатита, цирроза, гепатокарциномы. Отсутствуют средства специфической профилактики инфекции.
Группа наиболее распространенных вирусных гепатитов человека включает гепатит А, гепатит В, гепатит С, гепатит D и гепатит Е (табл. 5).
Постоянно обсуждаются новые кандидаты — возбудители гепатитов G, F, TTV, SEN-V и др. Существенную проблему в современных условиях представляют микст-вирусные гепатиты.
Заболевания различаются по типу возбудителя, механизмам повреждения печени, клинической картине и исходам. Данная группа болезней не включает вирусные гепатиты, развивающиеся в качестве синдромов при инфекциях, вызванных вирусом Эпштейна—Барр
(ВЭБ), цитомегаловирусами (ЦМВ), герпесвирусами, вирусом желтой лихорадки и др. (так называемые гепатиты-спутники).
Гепатотропность возбудителей вирусных гепатитов объясняет сходство основных клинических проявлений заболеваний, представленных в периоде разгара характерными клинико-биохимическими и патоморфологическими синдромами или их сочетаниями, несмотря на то что инфекции вызваны разными вирусами и имеют существенные различия в патогенезе
В результате патологических изменений в печеночной ткани развиваются цитолитический, мезенхимально-воспалительный и холе-статический синдромы с определенными клиническими и лабораторными проявлениями.
Основным синдромом поражения печени при гепатитах является цитолиз. Цитолиз — повышение проницаемости клеточных мембран, сопровождающееся нарушением внутриклеточного метаболизма. Происходит перераспределение биологически активных веществ — выход за пределы клетки печеночно-клеточных ферментов (АлАТ, ЛДГ5 и др.) и ионов калия, проникновение в клетку жидкости и ионов натрия, кальция (отек, набухание). Процесс дезинтеграции мембран гепатоцитов распространяется и на внутриклеточные органел-лы. Повышение проницаемости лизосомальных мембран и массивный выход активных гидролаз приводят к аутолизу клеток. Все это приводит к дистрофическим изменениям в гепатоцитах и их некрозу. Диффузный цитолиз и дистрофия сопровождаются нарушениями функции печени (детоксической, белковосинтетической, пищеварительной, нарушениями пигментного обмена и др.). Клиническая выраженность симптомов зависит от тяжести поражения и реализации мощной компенсаторной возможности органа. Характерным клиническим проявлением диффузного цитолиза и дистрофии гепатоцитов является синдром интоксикации — астения, повышенная утомляемость, недомогание, сонливость, разбитость, головокружение. Интоксикация определяется метаболическими изменениями, обусловленными нарушением детоксической функции печени (аутоинтоксикация), обычно не сопровождается лихорадкой. С цитолизом связано нарушение пигментного обмена, что проявляется желтухой кожных покровов и слизистых оболочек, потемнением мочи и ахолией кала. Типичным признаком гепатита является увеличение размеров печени, плотновато-эластическая консистенция органа, восстановление размеров по мере обратного развития заболевания. Диспепсические жалобы обусловлены нарушением функции желчеобразования и выделения желчи, вовлечением в процесс гастродуоденальной и панкреатической зоны. Характерны снижение аппетита, тошнота, возможна рвота, ощущение дискомфорта и(или) болей в эпигастральной области и правом подреберье. При тяжелой форме заболевания проявлением нарушения белковосинтетической функции печени становится геморрагический синдром, обусловленный дефицитом факторов свертывания, синтезируемых печенью (протромбин, проакцеле-рин, проконвертин), а также дефектами противосвертывающей системы крови.
Основными лабораторными критериями цитолитического синдрома являются: повышение активности АлАТ и АсАТ, уровня железа в сыворотке крови («прямые» признаки), снижение синтеза альбумина, протромбина и других факторов свертывания крови, эфиров холестерина, а также повышение уровня билирубина в крови за счет связанной, а при тяжелых формах — возможно и свободной фракции («косвенные» признаки).
Синдром внутрипеченочного холестаза обусловлен нарушением оттока желчи в результате снижения секреторной функции гепатоцитов. В подавляющем большинстве случаев холестаз при гепатитах сочетается с синдромом цитолиза. В основе холестаза лежат снижение проницаемости мембран, нарушение чрезмембранного транспорта, нарушение метаболизма холестерина и желчных кислот. Усиление холестатического синдрома при вирусных гепатитах может быть связано с предшествующим токсическим поражением печени (суррогаты алкоголя, гепатотоксичные лекарственные средства, наркотики и др.). Клинически холестаз характеризуется стойкой интенсивной желтухой, нередко приобретающей застойный зеленоватый оттенок, кожным зудом, длительной холурией и ахолией кала.
Лабораторными маркерами холестаза служат гипербилирубинемия (за счет связанной фракции), увеличение содержания в крови желчных кислот, холестерина, меди, повышение активности экскреторных ферментов (щелочной фосфатазы, гаммаглутаминтранспептида-зы, 5-нуклеотидазы).
Мезенхимально-воспалительный синдром, выраженный в большей или меньшей степени, свойствен большинству заболеваний печени и связан с реакцией ретикулоэндотелиальной системы на антигенную стимуляцию. Мезенхимально-воспалительный синдром приобретает важное значение в развитии и прогрессировании хронических гепатитов, с ним связан активный фиброгенез, формирование цирроза, портальная гипертензия и др. Основными клиническими проявлениями синдрома являются повышение температуры тела (субфебрильное), стойкое увеличение и плотная консистенция печени, спленомегалия, косвенным проявлением служит портальная гипертензия (асцит, усиление венозного рисунка на передней брюшной стенке, варикозное расширение вен пищевода, желудка). Лабораторными признаками мезенхимально-воспалительного синдрома являются повышение уровня а2-глобулинов и выраженная гилергамма-глобулинемия, увеличение содержания иммуноглобулинов всех классов, изменение количества лейкоцитов в периферической крови и увеличение СОЭ, снижение сулемового титра и повышение тимоловой пробы.
У отдельных больных могут превалировать проявления одного из указанных синдромов.
Гепатит А
Син.: эпидемический гепатит, болезнь Боткина
Гепатит А (ГА, Hepatitis А) — острая циклическая вирусная инфекция с фекально-оральным механизмом передачи возбудителя, характеризующаяся нарушением функции печени и нередко желтухой.
Этиология. Возбудитель (ВГА, HAV) — энтеровирус тип 72, относится к роду Enterovirus, семейству Picornaviridae. Известны 7 генотипов. Это РНК-содержащий вирус, имеющий диаметр около 28 нм
Возбудитель устойчив во внешней среде: при комнатной температуре может сохраняться в течение нескольких недель или месяцев, а при 4 °С — несколько месяцев или лет. Вирус инактивируется при кипячении в течение 5 мин, чувствителен к формалину и ультрафиолетовому облучению, стандартным дезинфекционным средствам (хлорамин в концентрации 1 г/л вызывает полную инактивацию вируса при комнатной температуре через 15 мин).
Эпидемиология. ГА — антропонозная кишечная инфекция. Источником возбудителя являются больные субклиническими и манифестными формами заболевания. Выделение больными вируса с фекалиями обычно продолжается 2—3 нед и начинается в конце инкубационного периода, интенсивно происходит весь продромальный (преджелтушиый) период и сохраняется первые дни желтухи (разгара болезни). Имеются данные о более продолжительном вирусовыделе-нии. Наибольшее эпидемиологическое значение имеют больные инаппарантными, стертыми и безжелтушными формами ГА, число которых может во много раз превышать число больных желтушными формами ГА
Фекально-оральный механизм заражения ГА реализуется через водный, пищевой и контактно-бытовой пути передачи вирусов. Особое значение имеет водный путь передачи вируса ГА, обеспечивающий возникновение эпидемических вспышек инфекции. Крупные водные эпидемии и вспышки связаны с фекальным загрязнением водоемов, служащих источником водоснабжения. Во многих странах высокая заболеваемость ГА непосредственно связана с отсутствием свободного доступа населения к достаточному количеству безопасной в эпидемиологическом отношении воды.
Контактно-бытовой путь передачи инфекции обусловлен низким уровнем санитарной культуры и часто реализуется в детских коллективах. ГА относят к «болезням грязных рук». Заражение может происходить через контаминированные бытовые предметы, игрушки.
Регистрируются групповые заболевания, связанные с пищевым путем передачи инфекции. При этом заражение возможно в результате употребления в пищу продуктов без предварительной термической обработки или загрязнения уже готовых блюд. Важное значение в качестве источников инфекции имеют лица, занятые приготовлением пищи, или продавцы продовольственных товаров.
Восприимчивость к ГА всеобщая. Наиболее часто заболевания возникают у детей старше 1 года (особенно в возрасте 3—12 лет, в организованных коллективах) и у молодых лиц. Дети до 1 года малочувствительны к заражению, так как у них сохранен пассивный иммунитет от матери. У большинства людей в возрасте старше 30—35 лет обнаруживается активный иммунитет в отношении ГА, при этом в крови 60—97 % доноров регистрируют антитела к вирусу (анти-HAV-IgG).
ГА свойственно сезонное повышение заболеваемости в летне-осенний период. Широкое распространение ГА ведет к формированию обширной прослойки иммунного населения, что определяет периодичность в динамике заболеваемости. Отмечаются периоды подъема заболеваемости через 5—20 лет.
Инфекция регистрируется как в виде эпидемий и крупных вспышек, так и спорадических заболеваний. ГА встречается практически повсеместно и относится к наиболее распространенным в мире кишечным инфекциям. Максимальный уровень заболеваемости регистрИруется в странах Азии, Африки, Латинской Америки, что связано с условиями жизни и низким уровнем санитарной культуры населения. Возможен завоз ГА в благоприятные в эпидемиологическом отношении страны ладами, выезжавшими в гиперэндемичные регионы
Патогенез и патологоанатомическая картина. ГА — доброкачественная циклическая инфекция, протекающая со сменой фаз и периодов.
После проникновения вируса ГА в организм больного с пишей или водой происходит первичная репликация в эндотелии слизистой оболочки тонкой кишки и мезентериальных лимфатических узлах. Затем вирус попадает в кровь. Вирусе-мия сопровождается возникновением интоксикационного синдрома в начальный (продромальный) период болезни и диссеминацией возбудителя в печень. Проникновение вируса в гепатоциты и его репликация приводят к нарушению функции клеточных мембран и внутриклеточного метаболизма с развитием цитолиза и дистрофии печеночных клеток. Наряду с прямым цитопатическим действием вируса в повреждении гепатоцитов имеют значение иммунные механизмы.
Воспалительные и некробиотические процессы развиваются преимущественно в перипортал ьной зоне печеночных долек и портальных трактах. При морфологическом исследовании выявляют различную степень дистрофии гепатоцитов и их фокальные некрозы (при ГА объем некроза печеночной ткани ограничен), пролиферацию и активизацию звездчатых эндотелиоцитов (клеток Купфера), лимфомоно цитарную инфильтрацию.
В результате морфологических изменений печеночной ткани развиваются характерные клинико-биохимические синдромы — цитолитический, мезенхимально-воспалительный и хо-лестатический.
Из пораженных гепатоцитов вирус с желчью попадает в кишечник и выделяется из организма с фекалиями.
Инфекция имеет самолимитирующий характер, сопровождается обратимыми структурно-функциональными изменениями печени.
Вирус ГА отличается высокой иммуногенностью. Быстрый и мощный иммунный ответ блокирует реплика цию возбудителя и прекращает его распространение на неинфицированные печеночные клетки. В результате специфической сенсибилизации лимфоцитов происходит антителоопосредованный лизис инфицированных гепатоцитов натуральными киллерами, что приводит к элиминации возбудителя.
Гуморальный иммунный ответ характеризуется ранним синтезом антител к вирусу ГА (анти-HAV): в кон це инкубационного, продромальном и начале периода разгара обнаруживается в нарастающем титре анти-HAV IgM. С появлением желтухи в период разгара, как правило, происходит освобождение организма от вируса и в период реконвалесценции выявляются анти-HAV IgG, которые обнаруживаются спустя много лет после перенесенного ГА. Формируется стойкий иммунитет.
Хронические формы инфекции, в том числе вирусоноси-тельство, при ГА не установлены. Прогрессирующие и молниеносные формы вирусного гепатита у лиц, инфицированных вирусом ГА, связывают с ассоциированной вирусной инфекцией (HBV, HCV, аденовирусы, герпесвирусы и др.) и воздействием дополнительных факторов (токсические поражения, дефекты иммунной системы и др.).
Клиническая картина. ГА характеризуется полиморфизмом клинических проявлений. Различают инаппарантную (субклиническую) и манифестные формы — стертую, безжелтушную и желтушную, по тяжести — легкую, средней тяжести и тяжелую. По течению выделяют острую и затяжную формы.
При ГА в большинстве случаев развивается инаппарантная форма, выявление которой затруднено и основано исключительно на результатах лабораторного обследования.
В манифестных случаях болезни выделяют следующие периоды: инкубационный, преджелтушный (продромальный), разгара (желтушный) и реконвалесценции.
Инкубационный период ГА составляет в среднем 21— 28 дней (7—50 дней).
Продромальный (преджелтушный) период продолжается в среднем 5—7 дней и характеризуется разнообразными клиническими проявлениями. По ведущему синдрому выделяют несколько вариантов его течения: гриппоподобный (лихорадочный), диспепсический, астеновегетативный и смешанный. Наиболее часто при ГА встречается лихорадочный вариант продрома в сочетании с диспепсическими жалобами. Заболевание начинается остро с повышения температуры тела до 38—39 °С, которая сохраняется 1—3 дня. Больных беспокоят головная боль, общая слабость, разбитость, возможны умеренно выраженные признаки воспаления верхних дыхательных путей, как при ОРЗ. При этом с большим постоянством больные отмечают снижение или отсутствие аппетита, дискомфорт и ощущение тяжести в эпигастральной области. При диспепсическом варианте преджелтушного периода возникают боли разной интенсивности в эпигастральной области и правом подреберье, тошнота и рвота.
Астеновегетативный синдром сопровождается выраженной общей слабостью, повышенной утомляемостью, снижением работоспособности, сонливостью, головокружением.
Через 2—4 дня изменяется цвет мочи, она становится темно-коричневой, цвета крепкого чая. В конце преджелтушного периода кал обычно обесцвечивается (ахолия), приобретает вид белой глины, может быть неоформленным. В этот период при осмотре больного выявляют важный диагностический признак заболевания — увеличение размеров печени, причем пальпация ее может быть болезненной. Иногда уже в этот период определяется увеличение селезенки.
Период разгара продолжается в среднем 2—3 нед (с колебаниями от 1 нед до 1,5—2 мес). Наиболее полно картина болезни представлена при заболевании средней тяжести, протекающем обычно с желтухой. Как правило, возникновение желтухи сопровождается заметным улучшением самочувствия больных — нормализацией температуры тела, уменьшением или исчезновением головной боли и других проявлений интоксикации, что служит важным дифференциально-диагностическим признаком ГА. В разгаре заболевания сохраняются общая слабость, астения, выраженность и продолжительность которых зависят от формы тяжести ГА. Как правило, в желтушный период заболевания сохраняются диспепсические симптомы. Характерны ощущения тяжести и распирания в эпигастральной области и в правом подреберье, усиливающиеся после приема пищи, тошнота, редко — рвота.
В развитии желтухи различают фазы нарастания, максимального развития и угасания. В первую очередь желтуха обнаруживается на слизистой оболочке рта (уздечка языка, твердое небо) и склерах, в дальнейшем появляется на коже. Обычно интенсивность желтухи соответствует тяжести болезни. При тяжелых формах заболевания желтуха приобретает шафрановый оттенок.
При обследовании больных обращают на себя внимание склонность к брадикардии и артериальной гипотензии, приглушение сердечных тонов. Язык обложен белым или желтоватым налетом. Размеры печени увеличены, определяется ее закругленный и болезненный край. В '/3 случаев отмечается небольшая спленомегалия. В этот период наиболее выражены потемнение мочи и обесцвечивание кала.
Фаза угасания желтухи протекает обычно медленнее, чем фаза нарастания, и характеризуется постепенным исчезновением признаков болезни.
С исчезновением желтухи наступает период реконвалесценции, продолжительность которого весьма вариабельна (от 1—2 до 8—12 мес). В это время у больных восстанавливается аппетит, угасают астеновегетативные симптомы, нормализуются размеры печени и функциональные печеночные тесты.
Безжелтушные и стертые формы ГА протекают легко, ма-лосимптомно. При этом важное диагностическое значение приобретают обнаружение гепатомегалии и результаты лабораторных методов диагностики.
У 5—10 % больных развивается затяжная форма болезни
продолжительностью до нескольких месяцев, характеризующаяся монотонной динамикой клинико-лабораторных показателей. Как правило, затяжные формы ГА заканчиваются выздоровлением больных.
Схема 2. Ранняя (в продромальном периоде) диагностика ГА
4. Холурия (иногда и ахолия кала)
К осложнениям ГА относят обострения и рецидивы болезни.
В период угасания симптомов у отдельных больных наступают обострения, проявляющиеся усилением клинических и(или) биохимических проявлений заболевания.
Рецидивы возникают в период реконвалесценции через 1— 6 мес после клинического выздоровления и нормализации функциональных печеночных тестов и характеризуются возвратом клинических и биохимических симптомов разгара болезни. Затяжные формы ГА, обострения и рецидивы болезни требуют пристального наблюдения и лабораторно-морфологи-ческого обследования для исключения возможной ассоциированной инфекции (HBV, HCV и др.).
Помимо указанных осложнений у ряда больных могут появляться признаки поражения желчных путей (дискинезии, воспалительные процессы).
Исходом ГА у 90 % больных является полное выздоровление. В остальных случаях отмечаются остаточные явления в виде гепатофиброза, астеновегетативного (постгепатитного) синдрома. ГА может привести к манифестации синдрома Жильбера (наследственного пигментного гепатоза) с повышением в сыворотке крови уровня свободного билирубина.
Прогноз благоприятный. Летальность не превышает 0,04 %.
Диагностика. Диагноз ГА устанавливают с учетом комплекса эпидемиологических данных (развитие болезни после контакта с больным ГА или пребывание в неблагополучном районе в период, соответствующий инкубации ГА), клинических проявлений (циклическое развитие заболевания с возникновением характерных синдромов, включающих желтуху) и результатов лабораторных исследований (схема 2). Важным объективным признаком ГА является гепатомегалия, обнаруживаемая уже в преджелтушном периоде.
Наиболее постоянным лабораторным показателем, отражающим наличие гепатита (цитолитического синдрома), является повышение активности АлАТ в 10 раз и более по сравнению с нормой, что имеет важное диагностическое значение. Повышение активности АлАТ выявляется уже в продромальный (преджелтушный) период, сохраняется в разгар заболевания. Нормализация показателя происходит после угасания клинических проявлений заболевания и служит критерием выздоровления.
Ранним показателем нарушения пигментного обмена является обнаружение уробилиногена и желчных пигментов в мо-
I.
Кишечная инфекция?
Наиболее диагностически значимые признаки: Интоксикационный синдром (лихорадка, слабость, миалгий, артралгии и др.) Диспепсический синдром (анорексия, тошнота, рвота, дискомфорт и боли в эпигастрии и правом подреберье и др.) Гепатомегалия
3.
Генерализованная кишечная инфекция?
L
Решение вопроса о степени вовлечения в патологический процесс гепатобилиарной системы. Дифференциальная диагностика с другими генерализованными кишечными инфекциями
Генерализованная кишечная инфекция с нарушением пигментного обмена
Гепатит?
т
Вспомогательные диагностические признаки:
-
Эпидемиологический анамнез, детализированный с учетом водного, алиментарного и контактно-бытового путей передачи возбудителя на протяжении 1,5 мес до настоящего заболевания
-
Молодой, как правило, возраст
-
Микросимптомы болезни: признаки ваготонии, зуд кожи и др.
-
Гематологические сдвиги: лейкопения, относительный лимфоци-тоз, замедление СОЭ
"1
Вирусный гепатит? 1
Решающие диагностические признаки:
-
Результаты биохимического исследования (маркеры синдромов цитолиза, мезенхимального воспаления, холестаза)
-
Результаты серологического обследования (обнаружение IgM-анти-ВГА)
Вирусный гепатит А
че.
Увеличение содержания билирубина в
крови преимущественно за счет
связанной его фракции наблюдается при
желтушной форме болезни. Для ГА
характерно изменение белко-воосадочных
тестов — повышение тимоловой пробы и
снижение сулемового титра. В разгар
заболевания выявляются лей
копения, нейтропения, относительный лимфо- и моноцитоз, нормальная или сниженная СОЭ.
Достоверная верификация диагноза ГА достигается серологическими методами (РИА, ИФА и др.) путем обнаружения в крови анти-HAV IgM в продромальный период и период разгара. Анти-HAV IgG, обнаруживаемые в период реконвалес-ценции, имеют анамнестическое значение (рис. 7).
Дифференциальный диагноз ГА в продромальный период проводится с гриппом и другими ОРВИ, тифо-паратифозны-ми заболеваниями, малярией. В период разгара ГА дифференцируют с лептоспирозом, инфекционным мононуклеозом, псевдотуберкулезом, желтой лихорадкой, а также неинфекционными желтухами — гемолитической, обтурационной, токсическими гепатитами.
Лечение. Большинство больных ГА не нуждаются в активных лечебных мероприятиях. Больным следует создать благоприятные условия для функционирования поврежденной печени и самоизлечения. Это достигается щадящим режимом и рациональной диетой.
Постельный режим показан в период разгара болезни. По мере улучшения состояния больного режим постепенно расширяют, ограничивая физическую активность.
Диета (стол № 5 по Певзнеру) предусматривает калорийную пищу (соответственно физиологической норме), содержащую полноценные белки, жиры (за исключением трудно-перевариваемых: бараньего, свиного, говяжьего) и углеводы. Из рациона исключают продукты питания, оказывающие неблагоприятное действие на печень и требующие ее усиленной работы (копчености, острые приправы, маринады, чеснок, грибы и др.). Объем жидкости (включая щелочные минеральные воды) составляет 2—3 л в сутки. Целесообразно добавление в рацион свежих овощей, фруктов и соков, богатых витаминами. Рекомендован частый (5—6 раз в сутки) прием пищи.
Ограничение физических нагрузок и соблюдение диеты показаны в течение 6 мес после перенесенного заболевания, так как клиническое выздоровление значительно опережает патоморфологическое восстановление печеночной ткани. В это время следует исключить алкогольсодержащие напитки.
При средней тяжести и тяжелом течении ГА проводят де-зинтоксикационную терапию, с применением энтеральных (полифепан, энтеродез, оралит, цитроглюкосолан и др.) и ин-фузионных (растворы Рингера, глюкозы, коллоидов и др.) средств.
В период реконвалесценции, особенно при затяжном течении ГА, назначают метаболическую терапию, включающую сбалансированное введение витаминов группы В, С, жирорастворимых А, Е, а также гепатопротекторов (легален, карсил или силибор, эссенциале и др.). По показаниям применяют спазмолитики, желчегонные препараты (обычно холекине-тики).
Реконвалесценты ГА подлежат диспансерному клинико-ла-бораторному наблюдению.
Профилактика. Проводят комплекс санитарно-гигиенических мероприятий. Инфицированные лица изолируются на 28 дней от начала болезни. Лица, контактировавшие с больными, подлежат наблюдению и биохимическому обследованию на протяжении 35 дней после изоляции больного. В очагах проводится дезинфекция хлорсодержащими препаратами, вещи больных подвергаются камерной дезинфекции.
По эпидемическим показаниям проводится иммунопрофилактика ГА с помощью донорского иммуноглобулина (Globuman). Препарат вводят однократно внутримышечно не позже 10—14-го дня после контакта с больным (детям до 10 лет по 1 мл, старше 10 лет и взрослым — 1,5 мл). Защитное действие пассивной иммунизации ограничивается 3—5 мес. Для профилактики ГА применяют коммерческий иммуноглобулин с известным содержанием специфических антител к вирусу ГА.
В настоящее время успешно осуществляется активная иммунизация в регионах с высоким уровнем заболеваемости ГА. Вакцинопрофилактику проводят также лицам, выезжающим в эпидемиологически неблагоприятные регионы. Применяют инактивированные вакцины (Havrix, Avaxim и др.), обеспечивающие иммунитет на 10 лет и более.
Гепатит Е
Син. — гепатит ни А ни В с фекально-оральным механизмом заражения
Гепатит Е (ГЕ, Hepatitis Е) — острая вирусная циклическая инфекция с фекально-оральным механизмом заражения, склонная к эпидемическому распространению в основном в регионах с жарким климатом, отличающаяся большой частотой неблагоприятных исходов у беременных.
Этиология. Возбудитель ГЕ (HEV)— РНК-содержащий вирус размером 27—30 им. Возбудитель менее вирулентен и менее устойчив во внешней среде, чем вирус ГА.
Эпидемиология. Источником инфекции при ГЕ служит больной человек, выделяющий вирусы с фекалиями преимущественно в ранние сроки заболевания. Обсуждается возможность существования резервуаров инфекции вне человеческой популяции (грызуны, свиньи).
Механизм передачи инфекции — фекально-оральный, преимущественно с водным путем заражения. Возможно инфицирование алиментарным путем при употреблении в пищу термшески необработанных моллюсков и ракообразных. Контактно-бытовой путь заражения реализуется очень редко, что связано со значительно меньшей концентрацией вируса в фекалиях больного по сравнению с ГА. Инфицирующая доза вируса ГЕ в 2 раза выше, чем при ГА.
Восприимчивость к ГЕ всеобщая. Преимущественно болеют взрослые в возрасте 15—40 лет, чаще — мужчины, жители сельской местности. В эндемических регионах тропического и субтропического пояса инфекция регистрируется постоянно.
Выделяют три генотипа HEV — Asia, Mexica и North America, изолированные в разных регионах.
Крупные водные эпидемии и вспышки описаны в странах Центральной и Южной Азии, Северной и Западной Африки, Центральной Америки. Эпидемии в основном возникают осенью, в сезон дождей и паводков крупных рек, с чем связано загрязнение источников водоснабжения сточными водами. Эпидемический процесс имеет эксплозивный характер с быстрым достижением максимального уровня распространения. Вспышки заболевания, как правило, связаны с неудовлетворительными условиями жизни населения.
В Европе возможна регистрация завозного ГЕ — «гепатит путешественников», причем занос инфекции не приводит к ее распространению.
Патогенез и патологоаиатомическая картина. Основные звенья патогенеза при ГЕ сходны с ГА. Вирус ГЕ обладает прямым цитопатическим действием и вызывает цитолиз гепатоцитов. Иммунопатологические механизмы не имеют существенного значения в патогенезе ГЕ. Быстрый иммунный ответ приводит к купированию инфекционного процесса, самолимитирующемуся течению инфекции. После перенесенного ГЕ формируется, как правило, протективный иммунитет, однако в гиперэндемичных очагах описаны случаи повторного заражения.
Механизм избирательно тяжелого течения ГЕ с угрозой летального исхода у беременных женщин остается неясным.
При ГЕ морфологические изменения печени сходны с ГА —типичен фокальный, редко зональный некроз. При фульминантном ГЕ у беременных выявляются признаки массивного или субмассивного некроза печени.
Клиническая картина. Инкубационный период при ГЕ колеблется от 20 до 65 дней. Заболевание может протекать в субклинической и манифестной формах. Основные клинические проявления сходны с ГА.
Преджелтушный период продолжается обычно 3—7 дней и сопровождается нарастающей общей слабостью, диспепсическим синдромом, иногда возникают боли в суставах и диарея. Возможно повышение температуры тела.
В разгар заболевания при появлении желтухи кожных покровов и слизистых оболочек самочувствие больных, как правило, не улучшается. Желтуха обычно кратковременна, как и интоксикация. Закономерно у больных определяется увеличение размеров печени и значительно реже, чем при ГА, сплено-мегалия. В большинстве случаев заболевание протекает в легкой и средней тяжести формах. Общая продолжительность клинических проявлений при ГЕ обычно составляет 2—3 нед. Инфекция заканчивается выздоровлением. Восстановительный период болезни протекает медленнее, чем при ГА. Хронические формы и длительное вирусоносительство не развиваются.
Особенностью ГЕ является избирательная тяжесть течения инфекции с угрозой летального исхода у беременных женщин, особенно при заражении во второй половине беременности. Гепатит и беременность оказывают выраженное взаи-моотягощающее влияние.
Тяжелые, нередко фульминантные, формы ГЕ у беременных (чаще на поздних сроках, после 24-й недели беременности) протекают с синдромом острой печеночной недостаточности, массивным геморрагическим синдромом и присоединением острой почечной недостаточности. Состояние больных резко ухудшается накануне родов или сразу после них, обычно отмечается большая кровопотеря в родах. При ГЕ у беременных стремительно нарастают желтуха кожных покровов, интоксикация, возникают повторная рвота, печеночная энцефалопатия с быстрой сменой стадий прекомы и комы. Наряду с нарушениями сознания у больных определяются «печеночный запах», тремор, тахикардия, значительно уменьшаются размеры печени, вплоть до симптома «пустого подреберья». Характерно развитие геморрагического синдрома в виде кровоизлияний в кожу и слизистые оболочки, кровотечений разной интенсивности, включая массивные послеродовые
маточные кровотечения. Возможно развитие тяжелого ДВС-синдрома. При ГЕ у беременных нередко возникает усиленный гемолиз эритроцитов с гемоглобинурией, что приводит к прогрессирующей острой почечной недостаточности.
При тяжелом течении ГЕ состояние больной резко ухудшается при часто случающемся самопроизвольном прерывании беременности (выкидыш, преждевременные роды). Даже при доношенной беременности дети нередко погибают в анте- и интранатальном периодах. Вероятность выживания плода и рождения полноценного ребенка невелика.
Прогноз. Течение ГЕ в общей популяции доброкачественное. Прогноз у беременных — неблагоприятный. Летальность при ГЕ среди беременных составляет 20—25 % (при некоторых эпидемиях достигает 40 %).
Диагностика. Распознавание ГЕ основано на клинико-эпи-демиологических данных с учетом географического анамнеза при исключении ГА, ГВ, ГС. Диагноз подтверждают обнаружением в крови анти-HEV IgM (методом ИФА), которые можно выявить на 10—12-й день болезни и в течение 1— 2 мес. В ранние сроки заболевания возможна индикация РНК HEV в крови и фекалиях методом ПЦР. Дополнительное значение имеет обнаружение вируса в фекалиях и биоптатах печени методом иммунофлюоресценции.
Лечение и профилактика. Лечение проводится, как при ГА. Больные ГЕ беременные женщины нуждаются в интенсивном стационарном наблюдении и, при тяжелом течении инфекции, проведении программы интенсивной терапии острой печеночной недостаточности, геморрагического синдрома и острой почечной недостаточности. Акушерская тактика сводится к максимально возможному сохранению беременности, предупреждению выкидыша и преждевременных родов. Искусственное прерывание беременности (на ранних сроках) возможно лишь в периоде реконвалесценции.
Профилактика проводится, как при ГА Рекомбинантная вакцина разрабатывается.
Гепатит В
Син.: сывороточный гепатит, шприцевой гепатит
Гепатит В (ГВ, Hepatitis В) — антропонозная вирусная инфекция с гемоконтактным механизмом заражения, протекающая с преимущественным поражением печени и многообразием проявлений от вирусоносительства до прогрессирующих форм гепатита с развитием острой печеночной недостаточности, цирроза печени и печеночно-клеточного рака.
Этиология. Возбудитель (HBV) — ДНК-содержащий вирус (вири-он — частица Dane) диаметром 42—45 нм, имеет липопротеидную оболочку и нуклеокапсид, сложную антигенную структуру. Известны различные антигенные варианты HBV, а также мутантные штаммы возбудителя, резистентные к противовирусной терапии.
Возбудитель устойчив во внешней среде (к низким и высоким температурам, многим дезинфектантам). Так, температуру 20 °С он выдерживает в течение 10 лет и более. Вирус устойчив к воздействию кислой среды, формалину, фенолу и др., инактивируется при автоклавировании (30 мин), стерилизации сухим паром (160 "С, 60 мин).
Эпидемиология. Источником инфекции при ГВ служат больные острыми и хроническими формами заболевания. При острой инфекции больной заразен с середины инкубационного периода, весь преджелтушный (продромальный) и период разгара до полной санации организма от возбудителя, причем возможна длительная перси-стенция вируса после перенесенного заболевания. Наибольшую эпидемиологическую опасность представляют больные бессимптомными формами ГВ, особенно хронические носители вируса. Кроме того, все варианты манифестной хронической инфекции, включая цирроз печени, могут сопровождаться пожизненной персистенцией HBV и представлять опасность как источники заражения.
Механизм заражения ГВ — гемоконтактный (парентеральный), который реализуется естественными и искусственными путями. Основным фактором передачи инфекции при ГВ является контамини-рованная кровь, причем для заражения достаточна минимальная инфицирующая доза (10~7 мл крови). Вирус ГВ может быть обнаружен и в других биологических жидкостях и тканях.
К естественным путям заражения относят половой и вертикальный. Половой путь реализуется при контактах с инфицированными партнерами. ГВ занимает важное место среди заболеваний, передающихся половым путем, особенно среди гомосексуальных партнеров, лиц с половыми перверсиями и большим числом половых партнеров, проституток. Вертикальная передача вируса ГВ происходит преимущественно во время родов, в 5 % случаев — внутриутробно. При наличии у матери HBeAg в крови (репликативной фазы инфекции) риск заражения детей значительно увеличивается.
Возможна бытовая гемоконтактная передача инфекции — в семейных очагах с активным источником инфекции (контакт с кровью при пользовании общими бритвенными приборами, ножницами, зубными щетками и др.).
Наряду с естественными существенное значение в распространении ГВ имеют искусственные (артифициальные) пути передачи вируса. К ним относится переливание крови и ее компонентов, причем с налаживанием контроля за донорами крови доля поеттрансфузион-ного ГВ значительно сократилась. Заражение ГВ возможно в ходе хирургических операций, при стоматологических, гинекологических, инструментальных лечебно-диагностических манипуляциях, разнообразных парентеральных процедурах, производимых недостаточно простерилизованными инструментами многоразового использования, загрязненными кровью.
В настоящее время, наряду с медицинскими манипуляциями, большое значение в распространении ГВ приобрели немедицинские парентеральные вмешательства. Значительно увеличилась и стала
1
74
175
преобладающей доля заражения ГВ при парентеральном введении наркотиков и их суррогатов.
Восприимчивость к вирусу ГВ высока. К группам высокого риска заражения относят реципиентов донорской крови — больных гемофилией, других гематологических больных, пациентов центров хронического гемодиализа, трансплантации органов и тканей, хронических больных, получающих разнообразную медицинскую помощь (больные ВИЧ/СПИДом, туберкулезом, онкологическими заболеваниями и др.).
Высок риск инфицирования парентеральных потребителей наркотиков, гомосексуалистов, лиц с множеством сексуальных партнеров, больных венерическими болезнями. Группой риска являются дети первого года жизни, заражение которых происходит либо от больной матери, либо в результате медицинских манипуляций. Инфекция регистрируется в разных возрастных группах —у людей среднего и старшего возраста в связи с ятрогенным инфицированием при наличии сопутствующих заболеваний, у подростков и молодежи — в связи с распространением наркомании.
ГВ является одной из наиболее опасных профессиональных инфекций для работников медицинских учреждений, имеющих непосредственный контакт с кровью (хирурги, акушеры, стоматологи, лаборанты, персонал центров гемодиализа и службы крови, медицинские сестры и др).
Сезонные колебания заболеваемости ГВ не характерны.
ГВ — одна из самых распространенных инфекций человека. Уровень заболеваемости на разных территориях колеблется в широких пределах. Частота выявления HBsAg среди доноров составляет до 1— 2 % в Северной Европе, Северной Америке и Австралии; около 2— 8 % в Центральной и Восточной Европе; более 8 % (до 20 %) в ряде районов Экваториальной и Северной Африки, Центральной и Юго-Восточной Азии, Китае и на Тайване; более 50 % в Океании. На долю азиатского континента приходится более 2/з всех инфицированных вирусом ГВ
Патогенез и патологоаиатомическая картина. Вирус ГВ имеет сложную структуру. Выделены антигенные системы вирио-на. Поверхностный анти ген — HBsAg, находящийся в липо-протеидной оболочке вируса, неоднороден и содержит груп-поспецифическую детерминанту а, две из четырех субтиповых детерминант d или у, г или w и дополнительные детерминанты (g, n, t и др.), определяющие существование самостоятел ь-ных подтипов HBsAg: ауг, ayw, adr, adw, которые распространены в различных географических зонах: adw преобладает в Северной Европе, Америке и Австралии, ayw — в Восточной Европе, Северной и Центральной Азии, Восточном Средиземноморье, Северной и Западной Африке; adr — в странах Юго-Восточной Азии, Китае, Японии.
HBsAg обнаруживается в виде сферических (22 нм) и тубу-лярных (длиной до 700 нм) частиц в крови, гепатоцитах, сперме, влагалищном секрете, цереброспинальной жидкости, синовиальной жидкости, грудном молоке, слюне, слезах, моче за 1—1,5 мес до первых клинических проявлений болезни, на протяжении всего продромального и первые 2—3 нед желтушного периодов. Персистенция HBsAg в крови более 7—8 нед указывает на возможность перехода процесса в хроническую форму- Сердцевинный (core) антиген — HBcAg выявляется в ядрах и перинуклеарной зоне гепатоцитов (отсутствует в крови). В состав нуклеокапсида HBV также входит е-антиген — HBeAg, его появление в крови обусловлено ДНК-полимераз-ной активностью и указывает на репликативную активность возбудителя, подтверждая наличие HBcAg в гепатоцитах. Лица с HBeAg в крови наиболее опасны в эпидемиологическом отношении. Персистенция HBeAg более 3—4 нед от начала болезни может указывать на переход гепатита в хроническую форму. Мутантный вариант вируса связывают с невозможностью экспрессии HBeAg, при сохранении продукции анти-НВе.
Из места внедрения вирус ГВ гематогенно достигает печени, где происходит репликация вирионов и их антигенов, развиваются некробиотические и воспалительные изменения, соответствующие цитолитическому, мезенхимально-воспали-тельному и холестатическому синдромам. Вирус ГВ не обладает прямым цитопатическим действием. Повреждение печени при ГВ иммуноопосредовано, обусловлено силой и характером иммунного ответа на экспрессию антигенов вируса ГВ на печеночноклеточных мембранах и определяется степенью ин-фекционности, вирулентности и дозой вирусов, активностью системы интерферона, иммуногенетическими свойствами инфицированного организма.
В генезе цитолиза существенная роль отводится иммунопатологическим реакциям, индуцированным антигенами вирусов, локализованными в мембранах гепатоцитов, и фиксацией на них антител и комплемента. Происходят усиление пере-кисного окисления липидов клеточных мембран с повышением их проницаемости, выход лизосомальных гидролаз в цитоплазму гепатоцитов, нарушение структуры и повреждение митохондрий, увеличение внутриклеточного содержания ионов натрия и кальция, а также другие процессы, определяющие нарушение внутриклеточного метаболизма и повреждение печеночных клеток.
Развитие острой циклической формы ГВ отражает нормальную иммунную реакцию организма в ответ на внедрение возбудителя. Цитолиз гепатоцитов иммунокомпетентными клетками (лимфоцитами-киллерами, сенсибилизированными к экспрессированным на гепатоцитарных мембранах антигенным детерминантам вируса ГВ, А-клетками и др.) приводит к повторной гематогенной диссеминации вирусов, нарастанию иммунного ответа, сенсибилизации В-лимфоцитов, продукции антител и при циклическом течении процесса — к элиминации возбудителей. Исчезновение вируса из организма — ре-
176
- Шувалова
177
зультат разрушения всех инфицированных клеток и подавления различных фаз репликации вируса вырабатываемым интерфероном. Реакция гуморального звена иммунитета проявляется накоплением специфических антител к антигенам вируса ГВ. В острую фазу болезни в крови обнаруживают анти-НВс Ig класса М, затем G, позже — анти-НВе и последними, обычно через несколько месяцев после клинического выздоровления — анти-HBs. Образующиеся иммунные комплексы, включающие антигены, антитела и СЗ-компонент комплемента, фагоцитируются макрофагами и выделяются из организма. Вместе с тем циркулирующие иммунные комплексы могут участвовать в иммунопатологических реакциях. В 80—85 % случаев HBV-инфекция завершается выздоровлением.
Молниеносные, злокачественные формы ГВ в значительной степени обусловлены генетически детерминированной гиперергической реакцией иммуноцитов на достаточно чужеродные в антигенном отношении вирусы при низком интер-фероновом ответе.
Вместе с тем низкая патогенность и антигенная чужерод-ность вирусов, неэффективность клеточного и гуморального иммунитета, дефектность интерфероновой системы приводят к нарушению элиминации вируса, развитию состояния носи-тельства или хронических повреждений печени.
Механизмы хронизации и прогрессирования ГВ могут быть представлены недостаточным (неадекватным) иммунным ответом в сочетании с высокой репликативной активностью вируса или низкой репликативной активностью вируса с интеграцией генетического аппарата HBV в геном гепатоцита; мутацией вирусов; снижением продукции альфа-интерферона; аутоиммунными механизмами; внепеченочной репликацией вируса; иммуногенетической предрасположенностью.
Аутоиммунные механизмы обусловлены интерференцией вирусспецифических белков возбудителя и структурных субъединиц печеночных клеток.
Генетическая предрасположенность к ГВ нашла подтверждение в эпидемиологических характеристиках инфекции у представителей разных рас. HBs-антигенемия максимально распространена в странах Центральной Африки, Юго-Восточной Азии, Латинской Америки, Австралии, Океании, где преобладают лица со слабым иммунным ответом. Эти регионы отличаются наиболее высокой заболеваемостью гепатоцеллю-лярной карциномой. Вместе с тем частота острых манифестных форм в гиперэндемичных регионах небольшая. В странах Европы и Северной Америки преобладание лиц с адекватной силой иммунного ответа определяет большую частоту острой манифестной инфекции с выздоровлением.
Прогрессирование хронического ГВ приводит к развитию цирроза печени, острой печеночной недостаточности, гепатоцеллюлярному раку и другим неблагоприятным исходам. Наблюдающиеся при прогрессирующих формах острого и хронического ГВ острая токсическая дистрофия, массивный и субмассивный некроз печени приводят к развитию острой печеночной недостаточности (ОПН), сопровождающейся накоплением в крови токсичных метаболитов (аминокислоты, ароматические соединения, фальш-медиаторы, свободный билирубин, бактериальные токсины, продукты распада клеток и др.) —так называемая метаболическая буря, с поражением ЦНС в виде неврологических и психических расстройств. Водно-электролитные и кислотно-основные нарушения приводят к отеку-набуханию головного мозга. Резко снижается синтез печенью факторов свертывания крови, нарушаются калликреин-кининовая система и антитрипсиновая активность крови, обусловливающие развитие массивного геморрагического синдрома. ОПН — основная причина гибели больных ГВ.
Морфологические изменения при остром ГВ характеризуются более значительными, чем при ГА, некробиотическими процессами, локализованными чаще в центролобулярной и мезолобулярной зонах печеночной дольки. Наблюдаются гид-ропическая дистрофия и влажный некроз гепатоцитов, сухой некроз с образованием телец Каунсилмена, характерны «ступенчатые» некрозы — зональные, а при тяжелом течении болезни—субмассивные и массивные. Часто обнаруживаются мостовидные некрозы, соединяющие центральные и перипор-тальные зоны и портальные тракты или центры соседних долек. Наиболее часто мостовидные некрозы выявляются при прогрессирующих формах болезни.
В период разгара ГВ дистрофические и некробиотические изменения сопровождаются активизацией и пролиферацией звездчатых эндотелиоцитов (клетки Купфера), перемещающихся к зонам некроза, где вместе с лимфоцитами, гистиоцитами, плазматическими и другими клетками они образуют мо-нонуклеарные инфильтраты, преимущественно в перипор-тальной и перивенулярной зонах печеночной дольки.
Для холестатической формы ГВ характерны поражение внутрипеченочных желчных протоков, образование в них «желчных тромбов», «перистая» дегенерация гепатоцитов и накопление в них желчных пигментов.
Морфологические критерии диагностики хронического ГВ включают оценку степени активности гепатита и выраженность фиброза по результатам гистологического исследования ткани печени. Система Knodell учитывает портальное воспаление, интралобулярную дегенерацию и фокальный некроз, перипортальный некроз с наличием мостовидных некрозов или без них, что позволяет определить минимальную, низкую, умеренную, выраженную активность патологического процесса. Оценивается отсутствие или наличие фиброза печеночной ткани (слабовыраженный, умеренный, выраженный).
В пораженных гепатоцитах часто обнаруживаются HBV и его антигены (метод иммунофлюоресценции, окраска орцеи-ном, ПЦР).
Клиническая картина. ГВ характеризуется широким спектром клинических проявлений. Выделяют острый гепатит, представленный циклическими (самолимитирующимися) формами: острый ГВ — субклиническая, безжелтушная, желтушная (с преобладанием цитолиза или холестаза); острый ГВ с холестатическим синдромом, а также прогрессирующими формами: молниеносный (фульминантный, злокачественный) гепатит. По тяжести заболевания выделяют легкие, средней тяжести, тяжелые формы.
Хроническая форма инфекции: хронический ГВ — фазы репликативная и интегративная, разная степень активности (морфологическая, клинико-биохимическая). Цирроз печени. Гепатоцеллюлярная карцинома.
Наиболее частой среди манифестных форм ГВ является острая циклическая желтушная форма с цитолитическим синдромом.
Выделяют следующие периоды болезни: инкубационный, преджелтушный (продромальный), желтушный и реконвалес-ценции.
Продолжительность инкубационного периода составляет от 50 до 180 дней. Преджелтушный период длится в среднем 4— 10 дней, реже увеличивается до 3—4 нед, имеет различные проявления. Обычно интоксикация и диспепсические жалобы выражены умеренно. Возможен астеновегетативный вариант продромального периода со значительной общей слабостью, недомоганием, повышенной утомляемостью, сонливостью, головокружением. Нередко возникают боли в суставах, усиливающиеся ночью (артралгический вариант продромального периода). Возможна сыпь на коже (уртикарная). Встречается лихорадочная реакция, но значительно реже, чем при ГА. В 5—7 % случаев первые клинические признаки гепатита совпадают с появлением желтухи кожных покровов (латентный вариант преджелтущного периода).
В конце преджелтушного периода увеличиваются размеры печени и селезенки, происходит потемнение мочи и обесцвечивание кала. При лабораторном исследовании в моче обнаруживают уробилиноген, иногда желчные пигменты, в крови — повышение активности АлАТ, наличие HBsAg.
Продолжительность желтушного периода 2—6 нед с колебаниями от нескольких дней до нескольких месяцев. Первоначально желтуха появляется на склерах, слизистой оболочке рта в области твердого неба и на уздечке языка, позднее окрашивается кожа. Интенсивность желтухи обычно соответствует степени тяжести болезни. При яркой желтухе нередко выявляется геморрагическая сыпь на коже.
В этот период отмечаются симптомы интоксикации: общая слабость, раздражительность, головная боль, поверхностный сон, снижение аппетита вплоть до анорексии при тяжелых формах, тошнота, иногда рвота. Больных беспокоит ощущение тяжести и в эпигастральной области и правом подреберье, особенно после еды. Могут наблюдаться резкие боли в области печени, обусловленные перигепатитом, холангиогепатитом или начинающейся гепатодистрофией. В ряде случаев отмечается зуд кожи, связанный с холестатическим компонентом. Закономерной реакцией на синдром интоксикации являются артериальная гипотензия, приглушенность сердечных тонов и систолический шум на верхушке сердца. При интенсивной желтухе возникает брадикардия.
Язык больных обычно покрыт белым или бурым налетом. Как правило, выявляется гепатомегалия и часто спленомега-лия, причем пальпация печени умеренно болезненная, консистенция эластическая или плотноэластическая, поверхность гладкая. Сокращение размеров печени на фоне прогрессирующей желтухи и интоксикации часто указывает на развивающуюся ОПН. Плотная консистенция печени, сохраняющаяся после исчезновения желтухи, заостренный край органа могут свидетельствовать о переходе болезни в хроническую форму.
Угасание желтухи обычно происходит более продолжительно, чем нарастание, сопровождается постепенным улучшением состояния больных и восстановлением функциональных печеночных показателей. В фазе угасания возможно развитие обострений болезни, которые могут иметь клинические и(или) биохимические проявления.
В период реконвалесценции (2—12 мес) основные симптомы болезни исчезают, но длительно сохраняются астеновегетативный синдром, ощущение дискомфорта в правом подреберье. Возможно развитие рецидивов болезни с характерными клинико-биохимическими или биохимическими проявлениями.
При легкой форме ГВ желтуха и интоксикация непродолжительны (около 10 дней), билирубинемия не превышает 85— 100 мкмоль/л, диспротеинемия не характерна. При средней тяжести заболевания умеренно выраженные интоксикация и желтуха сохраняются в течение 2—3 нед, уровень билирубина в сыворотке крови менее 200 мкмоль/л, активность АлАТ и другие печеночные функциональные тесты нормализуются в течение 7—8 нед.
При тяжелой форме болезни значительно выражен синдром интоксикации в виде астении, головной боли, анорексии, тошноты и рвоты. Часто возникают признаки геморрагического синдрома в сочетании с яркой («шафранной») желтухой. Резко нарушены все функциональные тесты печени. При неосложненном течении тяжелые формы ГВ заканчиваются выздоровлением через 10—12 нед и более.
Безжелтушные и стертые формы ГВ напоминают преджелтушный период острой циклической желтушной формы, часто заканчиваются развитием хронических форм инфекции.
Острый ГВ с холестатическим синдромом характеризуется признаками цитолиза в сочетании с выраженным внутрипече-ночным холестазом. Наряду с типичными проявлениями гепатита отмечается длительно сохраняющийся холестаз, который проявляется зудом кожи, интенсивной желтухой застойного характера, ахоличным калом и темной мочой. Прогноз обычно благоприятный, несмотря на длительное течение болезни. Предрасполагающим фактором к развитию внутрипеченочно-го холестаза является прием алкоголя или гепатотоксичных лекарственных препаратов, особенно в продромальном периоде вирусного гепатита.
Холестатическая форма ГВ развивается редко и представляет большие трудности для отграничения от механической (обтурационной) желтухи. Эта форма проявляется клиническими и биохимическими симптомами внутрипеченочного холестаза при отсутствии выраженного цитолиза, может переходить в хронический гепатит.
В ряде случаев бывает затяжное течение ГВ, при котором выраженные клинико-биохимические симптомы сохраняются до 6 мес, при этом увеличивается риск перехода в хроническую форму инфекции.
Самым серьезным осложнением тяжелых форм ГВ является острая печеночная недостаточность (ОПН), острая печеночная энцефалопатия. Клиническая картина ОПН характеризуется развитием психоневрологической симптоматики (энцефалопатия), выраженного геморрагического синдрома, артериальной гипотензии, тахикардии, часто значительным уменьшением размеров печени и появлением «печеночного запаха» изо рта. В зависимости от степени неврологических расстройств выделяют 4 стадии энцефалопатии: прекома I, прекома II, кома и глубокая кома с арефлексией, продолжительность которых различна (от нескольких часов до нескольких дней, при хроническом ГВ — нескольких недель).
В стадии прекомы I отмечаются нарушение сна (сонливость днем и бессонница ночью, тревожный сон с яркими, устрашающего характера «кошмарными» сновидениями, эмоциональная лабильность, эйфория, головокружение, «ощущение провала в пропасть» (тягостное ощущение при закрывании глаз), эмоциональная лабильность, головокружение, замедленное мышление, легкий тремор пальцев рук и век, нарушение координации движения. Как правило, обнаруживаются усиление желтухи и геморрагический синдром — кровоизлияния в кожу, геморрагическая сыпь, носовые кровотечения и др. Важным признаком прекомы служит повторная «немотивированная» рвота.
В стадии прекомы II отмечаются спутанность сознания, нарушение ориентировки во времени и пространстве, психомоторное возбуждение, сменяющееся сонливостью, адинамией, усилением крупноразмашистого тремора кистей рук, появлением тремора языка, «печеночного запаха» изо рта. Характерна тахикардия. Определяются уменьшение размеров печени, мягкая тестоватая консистенция и резкая болезненность при пальпации. Прогрессирует геморрагический синдром (обширные кровоизлияния в кожные покровы, кровотечения, рвота «кофейной гущей»). Возможно повышение температуры тела в связи с развитием некроза печени или присоединением вторичной бактериальной инфекции.
Кома характеризуется бессознательным состоянием с сохранением реакции больного на сильные раздражители, появлением патологических рефлексов, непроизвольных мочеиспускания и дефекации. При остром ГВ нередко печень паль-паторно и перкуторно не определяется (симптом «пустого подреберья»).
При глубокой коме наблюдаются полная утрата сознания и отсутствие рефлексов. Диагностике энцефалопатии способствуют данные электроэнцефалографии (регистрация патологических дельта-волн).
Прогностически неблагоприятными для развития ОПН являются прогрессирующая гипербилирубинемия с увеличением свободной фракции билирубина при тенденции к уменьшению активности АлАТ (билирубиново-ферментная диссоциация), резкое снижение уровня протромбина, проакцелерина и других факторов свертывания в крови, а также нарастающий нейтрофильный лейкоцитоз и тромбоцитопения.
ОПН служит основным проявлением молниеносной формы ГВ, которая характеризуется бурным течением и гибелью больных в течение первых 2—3 нед болезни.
У беременных ГВ может протекать тяжело и нередко осложняется ОПН, особенно в III триместре беременности, что сопровождается перинатальной или интранатальной инфекцией новорожденных, особенно при наличии в крови матери HBsAg и HBeAg. У детей первого года жизни ГВ нередко приобретает тяжелое течение и имеет неблагоприятный прогноз.
Кроме ОПН к специфическим осложнениям ГВ относят массивный геморрагический синдром, отечно-асцитический синдром, обострения и рецидивы болезни.
Неспецифическими осложнениями являются суперинфекция (вирусная, бактериальная, протозойная, грибковая), активация эндогенной инфекции, хронических воспалительных очагов.
Исходом циклических форм ГВ у большинства больных является выздоровление (70—90 % случаев), при этом клиническое выздоровление опережает морфологическое, что требует проведения диспансеризации реконвалесцентов.
Выздоровление может быть полным и с остаточными проявлениями. При ГВ возможны обострения и рецидивы болезни. Постгепатитный синдром представлен астеновегетатив-ным симптомокомплексом, дискомфортом в области печени. У реконвалесцентов нередко наблюдаются дискинезия и воспалительные поражения желчевыводящих путей. В ряде случаев у реконвалесцентов отмечается стойкая гепатомегалия в результате гепатофиброза. Возможна манифестация синдрома Жильбера в связи с ГВ.
Прогноз при остром ГВ в большинстве случаев благоприятный. Летальность составляет около 1 % и обусловлена развитием ОПН, массивных кровотечений, ассоциированных инфекций. У 10—15 % больных ГВ развивается хронический гепатит.
Хронический ГВ — диффузный воспалительной процесс в печени, который диагностируется обычно в случаях сохранения клинико-биохимических проявлений заболевания в течение 6 мес и более. Вместе с тем у ряда больных при первичном обследовании удается выявить специфические для хронического гепатита симптомы, что связано со стертым или безжелтушным течением нераспознанной острой фазы болезни.
Хронический ГВ преимущественно имеет малосимптомное течение и нередко выявляется только по результатам лабораторного исследования (повышение активности АлАТ, маркеры вируса ГВ). Скрытая субклиническая фаза заболевания может продолжаться в течение многих лет. Первые проявления болезни часто соответствуют астеновегетативному синдрому. Больные отмечают общую слабость, повышенную утомляемость, недомогание, периодическое ухудшение самочувствия, нарушение сна, что обусловлено хронической печеночной недостаточностью. Реже возникают диспепсические проблемы — снижение аппетита, ухудшение переносимости жирной пищи, тошнота, дискомфорт в эпигастральной области и правом подреберье. Желтуха и потемнение мочи выявляются редко. Важным признаком хронического ГВ служит увеличение размеров печени, плотная ее консистенция. Реже обнаруживается увеличение селезенки.
При прогрессировании болезни у части больных развиваются внепеченочные знаки: телеангиэктазии (сосудистые «звездочки» на коже), пальмарная эритема (стойкое покраснение кожи ладоней). Геморрагический синдром проявляется кровоизлияниями в кожу, кровоточивостью десен, носовыми кровотечениями и др. Клинические проявления прогрессиро-вания хронического ГВ могут быть обусловлены аутоиммунными механизмами и сопровождаться внепеченочными органными и системными поражениями (васкулит, гломерулонеф-рит, полиартрит, анемия, эндокринные нарушения и др.), соответствовать признакам формирования цирроза печени (портальная гипертензия, отечно-асцитический синдром, гипер-спленизм и др.).
Характер и течение патологического процесса при хроническом ГВ зависят от репликативной активности возбудителя, в связи с чем выделяют хронический ГВ с высокой и низкой репликативной активностью. Сохранение циркуляции в крови HBeAg свидетельствует о продолжающейся активной репликации вируса. В крови больных выявляют HBsAg, НВс IgM, ДНК HBV. При хроническом ГВ с низкой репликативной активностью в крови обнаруживают HBsAg, анти-НВе, НВс IgG. В этих случаях нормальная или близкая к норме активность АлАТ позволяет диагностировать интегративный тип хронического ГВ.
Интегративный хронический ГВ, как правило, имеет доброкачественное течение. Диагноз подтверждается морфологически — выявляются дистрофические процессы в печени, внутридольковые лимфоидные инфильтраты и отсутствие фиброза. Вместе с тем возможно развитие гепатоцеллюлярной карциномы.
Вариантом хронической инфекции может быть «носитель-ство» HBsAg, характеризующееся длительным (более 6 мес) обнаружением в крови HBsAg при отсутствии клинических и биохимических признаков поражения печени. В большинстве случаев морфологическое исследование ткани печени свидетельствует о наличии у «но&гтелей» хронического ГВ с минимальной активностью патологического процесса, субклинической его формы, интегративной фазы инфекции.
Хронический репликативный ГВ чаще протекает с медленным, но неуклонным прогрессированием (непрерывно прогрессирующий вариант) или чередованием клинико-биохимических обострений и ремиссий. Обычно при этом выявляется умеренная или выраженная активность патологического процесса в печеночной ткани. На частоту и выраженность обострений, прогрессирование хронической HBV-инфекции существенное влияние оказывают дополнительные воздействия на организм: сопутствующие заболевания, погрешности в диете, хроническая алкогольная интоксикация, наркомания, суперинфекция другими гепатотропными вирусами (С, D, А и др.).
Обострение хронического ГВ сопровождается интоксикацией (преимущественно астеновегетативными проявлениями), умеренно выраженной желтухой, диспепсическим синдромом, субфебрильной лихорадкой, геморрагическим синдромом, внепеченочными проявлениями.
Лабораторные данные указывают на функциональную не
достаточность печени (умеренное повышение активности АлАТ, уровня билирубина в крови, снижение протромбиново-го индекса, диспротеинемия с уменьшением уровня альбуминов и общего белка, гипохолестеринемия и др.). Мезенхи-мально-воспалительный синдром проявляется значительно выраженной гипергаммаглобулинемией, повышенной тимоловой пробой, незначительным увеличением СОЭ. Нередко выявляется анемия и тромбоцитопения.
Энцефалопатия
.Сосудистые збездочни"
Гинекомастия
Спленомегалия Ясцит
Контрактура Дюпюитрена
Гепатомегалия
Польморная
эритем
о
Дтросрия яичек, Вариноцеле
Дтрофия кожи Геморрагии
Отеки
30—40 % случаев хронического репликативного ГВ заканчивается циррозом печени и(или) гепатоцеллюлярной карциномой.
Цирроз печени длительное время может быть клинически компенсированным и выявляется лишь при морфологическом исследовании. Цирроз характеризуется распространенным фиброзом с узловой перестройкой паренхимы печени, нарушением дольковой структуры и образованием внутрипеченоч-ных анастомозов. По мере прогрессирования (темпы которого могут быть различными) нарастает выраженность астенического, диспепсического, геморрагического синдромов, интоксикации, желтухи. К общим проявлениям декомпенсирован-ной стадии цирроза печени относятся нарастающее похудание, гормональные расстройства, длительный субфебрилитет. Возникают и увеличиваются отечно-асцитический синдром (пастозность и отечность голеней и стоп, асцит), портальная гипертензия (расширение вен на передней брюшной стенке, варикозное расширение вен пищевода, желудка, прямой кишки), гиперспленизм (рис. 8). Из лабораторных данных обращают на себя внимание резко выраженная диспротеинемия, гиперферментемия, гипербилирубинемия, снижение протром-бинового индекса, сулемового титра, повышение тимоловой пробы, уровня циркулирующих иммунных комплексов, анемия, лейкоцитоз, увеличение СОЭ. В крови и(или) ткани печени можно обнаружить маркеры HBV-инфекции.
Неблагоприятный исход заболевания может быть обусловлен развитием ОПН, портальной гипертензией и кровотечением из варикозно расширенных вен пищевода, присоединением бактериальной инфекции (например, флегмоны кишки), формированием гепатокарциномы.
Прогноз при репликативной хроническом ГВ с высокой активностью и циррозе печени обычно серьезный или неблагоприятный. Течение интегративного хронического ГВ преимущественно доброкачественное, но в 10—15 % случаев может развиться репликативная фаза инфекции.
В гиперэндемичных по HBV-инфекции регионах (в Африке и Юго-Восточной Азии) первичный рак печени в виде со-литарного, узлового или диффузного процесса (цирроз-рак печени) составляет около 50 % от всех злокачественных новообразований.
Диагностика. Важное значение в распознавании ГВ имеют данные эпидемиологического анамнеза (указание на медицинские и немедицинские парентеральные вмешательства, контакт с больным в сроки, соответствующие периоду инкубации), результаты клинического и лабораторного обследования (выявление характерной стадийности болезни и клинико-биохимических синдромов), а также результаты специфических методов исследования (схема 3).
С помощью РПГ, РНГА и более чувствительных методов — ВИЭФ, РИА и ИФА — в крови больных обнаруживают маркеры вируса ГВ (табл. 6). Для острого ГВ характерно обнаружение в сыворотке крови в преджелтушном и начальной фазе желтушного периодов HBsAg, HBeAg и анти-НВс IgM. В периоде угасания клинических проявлений и реконвалесценции определяются анти-НВе, анти-HBcIgG, позднее — анти-HBs (рис. 9). Длительное персистирование HBsAg и HBeAg при отсутствии анти-НВе свидетельствует о хронизации инфекции.
Схема 3. Ранняя (в продромальном периоде) диагностика ГВ
Инфекция с поражением пищеварительной системы?
HBsAg
Анти-HBcIgM Анти-HBcIgG
HBeAg
Анти-НВе
Анти-HBs
HBV-ДНК
Наиболее диагностически значимые признаки:
-
Интоксикационный синдром (слабость, артралгии, иногда экзантема, повышение температуры тела)
-
Диспепсический синдром (анорексия, тошнота, рвота, дискомфорт в эпигаст-рии и др.)
-
Гепатосплсномегалия
Генерализованная инфекция с поражением пищеварительной системы?
Решение вопроса о степени вовлечения в процесс гепатобилиарной системы. Дифференциальный диагноз с другими генерализованными инфекциями
4. Холурия, часто ахолия кала
Генерализованная инфекция с нарушением пигментного обмена, гепатит?
Вспомогательные диагностические признаки:
-
Эпидемиологический анамнез, детализированный с учетом парентерального, полового, перинатального путей заражения на протяжении 2—6 мес до настоящего заболевания
-
Наличие, как правило, сопутствующей патологии, требующей проведения лечебно-диагностических манипуляций
-
Микросимптомы болезни: признаки ваготонии, зуд кожи и др.
-
Изменения гемограммы: лейкопения, лимфоцитоз, уменьшение СОЭ
I
Вирусный гепатит В?
I
Решающие диагностические признаки:
-
Биохимические маркеры синдромов цитолиза, мезенхимального воспаления, холестаза
-
Маркеры ВГВ-инфекции: HBsAg, HBeAg, анти-HBcIgM
1
Вирусный гепатит В
В ткани печени методом иммунофлюоресценции или при электронной микроскопии могут быть обнаружены вирионы HBV, HBcAg и другие антигены вируса.
Важнейшим методом обследования больных ГВ является пункционная биопсия печени, позволяющая установить характер и направленность патологического процесса. Диагно-
стическую ценность имеют радиоизотопное сканирование и ультразвуковое исследование печени.
Дифференциальную диагностику в преджелтушном периоде ГВ проводят с различными гастроэнтерологическими забо-
Маркеры в крови
Таблица 6. Диагностическое значение маркеров HBV
Периоды и фазы инфекционного процесса
Острый гепатит — преджелтушный период, желтушный период, при затяжном течении — период ранней реконвалесценции
Хронический гепатит — интегративная и реплика-тивная форма
Острый гепатит — период разгара, высокие титры Хронический гепатит — низкие титры При HBsAg (+) — хронический гепатит При HBsAg (—) — указывает на перенесенный ранее гепатит В Острый гепатит
Хронический гепатит — репликативная фаза Реконвалесценция острого гепатита Хронический гепатит интегративная фаза Поздняя реконвалесценция острого гепатита, про-тективный иммунитет Поствакцинальный иммунитет
Острый гепатит и хронический гепатит — маркер репликации
леваниями, ревматическим и другими полиартритами, аллер гозами, в желтушном периоде — с лептоспирозом, иерсинио зом, псевдотуберкулезом, инфекционным мононуклеозом, сепсисом, гемолитическими и обтурационными желтухами.
Дифференциальная диагностика ГВ с токсическими nopaJ жениями печени (алкогольными и медикаментозными) сложна и основывается на анамнестических данных о контакте с ядом, закономерном наличии признаков нефропатии наряду с признаками функциональной недостаточности печени. Лекарственные поражения печени (ПАСК, ГИНК, этионамид и другие противотуберкулезные препараты, анаболические гормоны, «большие транквилизаторы», тетрациклин и др.) отмечаются при длительном применении, использовании высоких доз лекарственных средств, а также в случаях индивидуальной их непереносимости.
Лечение. Основой лечения ГВ, как и других гепатитов, слу| жит щадящий двигательный и диетический режим, что является достаточным для большинства больных легкими формами болезни.
При средней тяжести ГВ проводят дезинтоксикацию с при-1 менением обильного питья, энтеросорбентов, инфузии растворов глюкозы, Рингера, гемодеза и т. д. Дополнительно используют средства метаболической терапии (аскорбиновую кислоту, витамины группы В, жирорастворимые витамины Е, А), рибоксин. В период реконвалесценции применяют эссен-циале, гепатопротекторы (карсил, легалон, силибор).
Наибольшего внимания требует лечение больных тяжельм ми формами ГВ. В таких случаях увеличивают объем дезин-токсикационных средств (до 3 л в сутки). Наряду с базисной инфузионной терапией принято назначать глюкокортикоиды, обычно преднизолон в дозе 60—120 мг в сутки, ингибиторы протеаз (контрикал), спазмолитики, диуретические средства, антибиотики широкого спектра действия для предупреждения вторичной бактериальной инфекции.
В случаях ГВ с признаками ОПН проводят интенсивную терапию в условиях специализированного отделения. Больные нуждаются в тщательном уходе и постоянном мониторинге основных показателей биохимического гомеостаза. Базисная патогенетическая терапия направлена на замещение нарушенных функций печени и поддержание организма в условиях острой недостаточности печени. Осуществляется массивная дезинтоксикационная терапия путем введения больших объемов инфузионных растворов и форсирования диуреза (метод управляемой гемодилюции). Назначают большие дозы глюко-кортикоидов (240—420 мг преднизолона в сутки), ингибиторы протеаз, растворы альбумина, плазму крови, средства для коррекции нарушений кислотно-основного равновесия и электролитного обмена и др. Применяют патогенетические средства, такие как цитохром С, леводопа, гепастерил и др. Дополнительно используют плазмаферез с частичным плазмооб-меном, гемосорбцию, лимфосорбцию, обменные переливания донорской крови, гипербарическую оксигенацию.
При лечении хронического ГВ получен положительный эффект от применения противовирусных химиопрепаратов (ламивудин, фамцикловир, зидовудин, рибавирин, аденовир и др.) и рекомбинантных препаратов альфа-интерферона (реа-ферон, реальдирон, интрон А, роферон, пегинтрон и др.). Этиотропная терапия применяется также в случаях затяжного течения острого ГВ.
При хроническом ГВ применяют патогенетические средства, как и при остром гепатите, направленные на замещение и коррекцию нарушенных функций печени, объем и качество которых зависят от степени декомпенсации хронического ГВ.
При хроническом ГВ с аутоиммунным компонентом применяют иммуносупрессивную терапию, включающую преднизолон, азатиоприн (имуран), хингамин, по показаниям — их комбинации. Кроме того, используют экстракорпоральную ге-мокоррекцию на фоне базисной патогенетической терапии.
Профилактика включает комплекс мероприятий, направленных на выявление источников инфекции и предупреждение гемоконтактного инфицирования, а также вакцино- и серопрофилактику.
Для предупреждения ятрогенного распространения ГВ проводят раннее выявление больных, контроль за использованием донорской крови и ее препаратов, используют одноразовые инструменты для парентеральных манипуляций и тщательно стерилизуют приборы многоразового использования, применяют перчатки при проведении любых парентеральных манипуляций, в том числе стоматологических, а также при работе с образцами крови.
Для активной иммунизации в первую очередь континген-тов высокого риска заражения (дети от HBsAg-положительных матерей, больные гемофилией, пациенты и персонал центров гемодиализа, медицинские работники, наркоманы и др.) применяют различные типы генно-инженерных вакцин (Engtrix В, Н-В —Vax и др.), которые вводят обычно троекратно (по схеме 0, 1, 6 мес). Протективный эффект сохраняется в течение 5—10 лет. Ревакцинацию проводят через 7 лет. Во многих странах вакцинация охватывает всех детей в рамках календаря прививок.
Для пассивной иммунизации по экстренным показаниям (например, в случаях профессионального заражения) однократно применяют гипериммунный иммуноглобулин против ГВ (HBIG, Антигеп), оказывающий защитное действие при введении его не позднее 48 ч после вероятного заражения, с последующим проведением вакцинации.
Гепатит D
Син. — дельта-инфекция
Гепатит D (ГО, Hepatitis D) — вирусная инфекция человека с гемоконтактным механизмом инфицирования, протекающая исключительно в виде ко- или суперинфекции при ГВ, со склонностью к тяжелому и хроническому течению.
Этиология. Возбудитель TD (HDV) — РНК-содержащий дефектный вирус без оболочки (обнаженный, «голый», по биологическим свойствам приближающийся к вироицам), занимающий промежуточное положение между вирусами растений и животных, не способный к самостоятельной репликации. Для репликации вирус ГО нуждается в вирусе-помощнике, роль которого выполняет вирус ГВ, в частности HBsAg.
Вирус ГО устойчив во внешней среде (к высоким температурам, действию кислот и ультрафиолетового облучения).
Эпидемиология. Эпидемиологическая характеристика ГО близка к ГВ. Источником инфекции являются больные острым и хроническим ГО — как субклиническими, так и манифестными формами. Передача инфекции происходит при гемотрансфузиях, использовании инструментов для парентеральных вмешательств, контаминиро-ванных кровью. В распространении инфекции увеличивается роль парентеральных потребителей наркотических средств. Возможны половой и вертикальный пути передачи ГО, но они встречаются реже, чем при ГВ.
К ГО восприимчивы все лица, инфицированные вирусом ГВ,— больные и носители HBsAg. Зоны гиперэндемичности ГО и ГВ в основном совпадают. Особенно неблагополучны Южная Америка и Экваториальная Африка, где в некоторых районах инфекция получила эндемическое распространение. Высокая заболеваемость регистрируется также в Юго-Восточной Азии, в странах Средиземноморья. ГО встречается во многих странах Европы.
Патогенез и патологоаиатомическая картина. Особенностью вируса ГО является зависимость от вспомогательного вируса, т. е. его проникновение в гепатоциты и репликация возможны только в присутствии HBsAg.
Заражение может произойти одновременно двумя вирусами с развитием коинфекции, но чаще встречается суперинфекция — внедрение вируса ГО в ранее инфицированные вирусом ГВ гепатоциты. При проникновении в организм вирус ГО заносится током крови в печень, являющуюся единственным местом его репликации. Вирус обладает прямым цитопатиче-ским действием. При коинфекции репликация вируса ГО оказывает подавляющее действие на репродукцию вируса ГВ, способствует иммунному клиренсу инфицированных гепатоцитов, что может завершиться выздоровлением. Подавление репликации вируса ГВ может быть временным. В случаях суперинфекции вирус ГО определяет прогрессирующее течение инфекции с развитием фульминантного гепатита или цирроза печени. В патогенезе ГО имеют значение иммунные механизмы повреждения гепатоцитов, возможно развитие аутоиммунных реакций.
Морфологические изменения ткани печени сходны при ГО и ГВ. Для хронического ГО характерно раннее развитие цирроза печени.
Клиническая картина. Острый ГО чаще развивается при одновременном инфицировании вирусами В и D.
Инкубационный период составляет 20—40 дней. Преджелтушный период сопровождается лихорадкой, болями в суставах. Клинические проявления разгара заболевания сходны с ГВ. Однако с появлением желтухи самочувствие обычно не улучшается, нарастает интоксикация, нередко сохраняется субфебрильная температура тела. Нередко через 2—3 нед от начала заболевания возникает клинико-биохимическое обострение. ГО чаще протекает в среднетяжелой форме и завершается выздоровлением.
При суперинфицировании вирусом ГО больного хронической формой ГВ или носителя HBsAg острый гепатит D развивается редко, но проявляется в тяжелой или фульминант-ной форме. В этих случаях отмечаются яркая желтуха, быстро нарастающая интоксикация, энцефалопатия, геморрагический синдром, увеличение размеров печени и селезенки. Характерно волнообразное течение. У большинства больных суперинфицирование вирусом ГО приводит к развитию хронического гепатита.
Возможно различное течение заболевания от субклинических до манифестных, быстропрогрессирующих форм с развитием цирроза печени. При субклинических формах диагноз устанавливается по наличию в крови маркеров HDV. Манифестные формы проявляются типичными признаками хронического гепатита и цирроза печени. Течение заболевания волнообразное с частыми обострениями.
Диагностика. Диагноз основан на клинико-лабораторных данных, подтверждающих наличие гепатита. Для верификации диагноза используют определение анти-HDV методом ИФА и РНК HDV методом ПЦР. При остром ГО в крови обнаруживают анти-HDV IgM, после сероконверсии анти-HDV IgG персистируют в течение нескольких месяцев с постепенным снижением их титра в крови. При хронической инфекции HDV сохраняется в ткани печени и анти-HDV IgM определяются в высоком титре в крови весь период репликации вируса.
Лечение и профилактику П> проводят как при изолированных формах ГВ. Специфическая профилактика не разработана.
192
Шувалова
193
Гепатит С
Син. — гепатит ни А ни В с парентеральным механизмом заражения, посттрансфузионный гепатит ни А ни В, гепатит наркоманов
Гепатит С (ГС, Hepatitis С) — вирусное заболевание человека с гемоконтактным механизмом заражения, склонностью к хроническому длительному малосимптомному течению с исходом в цирроз печени.
Этиология. Возбудитель ГС (HCV) — РНК-содержащий вирус, геном которого кодирует структурные (core — сердцевинный и 2 глико-протеина оболочки El, E2/NS1) и неструктурные (NS2, NS3, NS4, NS5) белки. Вирус генетически неоднороден, нестоек во внешней среде.
Эпидемиология. Источником возбудителя ГС является человек, больной острой или хронической инфекцией. Наиболее опасны в эпидемиологическом отношении субклинические формы заболевания, преобладающие при гепатите С.
ГС имеет гемоконтактный (парентеральный) механизм передачи инфекции. Одним из важнейших путей инфицирования остается переливание крови и(или) ее компонентов. Факторами перщачи HCV могут быть различные медицинские и немедицинские инструменты и препараты, контаминированные крошю. Для заражения имеют значение множественные лечебно-диагностические манипуляции, реже — единичные парентеральные вмешательства. Инфицирующая доза HCV в несколько раз больше, чем HBV. Это объясняет меньшее значение полового и вертикального (от матери к ребенку) пути заражения, а также меньший риск инфицирования при бытовых контактах и профессионального заражения медицинских работников.
Пути передачи инфекции сформировали группы эндемического распространения ГС. К ним относят реципиентов крови и ее препаратов — гематологических больных, например гемофилией, пациентов центров хронического гемодиализа, трансплантации органов и тканей и др. Группой высокого риска инфицирования, представляющей большую эпидемиологическую опасность, являются парентеральные потребители наркотиков, что позволило определить гепатит С как «гепатит наркоманов».
ГС встречается повсеместно, причем в последние годы его распространение связано с «пандемией» наркомании. В мире HCV инфицировано 500 млн. человек, т. е. 10 % популяции. Известно 11 генотипов вируса, распределение которых в разных регионах мира неравномерно. Генотипы 1а, 1в, 2а, 2в, 2с и За составляет более 90 % вирусов, выделенных в Северной и Южной Америке, Европе, России, Китае, Японии и Австралии. Генотипы 4, 5а и 6 выявляется в Центральной и Южной Африке, Юго-Восточной Азии.
Патогенез и патологоанатомическая картина. Важную роль в патогенезе ГС играют биологические свойства возбудителя. Развитие инфекции связано с проникновением и репликацией вируса в гепатоцитах, при этом доказано его прямое цитопатическое действие. Вместе с тем это не приводит (как при ГА) к элиминации возбудителя из организма, так как HCV обладает слабой иммуногенностью. Гуморальный иммунный ответ при ГС выражен слабее, чем при ГВ, вследствие меньшего антителообразования. Образующиеся антитела не способны эффективно нейтрализовать вирусы. Склонность с спонтанному выздоровлению при этом заболевании не велика. У большинства (80 %) больных формируется хронический гепатит с длительным персистированием вируса в организме. Известно, что HCV не имеет интегративных форм, так как в его жизненном цикле нет ни матричной, ни промежуточной ДНК. В связи с этим персистенция вируса в организме имеет иные механизмы.
В хронизации инфекции имеет значение изменчивость вируса с образованием множества одновременно существующих, иммунологически различающихся антигенных вариантов — квазиразновидностей, которые обладают значительными возможностями адаптации и избегают иммунного надзора. При этом скорость мутаций существенно превышает скорость репликации вируса, что и определяет многолетнее персистирова-ние вируса в организме. Образующиеся вируснейтрализующие антитела высокоспецифичны и не способны нейтрализовать вновь появляющиеся вирусные варианты, что не только создает условия для «иммунного ускользания» и сохранения вируса в организме, но и не исключает вероятность повторного инфицирования. HCV способен подавлять клеточное звено иммунитета, вызывая «Т-клеточную анергию», что также способствует хронизации инфекционного процесса.
Длительное сохранение вируса в организме связано также с возможностью его репликации вне печени: в клетках костного мозга, селезенки, лимфатических узлов, периферической крови. HCV может вызывать индукцию аутоантител, что приводит к включению аутоиммунных механизмов прогрессирова-ния заболевания.
Отличительной чертой ГС является продолжительное тор-пидное латентное или малосимптомное течение заболевания и вместе с тем неуклонное прогрессирование патологического процесса. На течение и исходы ГС, в частности темпы развития декомпенсированного цирроза печени и гепатокарцино-мы, существенное влияние оказывают реинфекция (повторное заражение) и суперинфекция другими гепатотропными вирусами, а также факторы, определяющие реактивность макроорганизма (алкоголизм, наркомания, сопутствующая патология и др.). Обсуждается роль иммуногенетических характеристик в формировании инфекционного процесса при ГС. Генетические факторы пациента (HLA класса 1) могут способствовать низкому иммунному ответу на вирус.
Пато'морфогенез ГС представлен различными фазами изменения печеночной ткани. Хронический ГС чаще описывают как гепатит с минимальной или слабо выраженной активностью патологического процесса и слабым или умеренно выраженным фиброзом. ГС имеет морфологические проявления, типичные для хронического гепатита. К характерным особенностям ГС относят наличие лимфоидных фолликулов в пери-портальной соединительной ткани, изменения желчных капилляров и жировую дистрофию гепатоцитов. Для ГС установлены более быстрые темпы процесса фиброзирования печеночной ткани — выраженная циррозогенность возбудителя. При этом нередко отсутствует корреляция между клинико-ла-бораторными показателями и патоморфологическими характеристиками, что значительно повышает диагностическое значение прижизненного морфологического исследования ткани печени методом пункционной биопсии.
Клиническая картина. Продолжительность инкубационного периода составляет от 2 до 26 нед, чаще — 6—8 нед.
Выделяют острую форму (или фазу) заболевания, продолжительностью до 6 мес, и хроническую, которая может быть разделена на субклиническую (латентную) фазу и фазу манифестации (реактивации).
Острый ГС у подавляющего большинства больных протекает субклинически и остается нераспознанным. Диагноз в этих случаях устанавливают на основании результатов лабораторного обследования: выявляют повышение активности АлАТ, анти-HCV и(или) РНК вируса. Сероконверсия происходит через 6—8 нед после заражения.
Манифестные формы преимущественно легкие и средней тяжести, обычно малосимптомны, чаще протекают без желтухи. Продромальный период напоминает преджелтушный период ГВ, сопровождается астеновегетативным, диспепсическим, артралгическим синдромами, реже — лихорадкой. В период разгара больные отмечают общую слабость, недомогание, быструю утомляемость, вялость, снижение аппетита. Возможны дискомфорт и ощущение тяжести в эпигастраль-ной области и правом подреберье. В редких случаях отмечается умеренно или слабо выраженная желтуха кожных покровов и склер. Печень умеренно увеличена. Острый ГС преимущественно протекает нетяжело, но у 80—85 % больных не завершается выздоровлением, а переходит в хроническую фазу инфекции.
Хронический ГС отличается длительным субклиническим или малосимптомным течением, что существенно затрудняет его диагностику. При этом сохраняется вирусемия с небольшой вирусной нагрузкой, иммунитет недостаточен для элиминации возбудителя.
В эту фазу инфекции самочувствие больных обычно не нарушается, они считают себя здоровыми. Тщательное обследование больных позволяет выявить незначительное увеличение размеров и уплотнение печени. Периодически отмечается «волнообразное» умеренное повышение активности АлАТ (в 3—5 раз по сравнению с нормой). В крови закономерно обнаруживают анти-HCV, РНК HCV выявляют непостоянно, обычно в низких концентрациях. Продолжительность этой фазы заболевания составляет 15—20 лет, но может значительно сокращаться при развитии суперинфекции и под влиянием различных факторов, изменяющих реактивность организма (например, алкоголизм, наркомания, сопутствующие заболевания). Минимальные клинические проявления не исключают обнаружения при морфологическом исследовании ткани печени умеренной и высокой активности патологического процесса.
Фаза реактивации (манифестации) хронического ГС характеризуется последовательным возникновением признаков хронического гепатита, цирроза печени и гепатокарциномы. Клинические проявления хронического ГС представлены признаками печеночной недостаточности. Больные астенизированы, жалуются на утомляемость, снижение трудоспособности, прогрессируют общая слабость, нарушение сна, снижение аппетита. Возможны разнообразные диспепсические жалобы, уменьшение массы тела. Закономерно выявляется увеличение размеров печени, нередко в сочетании со спленомегалией. Сравнительно редко возникает желтуха. В клинической картине хронического ГС важное место занимают внепеченочные проявления (васкулиты, гломерулонефрит, криоглобулинемия, тиреоидит, нейромышечные нарушения, суставной синдром, апластическая анемия и др.). Манифестация хронического ГС сопровождается повышением активности АлАТ, увеличением уровня вирусемии. Характерны диспротеинемия, повышение активности гаммаглутамилтранспептидазы.
У 20—40 % больных хроническим ГС происходит формирование цирроза печени, причем в течение длительного времени цирроз остается компенсированным и, как правило, нераспознанным. Эволюция хронического ГС в цирроз существенно быстрее происходит у лиц старше 50 лет. Типичные клинические признаки цирроза печени могут проявиться через годы после его возникновения.
Риск развития рака печени при ГС в три раза выше, чем при ГВ. У 30—40 % больных с циррозом печени формируется гепатокарцинома.
Диагностика. Диагноз основан на клинико-эпидемиологи-ческих данных, показателях функционального состояния печени и результатах выявления маркеров инфицирования вирусом ГС. Для диагностики ГС имеет значение обнаружение в крови анти-HCV методом ИФА, референс-тест проводят методом иммуноблота (RIBA), наиболее информативным является определение РНК HCV методом ПЦР.
Обнаружение в крови анти-HCV в основном имеет значение для установления этиологического диагноза, но не свидетельствует о продолжающейся репликации вируса и не характеризует активность инфекционного процесса. Выявление антител к неструктурным белкам вируса (анти-HCV NS4) указывает на хроническую инфекцию.
Индикация методом ПЦР РНК HCV в крови (ткани печени, костном мозге, периферических клетках крови) свидетельствует о продолжающейся репликации вируса, ее количественный показатель имеет значение в определении прогноза заболевания и оценке эффективности терапии.
Для диагностики хронического ГС обязательно использование результатов прижизненного морфологического исследования ткани печени с оценкой активности патологического процесса (минимальная, низкая, умеренная, выраженная) и степени фиброзирования.
Лечение и профилактика. При манифестных формах острого и хронического ГС в лечении используют основные методы базисной патогенетической и симптоматической терапии, как при ГВ.
В лечении больных ГС доминирующее положение занимают препараты альфа-интерферонов (реаферон, реальдирон, интрон А, роферон-А, пегилированные препараты и др.). При хроническом ГС с повышением активности АлАТ и наличием РНК HCV в крови курс интерферонотерапии составляет от 6 до 12 мес. При сохранении РНК HCV через 3 мес от начала лечения или при рецидиве болезни после завершения курса лечения назначают комбинированную терапию: препараты интерферона и рибаверин (ребетол).
Профилактические мероприятия в отношении путей и факторов передачи вируса ГС проводятся так же, как при ГВ. Специфическая профилактика ГС не разработана.
ЛЕПТОСПИРОЗ
Син.: болезнь Васильева—Вейля, водная лихорадка
Лептоспироз (Leptospirosis) — острая зоонозная инфекция, характеризующаяся явлениями интоксикации с резко выраженными миалгиями, преимущественным поражением почек, печени, нервной и сосудистой систем, сопровождающаяся развитием геморрагического синдрома и нередко желтухи.
Исторические сведения. Впервые клиническая картина инфекционной желтухи была описана в 1886 г. немецким ученым А. Вейлем на основании анализа 4 случаев болезни. В 1888 г. ученик С. П. Боткина Н. П. Васильев опубликовал сообщение о 17 случаях этого заболевания, которые он наблюдал с 1883 г. Представленное им подробное клиническое описание болезни позволило четко отграничить ее от так называемых катаральных желтух (болезнь Боткина) и тем самым выделить как самостоятельную нозологическую форму. Инфекционную желтуху стали называть болезнью Васильева—Вейля. Поиски возбудителя заболевания увенчались успехом в 1914— 1915 гг., когда японские исследователи А. Инадо и соавт. выделили от больных лептоспиру L. icterohaemorrhagiae и отнесли ее к спирохетам. В последующие годы во многих странах мира был выявлен лептоспироз и изучены его возбудители — различные типы лепто-спир.
Этиология. Возбудители лептоспироза относятся к семейству Leptospiraceae, выделенному из Spirochaetaceae, роду Leptospira, который подразделяется на два вида: паразитический Interrogans и сапро-фитический Biflexa.
Морфологически лептоспиры характеризуются наличием многочисленных (15—20) мелких завитков (от лат. leptos — мелкий, spina — завиток). Длина лептоспир 6—15 мкм, толщина —0,25 мкм. Лептоспиры подвижны и способны к поступательному, вращательному и сгибательному движению. Микроорганизмы грамотрицательны, по Романовскому — Гимзе окрашиваются в розовый цвет, при серебрении — в коричневый. Культивируются в анаэробных условиях на искусственных средах с добавлением кроличьей сыворотки при температуре 25—35 "С и рН 7,2—7,4. Рост лептоспир происходит медленно, их можно обнаружить лишь после 8—10-го дня культивирования.
Лептоспиры обладают гемолитической активностью, что имеет важное значение в патогенезе заболевания, как и другой фактор па-тогенности — адгезивность в отношении эритроцитов и, что особенно существенно, эндотелиальных клеток капилляров. При разрушении микроорганизмов выделяется эндотоксин, который, как и собственно лептоспиры, имеет основной точкой приложения эндотелий капиллярной сети.
В зависимости от антигенной структуры лептоспиры подразделяют на серологические группы (23) и варианты (более 200). Антигенные различия сероваров выявляются в серологических тестах (РМА и др.). Основное значение в патологии человека в России имеют се-рогруппы: L. grippothyphosa, L. pomona, L. tarassovi, L. hebdomadis, L. icterohaemonhagica, L canicola.
Лептоспиры являются гидробионтами, и этим во многом обусловлены эпидемиологические особенности вызванного ими заболевания. Они длительно выживают в пресной воде, что обеспечивает продолжительное сохранение микроорганизмов в природных условиях. Возбудители устойчивы к действию низких температур, не утрачивают активность после замораживания. В естественных водоемах они могут оставаться жизнеспособными 2—3 нед, в почве — до 3 мес, на пищевых продуктах — несколько дней. Лептоспиры чувствительны к действию ультрафиолетового облучения, кислот, щелочей, дезинфицирующих веществ, нагреванию. Из лабораторных животных к лептоспирам восприимчивы морские свинки, кролики, золотистые хомячки и др., погибающие на 5—6-й день после заражения обычно при наличии желтухи и кровотечений.
Эпидемиология. Источниками лептоспирозной инфекции человека являются больные и переболевшие дикие и домашние животные, заражающие воду и почву, что приводит к образованию природных, антропоургических (хозяйственных) и смешанных очагов инфекции.
Природные очаги лептоспироза обусловлены наличием инфекции среди диких животных. Они расположены преимущественно в лесной, лесостепной и лесотундровой зонах. Природные очаги могут быть обнаружены в приозерных котловинах, зарослях тростника, заболоченных травяных участках лесов, на сырых вырубках. Основными носителями лептоспир в природных очагах являются мелкие влаголюбивые грызуны и насекомоядные: полевки, полевые мыши, серые крысы, землеройки, ежи. Животные переносят хронические формы инфекции с длительной лептоспирурией, приводящей к интенсивному инфицированию окружающей среды.
Антропоургические очаги могут возникать как в сельской местности, так и в городах. В связи с непрерывным ростом поголовья сельскохозяйственных животных они играют важную роль в распространении инфекции. В антропоургических очагах инфекции ее резервуаром служат свиньи, крупный и мелкий рогатый скот и др., а также промысловые животные при клеточном их содержании. У инфицированных животных лептоспиры длительное время сохраняются в извитых канальцах почек и выделяются с мочой в течение нескольких месяцев, что поддерживает циркуляцию возбудителя в очаге. Особенно большое эпидемиологическое значение имеют антропоургические очаги, возникающие в животноводческих хозяйствах и на производствах по убою и первичной обработке животного сырья.
В городских антропоургических очагах основными источниками инфекции для человека служат черная и серая крысы. В настоящее время существенное значение в распространении лептоспироза приобрели домашние и бездомные собаки. Установлено, что инфициро-ванность домашних собак лептоспирами служит объективным интегральным показателем санитарно-эпидемиологического неблагополучия мегаполиса.
Больной человек не является источником инфекции. Лептоспироз имеет множественные механизмы заражения, при этом основное значение имеют алиментарный путь и контактный механизм передачи инфекции. Входными воротами инфекции служат поврежденные и неповрежденные кожные покровы, слизистые оболочки (преимущественно желудочно-кишечного тракта). Заражение лептоспирозом происходит при употреблении воды из открытых естественных и искусственных водоемов, пищевых продуктов, загрязненных инфицированной мочой животных. Возможно заражение через контаминированные возбудителем предметы быта и производства. Лептоспиры могут внедряться через кожные покровы при купании в непроточных водоемах и хождении по влажной почве босиком. Заражение может произойти при непосредственном контакте с больными животными (при уходе за животными, укусе и т. п.).
Чаще лептоспирозом болеют лица, работающие на заболоченных лугах, в рисоводческих и животноводческих хозяйствах, на мясокомбинатах. Возможно заражение лептоспирозом работников коммунального хозяйства, собачьих питомников, дератизаторов, владельцев собак.
В природных очагах заболеваемость регистрируется в виде спорадических случаев или групповых вспышек преимущественно в летний и осенний сезоны, однако спорадические заболевания этой инфекцией, как и заболеваемость в антропоургических очагах, регистрируются круглый год. К инфекции восприимчивы люди любого возраста, но чаще болеют подростки и взрослые. Перенесенное заболевание вызывает гомологичный иммунитет, стойкий, не препятствующий, однако, заражению другими сероварами лептоспир.
Патогенез и патологоаиатомическая картина. Лептоспироз—острая циклически протекающая генерализованная инфекция. В ее развитии выделяют 5 последовательно сменяющихся фаз.
Первая фаза (1—2-я неделя после заражения) — внедрение и размножение лептоспир. Из области входных ворот (кожа, слизистые оболочки), не вызывая воспаления в месте внедрения, лептоспиры с током крови разносятся во внутренние органы (преимущественно в печень, почки, селезенку, легкие), где в результате адгезии возбудителя к поверхности клеток происходит их накопление в межуточном пространстве (размножение возбудителей), лептоспиры проникают через ге-матолимфатический барьер. Развивается генерализованная гиперплазия лимфатических узлов. Эта фаза патогенеза соответствует инкубационному периоду.
Вторая фаза (1 —2-я неделя болезни) — вторичная леп-тоспиремия и генерализация инфекции. Эта фаза характеризуется массивным поступлением лептоспир в кров ь, под действием ее бактерицидных свойств часть возбудителей погибает с выделением эндотоксинов. Важным фактором патогенеза становится накопление эндотоксинов и токсичных метаболитов возбудителя в крови, а также проникновение лептоспир в межклеточные пространства органов и тканей, особенно в печень, почки, нервную систему (генерализация инфекции). В этот период возможно проникновение лептоспир через ге-матоэнцефалический барьер и развитие менингита. Клинически эта фаза соответствует начальному периоду болезни.
Третья фаза (3-я неделя болезни) — развитие максимальной степени токсинемии, панкапилляротоксикоза и органных нарушений, что соответствует периоду разгара заболевания. В результате повреждения эндотелия капилляров развивается панкапилляротоксикоз, который приводит к повышению проницаемости сосудистой стенки и нарушениям микроциркуляции, что сопровождается возникновением геморрагического синдрома и служит дополнительным механизмом инициации и прогрессирования органных поражений. Под действием лептоспир и токси чных продуктов их метаболизма и распада возникают дегенеративные и некротические изменения в печени, почках, мышцах и т. д. с нарушением функции органов, появлением желтухи, признаков почечной недостаточности ренального типа. Почки — закономерное место адгезии микроорганизмов. Лептоспиры накапливаются в интерстиции и колонизируют эндотелий проксимальных извитых канальцев — прилипают к базальным мембранам неф
ротелия
канальцев и капиллярных петель клубочков.
В экспериментах показано, что все
штаммы патогенных лептоспир оказывают
выраженное деструктивное действие на
культуры клеток почек животных, причем
без проникновения микроорганизмов
внутрь клеток, что позволяет судить о
повреждающей роли токсичных веществ,
продуцируемых лептоспирами. Нельзя
исключить одновременного нарушения
микроциркуляции под действием
токсических факторов, что способствует
некробиозу нефротелиоцитов.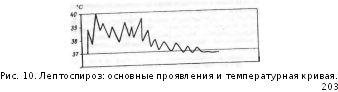
Характерно развитие гемолиза как следствия накопления в крови гемолизинов лептоспир. В этой фазе развития заболевания возникают условия для тяжелых, возможно смертельных, осложнений. К ним относят ИТШ, острую почечную и почеч-но-печеночную недостаточность, массивные кровотечения, респираторный дистресс-синдром, гемолитическую анемию, миокардит и др.
Четвертая фаза (3—4-я неделя болезни) — при благоприятном течении болезни, в ходе которой формируется нестерильный иммунитет, нарастают титры различных антител (агглютининов, опсонинов, комплементсвязывающих и др.), активизируется фагоцитоз лептоспир звездчатыми эндотелио-цитами в печени, моноцитами, полиморфно-ядерными клетками и др., однако лептоспиры еще могут длительно сохраняться в межклеточных пространствах, особенно в почках (до 40-го дня болезни). Наряду с этим наблюдается обратное развитие органных и функциональных расстройств. Эта фаза соответствует периоду угасания клинических проявлений.
Пятая фаза (5—6-я неделя болезни) — формируется стерильный иммунитет к гомологичному серовару лептоспир, происходит восстановление нарушенных функций, наступает выздоровление.
У больных, умерших от лептоспироза, на фоне значительного нарушения кровообращения с преимущественным поражением сосудов микроциркуляторного русла, обнаруживаются признаки распространенного геморрагического синдрома (обширные кровоизлияния в органы и ткани), увеличение печени, признаки внутрипеченочного холестаза. Характерны жировая и белковая дистрофия гепатоцитов, накопление в них желчных пигментов, некроз отдельных печеночных клеток. Выявляется увеличение селезенки и лимфатических узлов, в которых отмечаются гиперплазия лимфоидных элементов, увеличение количества плазматических и полиморфно-ядерных клеток, признаки эритрофагии. Наиболее значительные изменения наблюдаются в почках — увеличение, кровоизлияния в корковом и мозговом слое. Характерны дистрофия и некроз эпителия извитых канальцев, клубочки поражаются в меньшей степени. В просвете канальцев часто обнаруживают лептоспиры. Нередко определяют отек вещества и оболочек головного мозга, очаговые кровоизлияния в мозг. У ряда больных отмечаются признаки миокардита, дистрофические изменения в скелетных мышцах (икроножных, поясничных и др.).
Клиническая картина. Инкубационный период колеблется от 3 до 30 дней и составляет в среднем 6—14 дней. Спектр клинических проявлений лептоспироза очень широк (рис. 10). Различают желтушные и безжелтушные формы лептоспироза, протекающие в легкой, средней тяжести и тяжелой формах.
В течении болезни выделяют следующие периоды: начальный (лихорадочный), разгар (органных повреждений), рекон-валесценции, — соответствующие фазам патогенеза.
Цереброспинальная жидкость:
лимфоцитарный
плеоцитрз
Печеночные
пробы ■ ШТ, AcftT n/S билирубин \ протромбин н/\
Азотемия
Гемограмма-нейтрофильный лейкоцитоз анемия
тромбоци топенип\ увеличение СОЭ

менингеальный синдром
Инъекция сосудов склер и гиперемия юнъюнктиб
Герпетическая сыпь
Желтушность кожи Петехии
Пневмония
Гепотосллено-мегалия болезненность В области почек
Гене! лим*
ерализоВанный (раденит
Миапгии
Анализ мочи: протеинурия гематурия цилинорурия
Олигурия
Начальный период продолжительностью около 1 нед (укора^ чивается при тяжелом течении болезни) проявляется интоксикационным синдромом и признаками генерализации инфекции. Характерно острое, часто внезапное начало болезни. Наблюдаются озноб, быстрое повышение температуры тела до 39—40 "С, сильная головная боль, головокружение и резкая общая слабость, могут быть боли в поясничной области, тошнота и рвота. Частым и диагностически важным симптомом являются интенсивные боли в разных группах мышц, особенно в икроножных мышцах. Боли в ногах могут быть настолько сильными, что не позволяют больным передвигаться. Пальпация мышц болезненна. У некоторых больных отмечается болезненность при пальпации мышц брюшной стенки, что симулирует признаки острой хирургической патологии органов брюшной полости. Лихорадка сохраняется в течение 5—8 дней, имеет постоянный или ремиттирующий характер и снижается критически или по типу ускоренного лизиса.
В этот период болезни больные обычно возбуждены, беспокойны. Характерны одутловатость и гиперемия лица и иногда шеи, расширение сосудов склер и конъюнктивы (рис. 11; см. цв. вклейку), часто появляются герпетические высыпания на губах и крыльях носа с геморрагическим пропитыванием. С 3—6-го дня болезни на коже туловища и конечностей возникает полиморфная, быстро исчезающая сыпь (кореподобная, точечная, розеолезная, уртикарная и др.). При тяжелом течении заболевания уже в начальном периоде могут быть обнаружены геморрагии на склерах и конъюнктиве, петехиаль-ные элементы на коже в подмышечных и паховых областях, в локтевых сгибах. Нередко отмечаются носовые кровотечения.
Характерны тахикардия, понижение артериального давления, глухость сердечных тонов. Дыхание учащено соответственно уровню температуры тела. При тяжелом течении леп-тоспироза могут наблюдаться признаки дыхательной недостаточности, в дальнейшем появляется кровянистая мокрота. Нередко отмечаются признаки бронхита.
Язык со 2—3-го дня болезни становится сухим, покрывает-.ся бурым налетом. Пальпация живота может быть чувствительной, определяются увеличенная и слегка болезненная печень, у '/з больных — увеличенная селезенка. Часто выявляется микрополилимфаденит.
У большей части больных уже в этот период болезни наблюдаются признаки поражения почек: положительный симптом Пастернацкого, уменьшение мочеотделения, в моче — белок, лейкоциты, эритроциты, гиалиновые цилиндры, реже — зернистые; в крови — незначительное увеличение содержания азотистых метаболитов.
Нередко (у 10—20 % больных) развивается менингеальный, симптомокомплекс: усиление головной боли, головокружение, тошнота и рвота, положительные симптомы Кернига, Брудзинского и др. При исследовании спинномозговой жидкости выявляются увеличение содержания белка, лимфоци-тарный или лимфоцитарно-нейтрофильный умеренно выраженный плеоцитоз, обнаруживаться лептоспиры.
Гемограмма в этот период характеризуется нейтрофильным лейкоцитозом со сдвигом формулы влево и значительным увеличением СОЭ (до 40—60 мм/ч и более).
В конце 1-й —начале 2-й недели болезни (период разгара) температурная реакция и общетоксические проявления начинают уменьшаться, вместе с тем состояние больного не улучшается, становятся более выраженными и прогрессируют органные расстройства. У ряда больных, обычно при тяжелой форме болезни, развиваются недостаточность функции печени, почек и геморрагический синдром.
Желтуха, появляющаяся у части больных уже в течение 1-й недели болезни, в период разгара заболевания быстро прогрессирует, приобретает яркий, шафрановый оттенок, часто сопровождается кровоизлияниями в слизистые оболочки и кожу (рис. 12; см. цв. вклейку). Геморрагии могут возникать и при безжелтушной форме лептоспироза. По мере нарастания желтухи еще более увеличиваются печень и селезенка, которые при пальпации часто становятся болезненными; многие больные отмечают зуд кожи.
При биохимических исследованиях выявляются гиперби-лирубинемия (с повышением уровня как связанного, так и свободного билирубина), нормальная или умеренно повышенная активность АлАТ и АсАТ (значения этих показателей обычно меньше, чем при вирусном гепатите), повышение активности щелочной фосфатазы, 5-НУК. Белково-осадочные пробы обычно не изменяются.
Поражение почек — наиболее характерное проявление периода разгара лептоспироза. У больных отмечается более значительное, чем в начальном периоде, уменьшение диуреза вплоть до анурии при тяжелом течении болезни. Нарастает протеинурия (2—30 г/л), в осадке мочи выявляются в большом количестве лейкоциты, эритроциты, клетки почечного эпителия, зернистые и восковвдные цилиндры. Характерны значительное нарастание уровня мочевины, остаточного азота и креатинина в сыворотке крови, гиперкалиемия, ацидотиче-ские сдвиги кислотно-основного состояния. Из мочи могут быть выделены возбудители.
Прогрессирующая почечная и часто почечно-печеночная недостаточность — одна из основных причин смерти больных от лептоспироза.
Закономерно выявляются признаки поражения сердечнососудистой системы: частый и иногда аритмичный слабого наполнения пульс, пониженное артериальное давление (даже на фоне почечной недостаточности гипертензионный синдром наблюдается редко), глухие тоны сердца; на ЭКГ отмечаются признаки дистрофии миокарда и нарушения проводимости. В тяжелых случаях выявляется острый миокардит (ин-фекционно-токсический).
Усиливается или впервые появляется менингеальный синдром как проявление лептоспирозного менингита.
Наряду с симптомами поражения внутренних органов усиливаются проявления геморрагического синдрома как в виде кровоизлияний в кожу и слизистые оболочки, так и в виде желудочных, кишечных и маточных кровотечений. У части больных выявляется кровохарканье, прогрессируют признаки дыхательной недостаточности в результате кровоизлияний в легкие. Нередко возникают кровоизлияния в мышцы, особенно поясничные, мышцы брюшной стенки, симулирующие картину «острого живота», кровоизлияния в надпочечники. Характерно усиление признаков анемии.
Гемограмма в этот период характеризуется заметным уменьшением числа эритроцитов, ретикулоцитов и тромбоцитов, снижением уровня гемоглобина, умеренно выраженным нейтрофильным лейкоцитозом (обычно менее 20,0 х 109/л) со сдвигом формулы влево, лимфопенией, анэозинофилией и значительным повышением СОЭ.
На фоне своевременной и адекватной терапии при благоприятном течении болезни с 3-й недели заболевания признаки органных расстройств начинают регрессировать (период реконвалесценции). Уменьшается интенсивность желтухи, олигоанурия сменяется полиурией, уменьшаются показатели азотемии и восстанавливаются показатели кислотно-основного и электролитного обмена, улучшается самочувствие больных. Однако в этом периоде болезни также возможно развитие осложнений, проявляющихся поражением глаз (ирит, уве-ит, иридоциклит, помутнение стекловидного тела), гемолитической анемией, миокардитом и др. и сохраняющихся в течение последующих нескольких недель. Могут наблюдаться признаки ассоциированной инфекции — пневмония, отиты, стоматиты, абсцессы на месте пролежней и др.
У части больных (около '/3 случаев) возникают рецидивы болезни (от одного до двух-трех, редко более), протекающие с менее значительными клиническими признаками токсических и органных поражений. В случае возникновения рецидивов болезни бывает повторное, обычно менее значительное повышение температуры тела в течение 3—6 дней. В связи с повторными рецидивами лихорадка становится волнообразной.
Продолжительность болезни в среднем составляет 3—4 нед, при наличии рецидивов может удлиняться до 2—3 мес.
Могут наблюдаться случаи болезни со слабо выраженными проявлениями заболевания, без существенного нарушения функции почек и печени.
Прогноз. При адекватной терапии благоприятный, летальные исходы составляют 1—3 %, однако известны эпидемические вспышки с высокой летальностью (до 20—30 % и более).
Диагностика. Распознавание лептоспироза основано на тщательном анализе данных эпидемиологического анамнеза, правильной оценке результатов клинико-лабораторного обследования (циклическое течение болезни с признаками генерализации инфекции, выявление нарушений печеночно-по-чечных функций, нейтрофильный лейкоцитоз и раннее значительное повышение СОЭ и др.) (схема 4).
Специфическая диагностика включает различные методы обнаружения лептоспир и серологические тесты.
В начальный период заболевания лептоспиры могут быть обнаружены в крови и цереброспинальной жидкости, в разгар болезни также в моче.
К ориентировочным методам ранней диагностики относится бактериоскопия биологического материала от больного при исследовании методом «раздавленной капли» в темнопольном микроскопе, что позволяет обнаружить лептоспиры в виде серебристых подвижных нитей. Наиболее информативным методом является выделение культуры возбудителей путем посева материала от больного на питательные среды (фосфатно-сывороточная и др.), однако это исследование требует длительного времени (месяц и более), что значительно уменьшает его диагностическую ценность. Лептоспиры могут быть идентифицированы также путем заражения лабораторных животных, в органах которых обнаруживают возбудителей при окраске нитратом серебра.
В настоящее время используют метод ПЦР-диагностики для обнаружения лептоспир в различных биологических материалах.
Для серологической диагностики применяют преимущественно высокоинформативную реакцию микроагглютинации и лизиса (РМА), диагностические титры которой (1:100 и более) выявляются в парных сыворотках крови, взятой в период разгара и в более поздние сроки болезни (диагностический признак — нарастание титра в 4 раза и более). Могут использоваться РСК и РНГА.
Дифференциальная диагностика. Лептоспироз следует дифференцировать от большой группы инфекционных и неинфекционных болезней. В начальный период проводят дифференциальный диагноз с гриппом, тифо-паратифозными заболеваниями, геморрагическими лихорадками, менингитами разной этиологии. В период разгара — с желтушными формами вирусных гепатитов, малярией, желтой лихорадкой, иерси-ниозами.
Схема 4. Диагностика лептоспироза
I
4. Гепатоспленомегалия
Наиболее диагностически значимые признаки:
-
Лихорадка (4—5 дней и больше)
-
Головная боль
-
Нарушение сна
Инфекция?
Решение вопроса о принадлежности к зоонозным инфекциям
-> Генерализованная инфекция'
Дифференциальная диагностика с различными видами сепсиса и другими инфекционными и неинфекционными заболеваниями
Генерализованная зоонозная инфекция
5. Полисистемность: менингеальный и гепа-толиенальный синдромы, микрополиаде-нит, симптомы поражения сердечно-сосудистой и дыхательной систем, геморрагический и анемический синдромы
Г
Вспомогательные диагностические признаки:
-
Эпидемиологический анамнез, детализированный с учетом зооноз-ного характера заболевания
-
Микросимптомы болезни: миалгии, гиперемия конъюнктив и инъекция сосудов склер, «эндотель-симптомы» (Румпеля — Кончалов-ского — Лееде, симптомы «щипка», «резинки» и др.)
-
Характер изменения гемограммы (лейкоцитоз, нейтрофилез, увеличение СОЭ)
1
Лептоспироз? I
Решающие диагностические признаки:
-
Обнаружение возбудителя в крови, цереброспинальной жидкости, моче методом прямой микроскопии в темном поле
-
Выделение гемо- и урннокультуры возбудителя
-
Положительные результаты биопробы
-
Диагностические титры в РМА и РСК
~1
Лептоспироз
Лечение. Больные лептоспирозом подлежат обязательной госпитализации в инфекционные стационары, где им проводят комплексную этиотропную, патогенетическую и симптоматическую терапию, назначают щадящую диету и соответствующий периоду болезни двигательный режим.
Этиотропное лечение проводят пенициллином, который вводят внутримышечно 6 раз в сутки в дозе 6—12 млн ЕД, при наличии менингита — 24 млн ЕД в сутки в течение 7— 10 дней. Эффект наиболее выражен при раннем назначении антибиотиков (до 4-го дня болезни). При непереносимости пенициллина применяют эритромицин внутривенно по 500 мг каждые 6 ч, реже доксициклин по 100 мг 2 раза в сутки.
Наряду с антибиотикотерапией обычно при тяжелых формах применяют противолептоспирозный гетерологичный гамма-глобулин, содержащий антитела к наиболее распространенным сероварам лептоспир. Гамма-глобулин вводят внутримышечно в первые сутки 10—15 мл, в последующие 2 дня по 5—10 мл. Раннее применение гамма-глобулина в начальном периоде болезни снижает частоту и степень выраженности органных поражений, способствует более благоприятному течению болезни.
Этиотропная терапия проводится в сочетании с патогенетическими средствами, включающими дезинтоксикационные растворы, диуретические препараты, средства, повышающие резистентность сосудов и свертывание крови, антигистамин-ные препараты и анальгетики. При тяжелом течении болезни назначают глюкокортикоиды (обычно преднизолон от 40—60 до 120 мг в сутки и более).
При прогрессировании острой почечной недостаточности проводят коррекцию электролитных и ацидотических расстройств, назначают повышенные дозы осмо- и салуретиков, а при значительной азотемии и длительной анурии применяют гемодиализ, гемосорбцию, плазмаферез, гемофильтрацию, гипербарическую оксигенацию и другие методы интенсивной терапии.
Важное значение имеют тщательный уход за больными и профилактика ассоциированной инфекции. При значительно выраженной анемии проводят гемотерапию.
Реконвалесценты лептоспироза подлежат диспансеризации в течение 6 мес с участием инфекциониста, нефролога, офтальмолога и невропатолога.
Профилактика. Предупреждение лептоспироза у людей предусматривает проведение комплекса гигиенических и ветеринарных мероприятий.
Запрещается употребление сырой воды из открытых водоемов, купание в малопроточных водоемах, доступных сельскохозяйственным животным. Необходимо пользоваться защитной одеждой и обувью при мелиоративных и гидротехнических работах.
В антропоургических очагах водоемы защищают от грызунов и сельскохозяйственных животных, ветеринары и животноводы должны пользоваться спецодеждой. Необходимо постоянно проводить дератизационные мероприятия. Осуществ
ляют изоляцию и лечение больных животных. Эффективна вакцинация сельскохозяйственных животных.
Цереброспинальная жадность-нормальная или
лимфоци тарный плеоцитоз
Менингоэние-фолит
Пневмония
Иардиопатия
Лимфаденопатия
Печеночные пробы нормальные или
незначительно изменены
Артриты, бурситы Гепатосплено-мегалия
Орогенитальные расстройстоа
Гемограмма ■■ лейкопения лимфоцитоз лоВышение СОЭ
УзлоВатая эритема
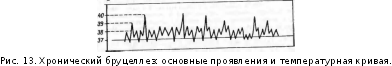
Контингента высокого риска заражения (животноводы, ветеринары, рабочие мясокомбинатов, ассенизаторы, дератиза-торы и др.) подлежат вакцинации убитой лептоспирозной вакциной. Вакцина вводится (по 2 мл подкожно) двукратно с интервалом 7—10 дней с последующей ревакцинацией через год.
БРУЦЕЛЛЕЗ
Син.: мальтийская, средиземноморская, неаполитанская, кипрская, ундулирующая лихорадка, септицемия Брюса, болезнь Банга, болезнь Траума
Бруцеллез (Brucellosis) — зоонозное инфекционное заболевание с высоким потенциалом хронизации. Характеризуется длительной лихорадкой и поражением опорно-двигательного аппарата, сердечно-сосудистой, нервной, мочеполовой и других систем организма (рис. 13).
Исторические сведения. Начало изучения бруцеллезной инфекции у людей положил Дж. Марстон в 1859 г., наблюдавший ее на о. Мальта. Тогда же это заболевание получило название «мальтийская лихорадка». В 1886 г. Д. Брюс обнаружил в селезенке умершего человека возбудителя «мальтийской лихорадки» и дал ему название Micrococcuc melitensis. В 1897 г. А. Райт и Д. Семпл установили, что сыворотка больных «мальтийской лихорадкой» дает реакцию агглютинации с М. melitensis, с тех пор эта реакция под названием реакции Райта приобрела большое значение в серодиагностике бруцеллеза. Датские исследователи Б. Бант и В. Стриболд в том же году из околоплодной жидкости абортировавшей коровы выделили микроорганизм, названный Brucella abortus bovis.
В 1914 г. из плода свиньи Дж. Траум выделил возбудителя инфекционного аборта свиней—Br. abortus suis. В 1920 г. возбудители аборта коров, коз, свиней и овец объединены в группу бруцелл, а само заболевание получило название «бруцеллез». В 1957 г. в США от пустырниковых крыс были выделены микроорганизмы, близкие к бруцеллам, отнесенные к новому виду — Brucella neotomae. В 1970 г. в Мехико к бруцеллам были причислены новые виды микроорганизмов: 1) вызывающие орхиэпидидимит у баранов (Br. ovis); 2) культуры, полученные от собак (Br. canis).
Этиология. В настоящее время известны 6 основных видов возбудителей бруцеллеза: Br. melitensis, Br. abortus bovis, Br. abortus suis, Br. neotomae, Br. canis, Br. ovis.
Основными носителями Br. melitensis являются овцы и козы, Br. abortus bovis поражает преимущественно крупный рогатый скот, Вг. abortus suis — свиней; Вг. neotomae — пустынных кустарниковых крыс; Br. canis —собак; Br. ovis —овец. Каждый из видов бруцелл подразделяется на биотипы с различно выраженной патогенностью для человека. Br. neotomae для людей не патогенны, значение Br. ovis в патологии человека изучается.
В морфологическом отношении виды бруцелл не отличаются друг от друга. Микробы имеют шаровидную или овоидную форму; размеры их 0,3—0,6 мкм. Грамотрицательны, могут расти на обычных питательных средах. В первых генерациях при высеве из организма бру-целлы растут медленно (2—4 нед), при пересевах их рост ускоряется. Под влиянием антибиотиков бактерии способны трансформироваться в L-формы.
Бруцеллы характеризуются высокой способностью к инвазии и внутриклеточному паразитированию. При их разрушении выделяется эндотоксин.
Бруцеллы не устойчивы к высокой температуре: при 60 °С они погибают в течение 30 мин; кипячение губит бактерии моментально. При низких температурах они могут сохраняться длительное время. Бруцеллы быстро погибают под воздействием прямых солнечных лучей и обычных дезинфицирующих веществ в рабочих концентрациях.
Эпидемиология. Бруцеллез относится к типичным зоонозам, человек является биологическим тупиком — больной человек не является источником инфекции. Характеризуется множественными путями заражения и выраженным профессиональным характером заболеваемости.
Источниками инфекции являются мелкий и крупный рогатый скот, свиньи, а в некоторых местах и северные олени. Наиболее важное эпидемиологическое значение принадлежит мелкому рогатому скоту вследствие облигатной патогенности для человека Br. meliten-sis. Эпизоотии бруцеллеза среди овец и коз влекут за собою эпидемические вспышки этого заболевания у людей. Br. abortus bovis, Br. abortus suis менее патогенны для человека. По этой причине крупный рогатый скот и свиньи имеют меньшее эпидемиологическое значение.
При совместном содержании или выпасе нескольких видов больных и здоровых животных между ними происходит обмен различными видами бруцелл. В этом процессе большое эпидемиологическое значение приобретает миграция Br. melitensis с мелкого рогатого скота на крупный рогатый скот и другие виды животных.
Заболевание бруцеллезом животных в период беременности в большинстве случаев влечет за собой аборт, при этом в плоде, его оболочках, околоплодной жидкости, плаценте возбудитель содержится в большом количестве.
У животных бруцеллы выделяются с мочой, испражнениями и молоком, а у абортировавших и с околоплодной жидкостью.
В передаче инфекции от животных к человеку большое эпидемиологическое значение имеют мясо и сырые молочные продукты: молоко, брынза, сыр. В сырых молочных продуктах бруцеллы сохраняются 15—60 дней, в мясе — до 20 дней.
Выделениями больных животных, содержащих бруцеллы, загрязняются шерсть, корм, подстилка в стойлах, почва, вода и др. Все эти инфицированные объекты могут служить факторами передачи возбудителя.
Заражение человека обычно происходит алиментарным или контактным путями. Однако возможен и аэрогенный механизм заражения, обусловленный проникновением микробов через верхние дыхательные пути с пылевыми частицами шерсти, навоза, подстилки и земли. В интенсивных очагах, особенно овечьего и свиного бруцеллеза, основным является контактный путь заражения человека. При этом микробы проникают через кожные покровы лиц, обслуживающих больных животных или обрабатывающих сырье животного происхождения.
Связь заболевания бруцеллезом с больными животными и продуктами животноводства обусловливает выраженный профессиональный характер этой инфекции. Основной контингент больных —работники животноводства и предприятий, обрабатывающих продукты от животных. Лица молодого и среднего возраста, наиболее часто контактирующие с источниками инфекции, составляют около 90 % заболевших.
В энзоотических очагах бруцеллеза сезонный подъем заболеваемости людей связан с периодом отела, окота или опороса у животных.
В результате проведения в государственном масштабе противо-бруцеллезных мероприятий во многих регионах нашей страны заболеваемость бруцеллезом сельскохозяйственных животных полностью ликвидирована; прекратились и заболевания людей. Однако бруцеллез сохранил свою значимость как краевая патология в азиатских регионах страны, в Казахстане, Закавказье, во многих странах Азии, Африки и Южной Америки.
Иммунитет при бруцеллезе не напряженный и не продолжительный, в среднем он длится 6—9 мес, не является строго специфическим. Это дает возможность вакцинировать людей маловирулентным штаммом коровьего типа (Br. bovis), создавая иммунитет к овечьему типу бруцелл (Br. melitensis).
Патогенез и патологическая анатомия. Бруцеллы проникают в организм через кожу или слизистые оболочки, захватываются макрофагами, размножаются в них и током лимфы заносятся в регионарные лимфатические узлы, а из них по лимфатическим и кровеносным сосудам распространяются по всему организму.
Схема патогенеза бруцеллеза включает пять фаз инфекции: лимфогенную, гематогенную, фазу полиочаговых локализаций, фазу экзоочаговых обсеменений и фазу метаморфоза. Степень проявления отдельных фаз и последовательность их развития зависят от индивидуальных особенностей организма, входных ворот инфекции, вида и дозы возбудителя, условий заражения.
Поступление инфекции по лимфатическим путям в регионарные лимфатические узлы — первая фаза патогенеза, т. е. фаза лимфогенного заноса и лимфорецепторных раздражений, — соответствует инкубационному периоду заболевания. Дальнейшее развитие патологического процесса определяется инфицирующей дозой и состоянием защитных сил ор ганизма. Бруцеллы могут длительно сохраняться в лимфатических узлах, обусловливая иммунологическую перестройку организма без каких-либо клинических проявлений (первичная латен-ция). При значительном накоплении возбудителя вследствие незавершенного фагоцитоза, характерного для этой инфекции, лимфатические узлы становятся резервуарами возбудителей, откуда бруцеллы могут поступать в кровь и распространяться по всему организму (фаза гематогенного заноса, первичной генерализации). Клинически это соответствует острому периоду болезни, проявляется лихорадкой, ознобами, потами, микрополиаденитом и другими симптомами.
Из крови бруцеллы захватываются клетками системы мо-нонуклеарных фагоцитов различных органов (печень, селезенка, костный мозг и др.) с формированием в них метастатических очагов инфекции (фаза полиочаговых локализаций).
С началом генерализации возбудителя и формирования метастатических инфекционных очагов происходит иммуноаллер-гическая перестройка организма, определяющая особенности патогенеза и патоморфологической картины заболевания.
Бруцеллез относится к тем инфекционным заболеваниям, при которых иммунный ответ не обеспечивает у значительной части больных бактериологическое очищение организма. Бруцеллы длительно сохраняются в метастатических очагах, из них происходит повторная многократная диссеминация возбудителя с развитием реактивно-аллергических изменений и хронизацией процесса (фаза экзоочаговых обсеменений и реактивно-аллергических изменений). Суперинфекция, нередко имеющая место в эндемических очагах болезни, является дополнительным фактором, способствующим развитию обострений, рецидивов и хронизации заболевания. Хроническое течение, сопровождающееся многократной генерализацией возбудителя из метастатических очагов, придает бруцеллезу характер хрониосепсиса. Длительное воздействие возбудителя и продуктов его жизнедеятельности на органы и ткани обусловливает иммуноаллергическую перестройку организма и комплекс проявлений, характерных для подострого и хронического бруцеллеза. В клинической картине наряду с присущими острому бруцеллезу симптомами появляются очаговые поражения различной локализации. В этот период уменьшается вероятность высева бруцелл из крови, выявляются положительные аллергические пробы (проба Бюрне).
Вместе с тем следует отметить, что и в эту фазу болезни возможно выделение бруцелл из крови, чаще в виде L-форм.
Следующая фаза — фаза резидуального метаморфоза — соответствует исходам бруцеллеза, завершающегося либо полным рассасыванием воспалительных образований, либо формированием стойких необратимых Рубцовых изменений в пораженных органах и тканях.
Патологоанатомические изменения при бруцеллезе полиморфны. Преимущественные изменения выявляются в соединительной ткани различных органов, характер и степень выраженности которых определяются фазой развития патологического процесса. В острой фазе заболевания возникают экс-судативно-воспалительные изменения в лимфатических узлах и внутренних органах (печень, селезенка, костный мозг и др.) с развитием в них серозного воспаления. Возникает инфекци-онно-реактивный васкулит. В подострой и хронической фазах процесса преобладают продуктивно-воспалительные изменения с образованием специфических бруцеллезных гранулем, преимущественно в опорно-двигательной, нервной, половой системах.
Клиническая картина. Инкубационный период при бруцеллезе длится от 7 до 30 дней. Клинические проявления весьма полиморфны и могут варьировать как по длительности течения, так и по разнообразию симптомов.
В очагах инфекции нередко встречается латентный бруцеллез (первичная длительная латенция), при котором у зараженных людей бруцеллы находятся в виде «дремлющей» инфекции, вызывая иммуноаллергическую перестройку организма. Однако при тщательном клиническом обследовании у части инфицированных лиц можно обнаружить некоторые симптомы болезни: увеличение лимфатических узлов, функциональные расстройства нервной системы, увеличение печени и селезенки и т. д. Серологические пробы и кожная аллергическая проба Бюрне у таких людей положительные.
Клинически выраженные формы бруцеллеза проявляются длительной лихорадкой, ознобами, повышенной потливостью, гепатоспленомегалией, поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой, урогенитальной и других систем организма.
Известно несколько клинических классификаций бруцеллеза, основанных на учете особенностей проявления этой инфекции. Е. С. Белозеров (1985), много работавший с больными бруцеллезом melitensis в Казахстане, предложил следующую классификацию болезни: субклиническая форма (у лиц, «положительно реагирующих» на пробу Бюрне); клинически выраженные формы: острый, подострый и хронический бруцеллез; хронический бруцеллез компенсированный, субком-пенсированный, декомпенсированный (с указанием органопа-тологии); суперинфекция; реинфекция; резидуальный бруцеллез (остаточные явления).
Острая и подострая формы бруцеллеза. В начале заболевания нередко имеет место продромальный период длительностью 3—5 дней, проявляющийся недомоганием, слабостью, подавленностью настроения, быстрой физической и умственной утомляемостью, легкой головной болью и понижением аппетита.
К концу продромального периода признаки интоксикации нарастают. Развиваются основные клинические проявления болезни, среди которых кардинальными являются гипертермия, сопровождающаяся ознобами и проливными потами, ге-патоспленомегалия.
Лихорадка длительная, в разгар заболевания температурная кривая ремиттирующего типа с подъемом во второй половине дня или в вечерние часы. Она может носить ундулируюший (волнообразный) и интермиттирующий тип или представлять собой длительный субфебрилитет.
Несмотря на продолжительность и высоту лихорадки, состояние больных не нарушается, самочувствие остается хорошим, часто выявляются словоохотливость и эйфория.
При острой форме бруцеллеза в течение одного и того же дня у больных наблюдаются однократные и многократные познабливания, иногда потрясающий озноб. В начале озноба температура тела иногда падает ниже нормы, затем возникают жар, сухость во рту, постепенно нарастает температура тела. Каждый раз озноб и повышение температуры тела завершаются профузным потоотделением.
Лимфатические узлы, особенно шейные и подмышечные, увеличены до (1—2) х (1,5—3) см, безболезненны и не спаяны с окружающей тканью.
У большинства больных обнаруживается умеренное расширение границ сердца влево, приглушенность его тонов, систолический шум на верхушке; в тяжелых случаях выявляются миокардит, эндокардит, перикардит. Артериальное и венозное давление понижено. Частота пульса соответствует температуре. У ряда больных бывает дикротия пульса, иногда экстра-систолия. Повышается проницаемость капилляров.
При острой форме заболевания, по мере развития токсико-септического процесса, выявляются изменения со стороны органов дыхания: катаральное воспаление верхних дыхательных путей, бронхиты, бронхопневмонии, бронхоадениты.
Печень и селезенка увеличены, мягкие, болезненные при пальпации. При поражении печени часто отмечаются ноющие боли в правом подреберье.
О поражении нервной системы в разгар острой формы заболевания свидетельствуют головные боли, раздражительность, эмоциональная неустойчивость, чрезмерная утомляемость, нарушения сна. В тяжелых случаях бруцеллезной инфекции наблюдаются расстройства психики, явления менин-гизма и менингита. Течение менингита обычно вялое, без четкой выраженности общемозговых и менингеальных симптомов. Лишь в отдельных случаях менингит протекает с яркой симптоматикой. Бруцеллезный менингит имеет обычно серозный характер.
Опорно-двигательная система при остром бруцеллезе поражается лишь у части больных в виде кратковременных артрал-гий, которые быстро исчезают по мере уменьшения признаков интоксикации.
На поздних сроках заболевания появляются клинические признаки иммуноаллергической перестройки организма.
У значительной части больных заболевание характеризуется наклонностью к затяжному течению с переходом его в под-острую и хроническую формы. Этому могут способствовать несвоевременная диагностика и поздно начатое лечение. После проведенной этиотропной терапии в организме больных даже при полном отсутствии клинических признаков могут сохраняться бруцеллы, локализованные внутриклеточно в системе мононуклеарных фагоцитов внутренних органов.
Длительное пребывание бруцелл, фиксированных в клетках, при наличии «расшатывающих» организм факторов (физические и эмоциональные перегрузки, переохлаждения, резкое нарушение обменных процессов и др.) приводит к вторичной генерализации инфекции с развитием клинических симптомов рецидива заболевания. Рецидивы могут возникать через 1—2 мес и в более поздние сроки после угасания симптомов.
Обычно рецидивы бруцеллеза протекают с ознобом, повышением температуры, усилением потоотделения. С первых же дней рецидива выявляются очаговые поражения отдельных органов и систем, при этом наиболее постоянно поражается опорно-двигательная система.
При определении продолжительности бруцеллезной инфекции следует учитывать возможность супер- и реинфекции, часто возникающих в эндемических очагах и значительно увеличивающих продолжительность заболевания. Некоторая часть больных при своевременном и правильно проведенном лечении выздоравливает спустя 1—2 года от начала болезни, однако чаще болезненный процесс затягивается и принимает хроническое течение.
Хроническая форма бруцеллеза развивается чаще всего вследствие ранее перенесенных острой и подострой форм болезни и ее рецидивов. Однако допускается возможность развития первично-хронического бруцеллеза непосредственно после периода первичной латенции.
Клинические симптомы хронического бруцеллеза проявляются на фоне предшествующей иммуноаллергической перестройки организма. Эта форма отличается полиморфизмом и лабильностью клинических признаков, рецидивирующим течением, слабой выраженностью интоксикации, преобладанием очагового поражения систем и органов.
Наиболее часто при хроническом бруцеллезе наблюдается поражение опорно-двигательной системы в виде артритов, периоститов, перихон-дритов. Характерны полиартриты с вовлечением в патологический процесс преимущественно крупных суставов — коленный (рис. 14), тазобедренный, локтевой, пояснич-но-крестцовое сочленение и др., редко поражаются мелкие суставы. Отмечаются боли в мышцах и суставах, огра- рис. 14. Поражение коленных ничение движений. Суставы суставов при хроническом бру-опухают, может быть гипере- целлезе.
мия кожи за счет периартрита. В суставах могут развиваться воспалительные изменения, сопровождающиеся накоплением выпота. При повторных поражениях суставов изменению подвергаются внутрисуставные поверхности, мениски, хрящи с последующим сужением суставной щели и ее заращением. Это приводит к артрозам, спондилоартрозам, анкилозу.
Характерно поражение крестцово-подвздошных сочленений с развитием анкилоза. При хроническом бруцеллезе часто поражаются мышцы. Миозиты сопровождаются болями — продолжительными, разной интенсивности. Помимо миозитов у больных бруцеллезом часто выявляются фиброзиты (целлюлиты). Они локализуются в подкожной клетчатке на спине, пояснице, реже — на голенях и предплечьях. Размеры их колеблются от 5—10 мм до 3—4 см. Со временем они уменьшаются в размерах, могут полностью рассосаться или склерозируются и остаются длительно безболезненными.
Жалобы больных на общую слабость, утомляемость, повышенную раздражительность, нарушение сна свидетельствуют о функциональном расстройстве нервной системы, протекающем по типу неврастении.
Поражения периферической нервной системы при хроническом бруцеллезе проявляются радикулитами, плекситами, межреберными и другими видами невралгий, расстройствами чувствительности, парезами, невритами слухового и зрительного нервов со значительным снижением слуха и остроты зрения.
Хроническая интоксикация центральной нервной системы, особенно коры головного мозга, в случаях длительного течения инфекции приводит к тяжелым неврозам, реактивным состояниям, ипохондрии, психозам. Наблюдаются кратковременные психосенсорные расстройства, оптико-вестибулярные и рецепторные нарушения. Более стойкими бывают расстройства психики с астеническим и ипохондрическим синдромами, ослабление памяти, понижение или повышение эмоциональной возбудимости.
При вовлечении в процесс вегетативной нервной системы нарушается тонус сосудов, возникают акроцианоз, обильное потоотделение, трофические нарушения кожи.
Закономерно поражается сердечно-сосудистая система и в первую очередь кровеносные сосуды. У больных возникают эндо-, пери- и панваскулиты, повышается проницаемость капилляров. Нередко отмечаются миокардиты, эндокардиты, панкардиты. Печень и селезенка увеличены, уплотнены, их функции нарушены.
При хроническом бруцеллезе нередко поражается урогени-тальная система: у мужчин возникают орхит, эпидидимит, у женщин — оофорит, сальпингит, эндометрит, нарушение менструального цикла и прерывание беременности.
В ряде случаев выявляется нарушение функции щитовидной железы, надпочечников и других эндокринных органов.
Картина крови характеризуется лейкопенией, лимфоцито-зом, моноцитозом, эозинопенией, тромбоцитопенией.
Для хронического бруцеллеза характерно волнообразное течение с ремиссиями и рецидивами. Больные надолго утрачивают работоспособность, могут стать инвалидами.
У вакцинированных лиц заболевание протекает легче и менее продолжительно, с невысокой температурой, нередко с самого начала отличается локальными симптомами в виде первично-хронической формы болезни. У значительного числа вакцинированных, заболевших первично-хроническим бруцеллезом, заболевание принимает стертый характер с мало выраженными проявлениями. Наиболее постоянным и иногда единственным симптомом в таких случаях являются арт-ралгии.
Резидуальная фаза (клиника поеледствий) бруцеллеза. У лиц, перенесших бруцеллез, нередко наблюдаются те или иные остаточные явления в основном функционального характера, обусловленные иммуноаллергической перестройкой организма и расстройствами вегетативной нервной системы. У таких больных отмечаются повышенная потливость, раздражительность, изменения нервно-психической сферы, нередко имеются артралгии. Боли в суставах чаще непостоянного характера, при этом видимых изменений в суставах не выявляется. Эти боли усиливаются при выполнении физической работы и в связи с переменой погоды. Температура тела у больных обычно нормальная, иногда субфебрильная. У ряда больных, перенесших бруцеллез, наблюдаются органические изменения опорно-двигательной системы с деформациями суставов за счет разрастания околосуставной ткани, что выявляется при клиническом и рентгенологическом обследовании. Стойкие и необратимые явления со стороны опорно-двигательного аппарата могут требовать оперативного вмешательства.
Прогноз. Для жизни, как правило, благоприятный. Летальность низкая. Прогноз в отношении трудоспособности и здоровья нередко неудовлетворителен.
Диагностика. В диагностике бруцеллеза учитывают клинические данные, эпидемиологический анамнез и результаты лабораторного обследования.
Эпидемиологический анамнез, указывающий на возможность профессионального или бытового заражения, имеет очень большое значение в диагностике бруцеллеза.
Каждый случай заболевания, подозрительный на бруцеллез, обязательно должен быть подтвержден лабораторно. Для этого обычно используют бактериологический, биологический, серологический и аллергологический методы исследования.
Выделение культуры бруцелл от больных является несомненным подтверждением диагноза. Возбудитель может быть получен с использованием специальных сред из крови, костного мозга, желчи, мочи, лимфатических узлов, цереброспинальной жидкости, суставной жидкости (при артритах), влагалищного отделяемого, пунктата селезенки. Рост бруцелл происходит медленно, в течение месяца. Бактериологические исследования ввиду их сложности и необходимости соблюдения мер предосторожности проводятся в специальных лабораториях. В1 последние годы нередко удается выделять L-формы бруцелл.
В практике лабораторной диагностики бруцеллеза нашед] применение метод иммунофлюоресценции, позволяющий обнаружить бруцелл в различных материалах, даже обсемененных сопутствующей микрофлорой.
В серологической диагностике бруцеллеза большое значение сохраняет реакция Райта, которая часто является положительной уже в первые дни заболевания; диагностическим считается титр агглютининов в исследуемой сыворотке крови не менее 1:200.
Для ускорения серодиагностики бруцеллеза широко приме* няется пластинчатая реакция агглютинации Хеддлсона с цельной сывороткой и концентрированным антигеном. Диагностическую ценность имеют также РСК, РИТА и реакция Кум-бса. Они отличаются более высокой чувствительностью, чем другие серологические методы.
Из аллергологических методов диагностики бруцеллеза ис-| пользуют реакцию Бюрне путем внутрикожного введения бру-целлина — фильтрата бульонной культуры возбудителя. Эта реакция основана на способности организма, сенсибилизированного бруцеллезным антигеном, отвечать развитием специфического процесса в коже в виде покраснения и отека. Реакцию учитывают по величине отека: при его диаметре менее 1 см реакция считается сомнительной, от 1 до 3 см — слабо положительной, от 3 до 6 см — положительной и более 6 см — резко положительной. Как правило, внутрикожная проба становится положительной к концу первого месяца заболевания. Она бывает положительной и у лиц, вакцинированных живой бруцеллезной вакциной. Особое значение эта реакция приобретает в диагностике хронического бруцеллеза.
Дифференциальная диагностика. Разнообразие симптомов,] свойственных бруцеллезу, обусловливает необходимость дифференциальной диагностики инфекции с большим числом заболеваний. Острый бруцеллез, характеризующийся выраженной лихорадочной реакцией, необходимо дифференцировать от брюшного тифа, малярии, Ку-лихорадки, сепсиса, туляремии, висцерального лейшманиоза, лимфогранулематоза и др.
При подостром и хроническом бруцеллезе, когда в клинив ческой картине доминируют очаговые проявления, чаще всего приходится исключать туберкулезное поражение различной локализации, ревматизм, ревматоидный артрит, полиартриты сифилитической и гонорейной природы. Перечень болезней, требующих дифференциальной диагностики, может быть очень большим. Поэтому при наличии клинических симптомов, напоминающих бруцеллез (длительный субфебрилитет, потливость, увеличение лимфатических узлов, печени, селезенки, поражение опорно-двигательного аппарата, нервной, урогенитальной и сердечно-сосудистой систем), а также с учетом эпидемиологических данных (пребывание в эндемическом очаге, профессиональный или бытовой контакт с сельскохозяйственными животными и т. д.) в первую очередь необходимы специфические лабораторные исследования, позволяющие верифицировать диагноз бруцеллеза.
Лечение. Задачами лечения больных бруцеллезом являются купирование болезненного процесса, ликвидация его последствий и восстановление трудоспособности пациента. Терапия болезни зависит от фазы, степени компенсации процесса и характера иммуноаллергической перестройки организма.
Для лечения острых и подострых форм бруцеллеза вначале применяют антибиотики: левомицетин (по 0,5 г 4 раза в сутки) или рифампицин (0,9 г в сутки), тетрациклин (по 0,5 г 4 раза в сутки), доксициклин (0,2 г в сутки), стрептомицин (по 0,5 г 2 раза в сутки внутримышечно). Продолжительность курса антибиотикотерапии не менее 14 дней. В последние годы в терапии бруцеллеза с хорошим эффектом применяют препараты из группы хинолонов (офлоксацин, дифлоксацин и др.), антибиотики комбинируют с бисептолом.
При хроническом бруцеллезе антибиотики применяют лишь в периоде обострения болезни с выраженными клини-ко-лабораторными проявлениями. При отсутствии признаков активации процесса, а также в стадии субкомпенсации хронического бруцеллеза с устойчивой нормализацией температуры назначение антибиотиков нецелесообразно.
Широко применявшаяся в прошлом лечебная вакцина в настоящее время используется крайне редко из-за высокой аллергизации населения вообще и сенсибилизирующих свойств вакцины.
При тяжелом течении острого бруцеллеза, иногда и при подострой и хронической формах болезни, применяют глюко-кортикостероиды.
С целью иммунной коррекции при бруцеллезе используют различные иммуномодуляторы.
При артритах и периартритах эффективно внутри- или пе-риартикулярное введение гидрокортизона. При подостром и хроническом бруцеллезе с преимущественным поражением опорно-двигательного аппарата и периферической нервной системы назначают нестероидные противовоспалительные средства с аналгезирующим эффектом: бутадион, ацетилсали-
циловая кислота, анальгин, реопирин, индометацин, бруфен, ибупрофен, вольтарен, диклофенак, найз и др.
Гиперемия лица и шеи („капюшонп
Фарингит
Лимфаденит
Печеночные пробы:
ftcflT, йлОТ\ билирубин \
Точечная сыпь
Гепатосплено-мегалия
Мезаденит
Гемограмма: , нецтросрильныи лейкоцитоз увеличение СОЭ
Гиперемия ладоней (.перчатки')
Лртралгии

Для лечения больных бруцеллезом широко применяют стимулирующую и десенсибилизирующую терапию, положительное действие на больных с опорно-двигательными поражениями оказывают физиотерапия (УВЧ, диатермия и др.), лечебная физкультура, массаж.
В стадии компенсации или резидуальных проявлений бруцеллеза наиболее эффективно санаторно-курортное лечение, в особенности на бальнеологических курортах с радоновыми и серно-радоновыми водами. При поражении суставов эффективно грязелечение.
Профилактика. Основные меры предупреждения бруцеллеза заключаются в искоренении инфекции у сельскохозяйственных животных, что предопределяется строгим соблюдением ветеринарно-санитарных правил. В целях профилактики бруцеллеза у людей производят обеззараживание молока кипячением и пастеризацией. Продукты, изготовленные из сырого молока, перед употреблением выдерживают необходимые сроки. Следует принимать меры, препятствующие распространению возбудителя с мясом и мясопродуктами. Обеззараживанию подлежат шкуры и шерсть животных.
К работе с инфицированными животными и на предприятиях по обработке животноводческого сырья допускаются лица, положительно реагирующие на бруцеллин или вакцинированные против бруцеллеза. При работе должны использоваться защитная одежда и дезинфицирующие вещества.
Специфическая профилактика бруцеллеза достигается применением живой противобруцеллезной вакцины, обеспечивающей иммунитет на 1—2 года. Вакцинацию проводят в районах, где имеется заболеваемость бруцеллезом среди животных. Иммунопрофилактике подлежат лица, обслуживающие сельскохозяйственных животных, и работники предприятий по обработке продуктов животноводства.
Несмотря на важную роль иммунопрофилактики бруцеллеза решающее значение в предупреждении инфекции имеют санитарно-гигиенические и ветеринарные мероприятия.
ПСЕВДОТУБЕРКУЛЕЗ
Син. — дальневосточная скарлатиноподобная лихорадка
Псевдотуберкулез (Pseudotuberculosis) — острое инфекционное заболевание, характеризующееся интоксикацией, ток-сико-аллергической и очаговой симптоматикой, протекающее с преимущественным поражением органов пищеварительной системы и часто с экзантемой (рис. 15).
Исторические сведения. Возбудитель инфекции описан в 1883 г. Л Маляссе и В. Виньялем, выделен в чистой культуре и подробно изучен Р. Пфейффером в 1899 г. В 1895 г. К. Эберт обнаружил во внутренних органах погибших животных узелковые образования, внешне напоминающие туберкулезные бугорки, но имеющие другую патоморфологию, что послужило поводом для названия этого заболевания псевдотуберкулезом.
Долгое время единичные описания псевдотуберкулеза у человека воспринимались как казуистика. Изменение представления о роли псевдотуберкулезного микроба в патологии человека произошло после того, как в 1953 г. В. Массхофф и В. Кнапп выделили из группы мезаденитов абсцедирующий ретикулоцитарный вариант, сопровождающийся высевом из очага воспаления псевдотуберкулезных бактерий. Вслед за наблюдениями этих авторов псевдотуберкулезные ме-задениты как сравнительно редкая патология человека были описаны во многих странах.
Новый этап в изучении псевдотуберкулеза у человека начался в 1959 г., когда стало складываться представление об эпидемическом характере заболевания. В это время на Дальнем Востоке возникла эпидемия ранее неизвестного заболевания, получившего название «дальневосточная скарлатиноподобная лихорадка» — ДСЛ. В 1965 г. В. А. Знаменский и А. К. Вишняков выделили из фекалий больных ДСЛ палочки псевдотуберкулеза. Опытом самозаражения (В. А. Знаменский) была доказана этиологическая роль этого микроорганизма в возникновении ДСЛ, которая стала рассматриваться как своеобразная клинико-эпидемиологическая форма псевдотуберкулеза человека. В настоящее время это заболевание описано во многих странах мира.
Этиология. Возбудитель псевдотуберкулеза Yersinia pseudotuberculosis относится к роду Yersinia, семейству Enterobacteriaceae. Это грамотрицательная палочка размером (0,8—2) х (0,4—0,6) мкм, спор не имеет. Бактериальная клетка имеет сложную антигенную структуру, образуя различные по своему составу антигенные комплексы, обладающие токсическими свойствами, содержит соматический О- и жгутиковый Н-антигены. По различиям в О-антигене выделяют 8 серологических вариантов псевдотуберкулезной бактерии. Заболевания у человека чаще всего вызывают I, реже — III и единичные — II, IV, V серовары. При разрушении бактериальных клеток выделяется эндотоксин, имеющий существенное значение в патогенезе заболевания. У некоторых штаммов I и III сероваров обнаружена способность к продукции экзотоксинов.
Возбудитель псевдотуберкулеза неприхотлив и растет как на обычных, так и на обедненных питательными веществами средах. Одним из наиболее важных для эпидемиологии заболевания свойств бактерий является их психрофильность, т. е. способность культивироваться при низких температурах. Псевдотуберкулезные бактерии могут быстро размножаться при температуре холодильника от 4 до 8 "С. Они весьма устойчивы к повторному замораживанию и оттаиванию; способны длительно существовать в почве (в глубоких слоях до года), воде (до 180 сут), на различных пищевых продуктах, а в благоприятных условиях (при низких температурах и повышенной влажности) и размножаться вне живого организма (сапрофитные свойства). Таким образом, возбудитель отличает высокая адаптационная способность. Вместе с тем палочка псевдотуберкулеза чувствительна к высыханию, воздействию солнечного света. При кипячении погибает через 10—30 с. Под действием растворов дезинфицирующих веществ в стандартных концентрациях (хлорамин, гипохлорид кальция и др.) возбудитель гибнет в течение нескольких минут.
Эпидемиология. Псевдотуберкулез — это типичный зооноз. В естественных условиях псевдотуберкулезом болеют многие виды млекопитающих и птиц, вместе с тем роль различных животных как источников заболевания человека неравнозначна. В природном очаге происходит постоянная циркуляция иерсиний псевдотуберкулеза между грызунами (дикими животными), выделяющими возбудителей с экскрементами, и окружающей средой, что поддерживает постоянное существование инфекции среди животных, однако отсутствие адекватного пути передачи инфекции человеку делает природные очаги «немыми», не имеющими значения в распространении инфекции среди людей.
Основным резервуаром возбудителя и источником заболевания для человека являются синантропные и дикие грызуны. Они инфицируют своими выделениями продукты питания и воду, где возбудитель не только сохраняется, но при низких температурах размножается и накапливается. Другим резервуаром псевдотуберкулезных бактерий является почва. Частое обнаружение в ней возбудителя связано не только с загрязнением испражнениями, но и с наличием у псевдотуберкулезной бактерии сапрофитных свойств. На этом основании заболевание может быть отнесено к сапрозоонозам. Человек источником псевдотуберкулеза не является.
Механизм передачи инфекции фекально оральный, ведущий путь заражения — пищевой. Наиболее обсемененными иерсиниями являются овощи, особенно закладываемые на длительное хранение. В условиях низких температур и повышенной влажности на овощах и окружающей среде (инвентаре, ящиках, полках и т. п.) создаются наиболее благоприятные условия для размножения и накопления возбудителей. К основным факторам передачи относятся овощные блюда (салаты из капусты и моркови, винегреты и др.), употребляемые в пищу без предварительной термической обработки. Возможно попадание возбудителей в готовые продукты питания (особенно опасно в пищеблоках), причем значительному их накоплению способствует хранение в условиях холодильника. Другие пути передачи инфекции (например, контактно-бытовой при уходе за больными животными) существенного значения в эпидемиологии псевдотуберкулеза не имеют.
К псевдотуберкулезу восприимчивы взрослые и дети, но у последних он регистрируется чаще. Это во многом связано с тем, что дети нередко находятся в коллективах (ясли, детские сады, школы, училища и т. д.) с общим пищеблоком. Чаще болеют жители городов. Псевдотуберкулез встречается в виде спорадических и групповых заболеваний, которые регистрируются в течение всего года. Сезонный подъем заболеваемости наблюдается в весенние месяцы (март—май).
Появление и повсеместный рост заболеваемости псевдотуберкулезом с середины XX в. обусловлены социально-экономическими факторами: урбанизацией, ростом городского населения; увеличением организованных коллективов с централизованными источниками питания; развитием пищевой промышленности; увеличением числа и укрупнением хранилищ продуктов питания и т. д.
Патогенез и патологоаиатомическая картина. Как и при
других кишечных инфекциях, возбудитель попадает в организм человека через рот с инфицированными продуктами питания. Преодолев защитный барьер желудка, бактерии фиксируются в лимфатическом аппарате кишечника (адгезия бактерий к эпителиальным клеткам подвздошной и слепой кишки, размножение и накопление в лимфатических фолликулах), что соответствует энтеральной фазе патогенеза. Патоморфоло-гические изменения в месте фиксации возбудителя нередко бывают значительными (в виде терминального илеита, аппендицита), но иногда выражены слабо и макроскопически не выявляются.
По лимфатическим сосудам кишечника возбудитель достигает регионарных лимфатических узлов, где происходит его интенсивное размножение, накопление, что сопровождается выраженной воспалительной реакцией лимфатического аппарата, развивается мезаденит. Наступает следующая фаза патогенеза — лимфангита и регионарного лимфаденита. Продукты воспаления, жизнедеятельности иерсиний, токсичные антигенные комплексы, а также эндотоксин, выделяющийся при гибели микробов в очаге воспаления, определяют развитие интоксикационного синдрома. Длительное сохранение возбудителя в лимфатическом аппарате приводит к ранней сенсибилизации организма к бактериям и эндотоксину. В связи с этим, наряду с токсическим повреждением различных органов и тканей, при псевдотуберкулезе важная роль отводится аллергическим реакциям.
Ранним ответом иммунной системы на внедрение возбудителей псевдотуберкулеза является фагоцитоз, однако на первых этапах, как правило, незавершенный. Макрофаги не только не обеспечивают переваривание и гибель бактерий, но и способствуют диссеминации — участвуют в их «транспортировке» в различные органы и ткани. Гибель фагоцитов сопровождается выходом жизнеспособных бактерий в окружающую среду. Это приводит к кратковременному выходу возбудителя за пределы очага воспаления в кровеносное русло (эпизоды бактериемии) с быстрой его гибелью под действием бактерицидных свойств крови с выделением эндотоксина.
В большинстве случаев эта фаза инфекционного процесса, соответствующая локализованной форме инфекции, завершается выздоровлением. Токсико-аллергические повреждения обеспечивают разнообразные внекишечные проявления инфекции как в разгар заболевания, так и в период обострений и рецидивов.
При прорыве лимфатического барьера (обычно при его несостоятельности у лиц с дефектами иммунной системы) развиваются бактериемия и паренхиматозная диссеминация возбудителя. Все эти патогенетические факторы обусловливают возможность развития генерализованных (септических) наиболее тяжелых форм псевдотуберкулеза.
Патологоанатом ическая картина, описанная у погибших при тяжелых формах болезни, свидетельствует о поражении всех органов и систем. В органах, богатых макрофагальными элементами, определяются псевдотуберкулезные очаги — «гранулемы», а иногда и микроабсцессы, в других органах отмечаются неспецифические изменения дистрофического характера.
В патогенезе псевдотуберкулеза можно выделить три основных компонента: инфекционный, токсический и аллергический, которые имеют существенное значение как при локализованных, так и при генерализованных формах заболевания.
Заключительным звеном патогенеза псевдотуберкулеза служит освобождение организма от возбудителя, ведущее к выздоровлению. Клинические данные свидетельствуют о том, что иммунитет развивается медленно и не является достаточно прочным, в связи с чем возникают обострения и рецидивы болезни, однако заболевание не приобретает хроническое течение. У части больных, особенно имеющих HLA В27, псевдотуберкулез может явиться толчком к образованию иммунопатологических реакций, выливающихся иногда в системные заболевания (типа коллагенозов).
Клиническая картина. Псевдотуберкулез отличается полиморфизмом клинических симптомов, выраженной цикличностью течения со сменой начального периода, периода разгара и реконвалесценции (с обострениями и рецидивами или без них).
Продолжительность инкубационного периода колеблется от 3 до 18 дней. Заболевание начинается остро без выраженного продрома. Температура тела быстро повышается до 38— 40 °С. Больные жалуются на общую слабость, недомогание, головную боль, мышечные и суставные боли, бессонницу, снижение или потерю аппетита. В начале заболевания могут быть насморк, першение, изредка боли в горле при глотании, небольшой кашель. На фоне симптомов интоксикации закономерно появляются диспепсические симптомы — тошнота, рвота, иногда расстройство стула, умеренные боли в животе.
При осмотре обращает на себя внимание несколько одутловатое лицо. Часто появляются симптомы «капюшона» (гиперемия лица и шеи), «перчаток» и «носков» (ограниченная гиперемия кистей и стоп) (рис. 16 а, б; см. цв. вклейку). Кожа сухая и горячая. Наблюдаются покраснение конъюнктив, инъекция сосудов склер, нередко бледный носогубный треугольник. Слизистые оболочки ротоглотки гиперемированы и отечны. Язык обложен белым налетом. Продолжительность начального периода 1 —5 дней.
В разгар заболевания сохраняется высокая температура тела, более выраженными становятся симптомы интоксикации, возникают признаки поражения внутренних органов. Одним из кардинальных симптомов псевдотуберкулеза является экзантема. Она появляется на I—6-й (чаще 2—4-й) день болезни. Сыпь точечная, напоминает скарлатинозную, цвет ее от бледно-розового до ярко-красного, иногда иктеричного — при вовлечении печени в патологический процесс. Фон кожи обычно нормальный, нередко наряду со скарлатиноподобны-ми элементами наблюдаются более крупные розеолезные, мелкопятнистые высыпания, возможно появление пятнисто-папулезных элементов. Сыпь локализуется симметрично на боковых поверхностях туловища, в аксиллярных областях, на коже нижних и верхних конечностей, преимущественно на сгибательной поверхности. Сгущение сыпи отмечается в естественных складках кожи и вокруг крупных суставов. Лицо, как правило, остается свободным от сыпи. В тяжелых случаях отдельные элементы или вся сыпь приобретают геморрагический характер. Сыпь держится 1—7 дней.
В период разгара у больных выявляются белый дермографизм, положительные симптомы Румпеля—Кончаловского— Лееде, Мозера, Пастия, усиливается гиперемия слизистых оболочек зева. Иногда на мягком небе определяется точечная энантема (рис. 16 в; см. цв. вклейку). При обследовании выявляется микролимфополиаденит. Большинство больных жалуются на боли в суставах, которые могут ограничивать их передвижение, а со 2-й недели может развиться инфекционно-аллергический артрит (моно- или поли-) с вовлечением в патологический процесс преимущественно крупных суставов (коленных, голеностопных). В ряде случаев в этот период возникает узловатая эритема, причем элементы сыпи локализуются не только на голенях, но возможно появление узловатой эритемы на верхних конечностях, коже туловища, что сопровождается болевыми ощущениями.
Нарушения деятельности сердечно-сосудистой системы проявляются тахикардией, реже — относительной брадикарди-ей. Артериальное давление умеренно снижено. При аускульта-ции сердца отмечаются приглушение тонов, систолический шум на верхушке.
Изменения функции пищеварительной системы характеризуются в этот период анорексией, тошнотой, иногда рвотой. Язык к 5-му дню болезни очищается от налета и становится ярко-красным с крупными сосочками — «малиновым». При пальпации живота отмечаются болезненность и урчание в илеоцекальной области. Часто определяется притупление перкуторного звука в правой подвздошной области, иногда могут прощупываться увеличенные и болезненные мезентериальные лимфатические узлы. Практически у всех больных определяются увеличенные печень и селезенка.
В периферической крови имеются значительные изменения. Характерен лейкоцитоз 10,0—30,0 х 109/л, нередко выше, нейтрофилез, палочкоядерный сдвиг, увеличение СОЭ до 20— 55 мм/ч, у части больных — эозинофилия.
На высоте клинических проявлений развивается симпто-мокомплекс инфекционно-токсической почки: протеинурия, микрогематурия, цилиндрурия. Иногда наблюдается и лейко-цитурия, однако эти изменения быстро исчезают по мере купирования синдрома интоксикации.
В особо тяжелых случаях у больных определяются явления менингизма, а иногда и симптомы серозного менингита, что может быть обусловлено ассоциированными инфекциями (вирусными). Гнойный менингит может быть проявлением септической формы заболевания.
Период разгара обычно продолжается 5—7 дней. Однако у '/з больных течение заболевания осложняется развитием обострений и рецидивов (чаще один, реже 2—3 и более). Рецидивы и обострения характеризуются повторной волной лихорадки и симптоматики локальных поражений. Нередко бывают боли в животе, артралгии, изменение цвета мочи (холурия). Возникает экзантема, носящая преимущественно аллергический характер (макулопапулезная, уртикарная, типа узловатой эритемы). Течение рецидивов, как правило, легче, чем основного заболевания.
В период реконвалесценции температура тела снижается до нормальной, симптомы интоксикации исчезают, нормализуются функции внутренних органов. У значительной части больных со 2—3-й недели болезни появляется отрубевидное шелушение кожи на туловище, лице и шее и более грубое пластинчатое или листовидное — на ладонях и стопах.
Общепринятой клинической классификации псевдотуберкулеза нет. Патогенетически обосновано выделение локализованной и генерализованной форм болезни. К локализованной относят интестинальную форму (гастроэнтерит, реже энтероколит), мезентериальный лимфаденит (мезаденит), терминальный илеит, гепатит. Генерализованная форма может изредка протекать с формированием вторичных очагов — септицемия (псевдотуберкулезный сепсис).
Удобной в практике остается клиническая классификация псевдотуберкулеза с обозначением ведущего симптомоком-плекса. Выделяют следующие клинические формы: абдоминальную, экзантемную (скарлатиноподобную), артралгиче-скую, желтушную, катаральную, смешанную. Стертые и субклинические формы, а также катаральная, как правило, регистрируются в эпидемических очагах инфекции при лабораторном обследовании коллективов, имеющих, например, общий пищеблок.
При абдоминальной форме псевдотуберкулеза преобладают симптомы поражения желудочно-кишечного тракта: признаки острого гастроэнтерита, энтероколита, гастроэнтероколита. Для этой формы характерен болевой синдром с локализацией болей преимущественно в правой половине живота, а также синдром диареи. Последний умеренно выражен. Стул у большинства больных не содержит патологических примесей с частотой не более 5—7 раз в сутки и лишь иногда (при вовлечении в патологический процесс толстой кишки) в стуле появляется примесь слизи. Продолжительность заболевания при этом варианте обычно не превышает 1 нед.
Сравнительно редко абдоминальная форма псевдотуберкулеза протекает в виде острого терминального илеита, мезаде-нита или аппендицита, при этом больные зачастую подвергаются оперативному вмешательству.
Острый терминальный илеит обычно проявляется симптомами интоксикации, повышением температуры тела до 38— 39 °С, довольно интенсивными, иногда до колик, болями в илеоцекальной области и диареей. Характерно наличие двух типов болей: схваткообразных и в промежутках между ними — постоянных. На рентгенограмме на протяжении 10—20 см пораженная часть подвздошной кишки определяется резко суженной и со сглаженным рельефом слизистой оболочки («симптом шнура»). Эта форма псевдотуберкулеза имеет склонность к длительному, рецидивирующему течению. Предполагается возможная связь этого варианта псевдотуберкулеза с развитием хронического гранулематозно-язвенного поражения подвздошной кишки — болезнью Крона.
Псевдотуберкулезный мезаденит, как правило, характеризуется острым началом, постоянными и схваткообразными болями в правой подвздошной области продолжительностью от нескольких часов до нескольких дней. Наряду с этим отмечаются повышение температуры тела до 38 °С, тошнота, рвота, стул до 3—5 раз в сутки. В дальнейшем у значительной части больных наблюдаются медленное (в течение 3—4 дней) развитие пери-тонеальной симптоматики и образование болезненного уплотнения — «инфильтрата» в илеоцекальной области, представляющего собой группу увеличенных мезентериальных узлов. При осмотре выявляются такие признаки мезаденита, как болезненность при пальпации брыжейки (симптом Штернберга), у наружного края правой прямой мышцы живота на 24 см ниже пупка (симптом Мак—Фэддена), притупление перкуторного звука в подвздошных областях (симптом Падалки).
Клиническая картина псевдотуберкулезного аппендицита очень напоминает симптоматологию мезаденита и характеризуется более быстрым темпом развития симптомов раздражения брюшины.
Всем вариантам абдоминальной формы псевдотуберкулеза свойственна наряду с интоксикацией и внекишечная симптоматика, обусловленная токсико-аллергическим синдромом: артралгии, экзантема, инъекция сосудов склер и конъюнктив, гиперемия мягкого неба, «малиновый» язык, что имеет существенное значение в распознавании инфекции. При абдоминальной форме часто развиваются обострения и рецидивы, заболевание приобретает затяжное течение.
Экзантемная форма характеризуется лихорадкой, скарлати-ноподобной сыпью, синдромом интоксикации. При этой форме рецидивы встречаются редко.
Артралгическая форма проявляется развитием артралгии или полиартрита на фоне интоксикации и высокой лихорадки. Нередко имеются и другие признаки псевдотуберкулеза (сыпь, поражение печени, кишечника), но симптомы со стороны опорно-двигательного аппарата преобладают и доминируют в клинической картине.
Желтушная форма характеризуется клиническими признаками реактивного гепатита (токсического и токсико-аллерги-ческого происхождения). Появляются желтуха, гипербилиру-бинемия и гипертрансфераземия, холурия и ахолия. Достигнув максимума в разгар болезни (обычно на высоте лихорадки) желтуха затем быстро угасает, биохимические пробы нормализуются.
При катаральной форме наблюдается поражение преимущественно слизистых оболочек верхних дыхательных путей. Это проявляется ринитом, фарингитом, трахеитом, бронхитом. Температура тела субфебрильная, сыпь встречается редко. Клиническая диагностика этой формы трудна.
Иногда в течении псевдотуберкулезной инфекции манифестируют симптомы двух клинических форм, например абдоминальной и артралгической, желтушной и абдоминальной и т. д. В таких случаях принято говорить о смешанной форме псевдотуберкулеза.
Генерализованная форма отличается тяжелым течением, характеризующимся высокой температурой тела, выраженностью интоксикации, наличием экзантемы и поражением ряда органов. Септическая форма чаще наблюдается у лиц со значительно сниженной общей реактивностью организма, нередко пожилого возраста, страдающих хроническими заболеваниями печени, сахарным диабетом, болезнями крови, алкоголизмом. Течение септической формы длительное, рецидивирующее, с формированием множественных гнойных поражений внутренних органов, высокой летальностью.
Тяжесть течения псевдотуберкулеза определяется выраженностью интоксикации и степенью вовлечения в патологический процесс внутренних органов. Выделяют легкие, средней тяжести и тяжелые формы.
При всех формах псевдотуберкулеза продолжительность заболевания обычно не превышает 1,5 мес. Однако иногда встречается затяжное течение болезни (1,5—3 мес) и в редких случаях повторные рецидивы значительно увеличивают продолжительность заболевания до 6 мес и более. Инфекция не имеет хронической формы, однако описаны хронические заболевания опорно-двигательного аппарата и желудочно-кишечного тракта, этиологически связанные с псевдотуберкулезом, которые можно расценивать как клинические проявления последствий заболевания (или его резидуальную фазу).
Осложнения заболевания встречаются при разных формах, могут быть обусловлены токсико-аллергическими реакциями (острый миокардит) или связаны с характером патологического процесса при отдельных формах (например, при абдоминальной — перитонит).
Прогноз обычно благоприятный. Исключение составляет лишь септическая форма, при которой прогноз всегда серьезный.
Диагностика. Выявление у больных достаточно демонстративных клинических признаков, сочетание симптомов поражения желудочно-кишечного тракта и внекишечных проявлений, наличие данных эпидемиологического анамнеза позволяют заподозрить псевдотуберкулез. В установлении окончательного диагноза решающую роль играют лабораторные методы исследования — бактериологический и серологический.
Основными материалами для бактериологического исследования служат кровь, фекалии и реже рвотные массы. Для диагностики катаральной формы исследуют смывы из зева. Пользуются методикой Петерсона и Кука (1963), основанной на способности бактерий расти при пониженной температуре в среде подращивания (стандартный фосфатно-буферный раствор, среда Серова).
В серологической диагностике псевдотуберкулеза используют РА и РИГА. Исследуют парные сыворотки больных, взятые в начале и на 3-й неделе болезни. Диагностическим при постановке РА считается титр 1:200 и более, при РИГА — 1:100. Наиболее диагностически ценным является нарастание титра специфических антител в сыворотке крови в динамике.
В экспресс-диагностике псевдотуберкулеза для обнаружения антигена в крови, фекалиях, слюне в первые дни заболевания могут быть использованы ИФА, НРИФ, РКА (реакция коагг-лютинации). Имеется опыт применения ПЦР-диагностики.
В диагностике имеет также значение гистологическое исследование биоптатов лимфатических узлов и других органов, полученных в процессе оперативного вмешательства, при этом на бактериологическое исследование (посевы) могут быть направлены удаленный червеобразный отросток и ме-зентериальные лимфатические узлы.
Дифференциальная диагностика. Зависит от клинического варианта болезни. Необходимо исключить скарлатину, острые кишечные инфекции, иерсиниоз, аппендицит и другие хирургические заболевания брюшной полости; ревматизм, полиартрит, вирусный гепатит, инфекционный мононуклеоз, тифо-паратифозные заболевания, сепсис и др.
Лечение. В комплексной терапии псевдотуберкулеза ведущая роль принадлежит этиотропным средствам. Наибольший клинический эффект отмечен при лечении больных левоми-цетином (хлорамфениколом). Препарат назначают в обычной терапевтической дозе (0,5 г 4 раза в сутки) в течение 2 нед. Двухнедельный курс антибактериальной терапии продиктован необходимостью профилактики рецидивов инфекции. Установлена эффективность аминогликозидов (гентамицин 240 мг/сут внутримышечно). При тяжелых формах и особенно повторных курса лечения (при рецидивах) назначают фторхино-лоны (ципрофлоксацин 0,5 г 2 раза в сутки; офлоксацин 0,4 г 2 раза в сутки в течение 10 дней). При генерализованных формах применяют парентерально цефалоспорины (цефазолин, кефзол по 1,0 г 4—6 раз в сутки внутримышечно или внутривенно) и фторхинолоны (ципрофлоксацин по 0,2—0,4 г 2 раза в сутки внутривенно) в течение 10 дней.
В случае выраженной интоксикации обосновано использование дезинтоксикационных средств (полиионные растворы, реополиглюкин, гемодез и др.), при тяжелом течении применяют глюкокортикостероиды.
Всем больным с учетом аллергического компонента в патогенезе заболевания показаны десенсибилизирующие и анти-гистаминные средства.
В связи с возможностью обострения и рецидивов при псевдотуберкулезе показано применение нестероидных анаболиков (пентоксил, метилурацил, калия оротат), поливитаминов и иммуномодуляторов (цитомединов).
При выраженных артралгиях и артритах назначают нестероидные противовоспалительные препараты (индометацин, бруфен, диклофенак, найз и др.).
Особое место занимает хирургическое лечение больных псевдотуберкулезом. Больные с аппендицитом, мезаденитом или терминальным илеитом нуждаются в наблюдении хирурга, который и определяет показания к операции. До операции и после нее в полном объеме проводится этиотропная и патогенетическая терапия.
Профилактика. В системе профилактических мероприятий при псевдотуберкулезе большое значение имеет борьба с источником и резервуаром инфекции — грызунами.
Мероприятия, направленные на пути распространения инфекции, включают постоянный санитарный надзор за питанием и водоснабжением, контроль за технологическим режимом обработки и хранения пищевых продуктов, особенно не подвергающихся термической обработке.
Меры специфической профилактики не разработаны.
ИЕРСИНИОЗ КИШЕЧНЫЙ
Син. — иерсиниоз
Иерсиниоз (Yersiniosis) — острое инфекционное заболевание, характеризующееся преимущественным поражением желудочно-кишечного тракта и выраженной токсико-ал-лергической симптоматикой.
Исторические сведения. Первые сведения о возбудителе иерси-ниоза получены в США, где с 1923 по 1957 г. было выделено от человека около 15 штаммов бактерий, классифицированных в то время как атипичные варианты псевдотуберкулезного микроба. Основоположниками изучения возбудителей иерсиниоза являются Дж. Шлейфстейн и М. Колеман, описавшие их в 1939 г. под названием «неидентифицированные микроорганизмы». В дальнейшем название бактерий неоднократно менялось, пока не утвердилось современное наименование Yersinia enterocolitica.
С конца 60-х годов наблюдается широкое распространение забот леваний животных и человека, вызываемых Y. enterocolitica. По данным ВОЗ, в 1966 г. в мире было описано только 23 случая иерсиниоза у человека. В настоящее время эта инфекция постоянно регистрируется во многих странах Европы, Америки, Азии и Африки.
Этиология. Возбудитель иерсиниоза относится к семейству кишечных бактерий Enterobacteriaceae, роду Yersinia. Иерсинии представляют собой грамотрицательные палочки размером (1,8—2,7) х х (0,7—0,9) мкм. Они растут как на обычных, так и на обедненных питательными веществами средах. Биохимическая активность у возбудителя иерсиниоза выше, чем у псевдотуберкулезной бактерии, различают пять его биохимических вариантов.
Возбудитель иерсиниоза содержит О- и Н-антигены. Различия в строении О-антигенов позволили выделить более 50 сероваров иерсинии. Наибольшее значение в патологии человека имеют 01; 03; 05; 08; 09 серовары.
При разрушении бактериальных клеток выделяется эндотоксин. Большинство штаммов Y. enterocolitica имеют выраженную способность к адгезии, что обеспечивает массивную колонизацию на поверхности кишечного эпителия. Важной отличительной особенностью возбудителя иерсиниоза от псевботуберкулезных бактерий является энтеротоксигенность, сопровождающаяся продукцией большого количества термостабильного энтеротоксина. Иерсинии обладают также способностью к инвазии и внутриклеточному размножению, однако инвазивные свойства выражены у них в значительно меньшей степени, чем у псевдотуберкулезной бактерии.
Подобно возбудителям псевдотуберкулеза, иерсинии относятся к психрофилам. При температуре холодильника (от 4 до 8 °С) они способны сохраняться и размножаться на овощах, корнеплодах и других пищевых продуктах. При кипячении погибают через несколько секунд. Чувствительны к действию обычных дезинфектантов.
Эпидемиология. Возбудитель иерсиниоза широко распространен в природе. Его обнаруживают в почве, воде, выделяют из организма многих видов животных. Однако основным резервуаром возбудителя в природе являются мелкие грызуны, которые, обсеменяя различные объекты внешней среды, пищевые продукты, воду, способствуют распространению инфекции среди других животных. Резервуаром иерсинии служит также почва, что объясняется наличием у них сапрофитных свойств. На этом основании заболевание может быть отнесено к сапрозоонозам.
Основным источником инфекции для человека являются сельскохозяйственные (свиньи, крупный рогатый скот, овцы, козы, олени и др.), реже — домашние животные и синантропные грызуны. Больной человек и бактериовыделитель как источники инфекции имеют несравненно меньшее значение.
Механизм передачи инфекции — фекально-оральный, основной путь распространения, как и при псевдотуберкулезе, пищевой. Факторами передачи иерсинии чаще всего являются мясные продукты, молоко, овощи. Это могут быть мясо и молоко больных животных. Инфицирование продуктов питания может произойти на этапе приготовления или хранения, в частности в условиях холодильника. Другие пути передачи инфекции возможны, но имеют существенно меньшее значение. Водный путь может быть реализован при употреблении воды из открытых источников. Возможен контактно-бытовой путь передачи инфекции при уходе за больными животными (например, свиньями). Передача инфекции от человека происходит в исключительных случаях при тесном общении (мать—ребенок, дети в одной семье) и при внутрибольничном распространении.
Заболевание встречается во всех возрастных группах, но чаще у детей первых лет жизни. В сельской местности в промышленных животноводческих хозяйствах могут формироваться очаги иерсиниоза. Сезонный подъем заболеваемости отмечается в холодное время года с пиком в ноябре. В некоторых регионах наблюдается два сезонных подъема — осенью и весной. Иерсиниоз протекает в виде спорадических И групповых заболеваний.
Патогенез и патологоанатомическая картина. Проникнув в организм через рот, иерсинии попадают в желудок, где частично погибают под действием кислой среды. Освободившиеся при разрушении бактерий эндотоксины приводят к развитию острого гастрита. Иерсинии, преодолевшие защитный барьер желудка, колонизируют слизистую оболочку тонкого отдела кишечника, внедряются в слизистую оболочку подвздошной кишки и ее лимфоидные образования. Действие эн-теротоксинов обеспечивает активацию ферментных систем энтероцитов, повышение секреции жидкости и солей в просвет кишки, что сопровождается развитием диареи — ключевого синдрома кишечного иерсиниоза. В месте входных ворот инфекции развивается различной выраженности воспалительный процесс (энтерит). В подавляющем большинстве случаев инфекция ограничивается этой фазой и быстро завершается элиминацией возбудителя из кишечника.
Возможно проникновение иерсинии по лимфати ческим сосудам в мезентериальные лимфатические узлы, где они размножаются, накапливаются и вызывают воспаление — мезаде-нит. Сохранение в лимфатических узлах возбудителя способствует сенсибилизации к нему организма. В патологический процесс могут быть вовлечены червеобразный отросток и слепая кишка.
Продукты жизнедеятельности микробов и эндотоксины обеспечивают развитие синдрома интоксикации.
На фоне изменений в кишечнике и лимфатическом аппарате развиваются токсический и аллергический процессы, что определяет возникновение внекишечных проявлений заболевания, таких же, как при псевдотуберкулезе.
В случае прорыва лимфатического барьера кишечника возникает бактериемия, обусловливающая развитие генерализованных септических форм заболевания. Иммунопатологические реакции у части больных иерсиниозом могут приводить к развитию системных заболеваний.
Иммунитет при иерсиниозе, так же как и при псевдотуберкулезе, характеризуется на ранних этапах развития инфекции незавершенным фагоцитозом, гуморальный ответ обычно формируется медленно и не является достаточно прочным, с чем связано длительное персистирование возбудителя в организме, нередкое развитие обострений и рецидивов болезни, возможность хронизации инфекции.
Данные о патоморфологических изменениях при иерсиниозе получены при оперативных вмешательствах и аутопсии у лиц, умерших от тяжелых форм заболевания. Характерны гиперемия и гиперплазия мезентериальных лимфатических узлов с явлениями абсцедирующего ретикулоцитарного лимфаденита, уплотнение брыжейки, четко отграниченное воспаление в дистальном отделе тонкой кишки протяженностью 15—100 см, иногда встречаются язвенно-некротические изменения слизистой оболочки червеобразного отростка, а также воспалительная реакция всех его слоев от катаральной до флегмонозной формы.
При тяжелых генерализованных формах отмечаются геморрагический отек и некроз слизистой оболочки подвздошной кишки, в брыжейке — увеличенные, гиперемированные лимфатические узлы, в печени и селезенке — множественные мелкие некротические очаги или абсцессы, из содержимого которых выделяются иерсинии.
Клиническая картина. Продолжительность инкубационного периода колеблется от 1 до 6 дней, иногда составляет 15 ч. Иерсиниоз характеризуется полиморфизмом клинических проявлений. Наиболее часто встречается гастроинтестиналь-ная форма заболевания с поражением желудочно-кишечного тракта и развитием острого энтерита, гастроэнтерита, гастро-энтероколита в сочетании с синдромом интоксикации.
Заболевание начинается остро с озноба и повышения температуры тела до 38—39 °С. Больных беспокоят головная боль, общая слабость, миалгии и артралгии. Одновременно с интоксикационным синдромом возникают тошнота, у части больных — рвота, боли в животе, которые имеют схваткообразный или постоянный характер. Боли локализуются в эпигастрии, вокруг пупка, в правой подвздошной области, иногда в правом подреберье. Характерен обильный жидкий стул, вязкий, иногда пенистый, с резким неприятным запахом. У некоторых больных при вовлечении в патологический процесс толстой кишки в стуле обнаруживается примесь слизи, редко — крови. Частота стула от 2—3 до 15 раз в сутки. Часто выявляются
«урчание» и «плеск» в правой подвздошной области. В большинстве случаев продолжительность заболевания невелика, колеблется от 2 до 7, реже — 15 сут.
Наряду с доброкачественным течением встречаются тяжелые формы болезни с резко выраженной интоксикацией вследствие выраженного гастроэнтерита — обезвоживанием и нарушением минерального обмена (сухость кожи и слизистых оболочек, снижение тургора кожи, судороги, снижение артериального давления).
На фоне энтерита и интоксикации возможно появление другой абдоминальной симптоматики. Абдоминальная форма представлена острым терминальным илеитом, мезаденитом и аппендицитом, которые существенно не отличаются от течения соответствующих вариантов псевдотуберкулезной инфекции.
Наряду с признаками поражения желудочно-кишечного тракта при иерсиниозе развивается внекишечная токсико-ал-лергическая симптоматика, сходная с псевдотуберкулезом (экзантема, полиартрит, гепатит).
При объективном обследовании в 1-ю неделю заболевания кожа больных нормальной окраски или несколько бледная. У некоторых из них обнаруживается точечная или мелкопятнистая сыпь на симметричных участках кожи туловища и конечностей, которая исчезает в срок от нескольких часов до 3—4 сут (рис. 17; см. цв. вклейку). Возможно развитие симптомов «капюшона», «перчаток» и «носков», как при псевдотуберкулезе. Нередко отмечаются покраснение конъюнктив, инъекция сосудов склер. Слизистая оболочка ротоглотки диффузно гиперемирована. При пальпации находят умеренно увеличенные и болезненные периферические лимфатические узлы. Определяются лабильность и учащение пульса, соответствующее температуре тела. Артериальное давление несколько снижено.
Язык, обложенный в первые дни болезни белым налетом, часто к 5—7-му дню очищается и становится «малиновым». При пальпации живота отмечаются болезненность и урчание в илеоцекальной области, с меньшим постоянством в эпи- и мезогастрии. Выявляются положительные симптомы Падалки, Штернберга. У больных с пониженным питанием можно прощупать увеличенные и болезненные мезентериальные лимфатические узлы. В патологический процесс может вовлекаться печень. Она увеличивается, становится доступной для пальпации к концу 1-й недели заболевания. У некоторых больных поражение паренхимы печени приводит к появлению желтухи склер, кожи и слизистых оболочек вследствие гипербилируби-немии. Иерсиниозный гепатит сопровождается умеренно выраженной гипертрансфераземией, отличается быстрым купированием клинико-лабораторных проявлений. Иногда определяется незначительное увеличение селезенки.
В случаях тяжелого течения заболевания кратковременно регистрируется симптомокомплекс «инфекционно-токсиче-ской почки».
В периферической крови наблюдаются лейкоцитоз, ней-трофилез, палочкоядерный сдвиг, увеличение СОЭ, иногда — эозинофилия.
У части больных на 2—3-й неделе болезни развиваются симптомы, свидетельствующие об иммуноаллергической перестройке в организме. В этот период нередко появляются урти-карные, макулезные, макулопапулезные высыпания с локализацией на туловище и конечностях, чаще в области крупных суставов; узловатая эритема. У некоторых больных развивается инфекционно-аллергический полиартрит: в процесс вовлекаются 2—4 сустава, отмечаются боли, отечность, покраснение, повышение температуры в области пораженных суставов, нарушение их функции. Иерсиниозный полиартрит отличается склонностью к рецидивирующему течению.
Иногда в этот период заболевания выявляются миокардит, нефрит, уретрит, цистит, конъюнктивит, иридоциклит, синдром Рейтера и другие поражения внутренних органов.
Течение иерсиниоза часто осложняют обострения и рецидивы. Они встречаются у '/з больных и характеризуются повторной волной лихорадки и симптомами поражения желудочно-кишечного тракта в сочетании с внеабдоминальными проявлениями, типичными для периода разгара.
В период реконвалесценции температура тела снижается до нормальной, симптомы интоксикации исчезают, нормализуются функции внутренних органов. У некоторых больных со 2—3-й недели болезни появляется отрубевидное шелушение кожи на туловище, лице и шее и пластинчатое — на ладонях и стопах.
Общепринятой клинической классификации иерсиниоза нет. Выделяют локализованные и генерализованные формы. По наибольшей выраженности того или иного клинического синдрома различают гастроинтестинальную, абдоминальную (аппендикулярную) и генерализованную (вторично-очаговую, септическую) формы, бактериовыделение.
По тяжести выделяют легкое, средней тяжести и тяжелое течение, что определяется выраженностью интоксикационного синдрома и степенью вовлечения в патологический процесс внутренних органов. Чаще заболевание протекает в легкой и среднетяжелой формах.
При всех формах манифестного течения иерсиниозной инфекции продолжительность заболевания обычно не превышает 1,5 мес. Однако иногда встречается затяжное течение болезни (1,5—3 мес) и в редких случаях — более 3—6 мес (хроническое). Наличие хронических заболеваний желудочно-кишечного тракта, соединительной ткани, этиологически связанньгх с перенесенным иерсиниозом, расценивается как клиническая картина последствий иерсиниоза (резидуальная фаза).
Наиболее тяжелое течение и прогноз имеет генерализованная (септическая) форма иерсиниоза, развивающаяся при выраженной иммунодепрессии, чаще у пожилых людей и детей раннего возраста. Заболевание начинается остро. Температура тела повышается до 39—40 °С. Отмечаются головная боль, слабость, адинамия, тошнота, рвота, диарея. Лихорадка ремитти-рующего или неправильного типа сопровождается потрясающим ознобом и профузным потом. Нередко выявляется желтуха кожных покровов. На коже часто наблюдается розеолез-ная, макулопапулезная или геморрагическая сыпь. Во всех случаях септической формы выявляется гепатоспленомегалия. В периферической крови отмечаются анемия, нейтрофильный лейкоцитоз, значительное повышение СОЭ. Течение болезни нередко имеет неблагоприятный исход.
Бактериовыделение характеризуется отсутствием клинических симптомов болезни при наличии выделения иерсинии из испражнений. Бактериовыделение может быть как кратковременным (острым), так и длительным (хроническим) — в течение нескольких месяцев. Бактериовыделители иерсинии выявляются активно при лабораторном обследовании работников пищевых предприятий и в эпидемических очагах.
Прогноз. В большинстве случаев, за исключением септической формы, благоприятный.
Диагностика. Из клинических признаков наибольшее диагностическое значение имеет сочетание синдрома поражения желудочно-кишечного тракта и «внекишечной», токсико-ал-лергической симптоматики. Большое значение в распознавании иерсиниоза имеют данные эпидемиологического анамнеза, особенно при групповом характере заболеваемости. Однако решающим в установлении окончательного диагноза являются специфические методы диагностики — бактериологический и серологический.
Основными материалами для бактериологического исследования служат испражнения и кровь. Используют метод подращивания на питательных средах при низких температурах с последующим выделением культуры Y. enterocolitica. Возбудитель иерсиниоза может быть обнаружен также в цереброспинальной жидкости, резецированных во время операции лимфатических узлах и червеобразном отростке.
Серологическая диагностика имеет большое значение для подтверждения клинического диагноза. Она осуществляется с помощью РА и РНГА методом парных сывороток. Исследуют сыворотки, взятые в начале и на 3-й неделе болезни. Диагностическим для РА считается титр 1:80 и выше, а для РНГА — 1:160 и выше.
В экспресс-диагностике иерсиниоза используются РНГА с антительными диагностикумами, а также РКА, ИФА, НРИФ — методы выявления антигена-возбудителя. Разработана ПЦР-диагностика.
Определенное значение в диагностике имеет также гистологическое исследование биоптатов лимфатических узлов и других органов.
Дифференциальная диагностика. Определяется клиническим вариантом болезни. Наиболее часто возникает необходимость дифференцировать это заболевание от псевдотуберкулеза, других острых кишечных инфекций (пищевых токсико-инфекций, сальмонеллеза), аппендицита, инфекционного полиартрита, ревматизма, вирусного гепатита, сепсиса иной этиологии и др.
Лечение. В качестве этиотропных средств применяют антибиотики, сульфаниламидные и химиопрепараты. Из антибиотиков наиболее эффективны левомицетин (по 0,5 г 4 раза в сутки), тетрациклины, аминогликозиды, фторхинолоны, при тяжелых формах — цефалоспорины. Из сульфаниламидных препаратов чаще других используют бисептол, из антисептиков — нитрофурановые (по 0,1 г 4 раза в день). Продолжительность этиотропной терапии зависит от формы заболевания, обычно составляет 7—14 дней, при генерализованных формах — не менее 14 дней. При генерализованной форме антибактериальная терапия проводится как при генерализованной форме псевдотуберкулеза.
Патогенетическая терапия включает средства дезинтоксикации и регидратации (при гастроинтестинальных формах). Для купирования внекишечных проявлений используют терапевтические средства, как при псевдотуберкулезе. По показаниям (острый аппендицит) проводятся оперативные вмешательства.
Профилактика. Осуществляется комплекс мероприятий, аналогичных тем, которые проводятся при псевдотуберкулезе и сальмонеллезе.
КАМПИЛОБАКТЕРИОЗ
Син. — вибриоз
Кампилобактериоз (Campylobacteriosis) — острое инфекционное зоонозное заболевание, характеризующиеся синдромом общей интоксикации, преимущественным поражением желудочно-кишечного тракта и возможностью генерализации патологического процесса.
Исторические сведения. Бактерии, относящиеся к роду Campylobacter, впервые идентифицированы в 1909 г. и были известны как причина заболевания домашних животных, сопровождающегося выкидышами. Впервые эти микроорганизмы были выделены от людей Р. Винцентом и др. в 1947 г., с 1972 г. описаны случаи диареи и бактериемии у детей, обусловленные кампилобактериями. В последние годы в результате специальных исследований по обнаружению кам-пилобактерий установлено их важное значение как этиологического фактора диарейньгх заболеваний у детей.
Этиология. Род кампилобактерий включает три вида, из которых Campylobacter fetus и его подвиды (fetus, intestinalis, jejuni) выделяют от человека. Основной причиной заболевания людей служат бактерии группы С. jejuni (С. jejuni, С. coli, С. laridis), реже — С. fetus fetus.
Campylobacter (от гр. campilo — изогнутый, bacter — палочка) — грамотрицательная изогнутая палочка длиной 1,5—8 мкм, шириной 0,2—0,5 мкм. Спор не образует, подвижна, имеет один или два жгутика. Для роста кампилобактерий требуются пониженная концентрация кислорода и повышенное содержание углекислого газа в окружающей среде. Все кампилобактерий растут при температуре 37 "С и рН 7,0; С. jejuni термофильны, оптимальная температура для их роста 42 °С. Лабораторная диагностика требует наличия вакуумных термостатов или микроанаэростатов. Для выделения и культивирования возбудителей необходимы селективные питательные среды, основой для которых служат желево-эритритный кровяной агар, среда Мюллера—Хинтона, бруцеллезный агар, кровяные агары различных форм.
Кампилобактерий — оксидоположительные, не окисляют и не ферментируют углеводы, не разжижают желатин, дают отрицательные реакции с метиловым красным и Фогеса—Проскауэра.
По термостабильному О-антигену и термолабильному Н-антигену С. jejuni делится на десятки биоваров. Кампилобактерий имеют общие антигены с возбудителями бруцеллеза и иерсиниоза.
Важное значение имеет способность некоторых штаммов кампилобактерий продуцировать энтеротоксин.
Возбудители устойчивы во внешней среде, при температуре 4°С могут сохраняться в почве, воде, молоке в течение нескольких недель, в замороженном мясе кампилобактерий остаются жизнеспособными несколько месяцев. Возбудители чувствительны к высушиванию и воздействию солнечного света. Кипячение и хлорирование воды полностью избавляют ее от кампилобактерий.
К этиологии кампилобактериозов не имеет отношения описанный ранее вид Campilobacter pylory, выделенный из желудка человека. В связи с обнаруженинными особыми биологическими свойствами и морфологическими признаками Campilobacter pylory выделен из рода кампилобактерий и отнесен к Helicobacter pylory. Большинством исследователей Helicobacter pylory признается как предрасполагающий фактор развития гастрита, дуоденита и язвенной болезни.
Эпидемиология. Основным резервуаром кампилобактерий и источником инфекции для человека служат животные и птицы, преимущественно домашние и сельскохозяйственные (кролики, свиньи, коровы, козы, овцы, утки, могут быть собаки и кошки), незначительную роль играют мелкие грызуны, дикие животные.
Заражение животных ведет либо к их гибели, либо к длительному носительству, при котором они инфицируют через выделения почву и воду. При убое таких животных происходит инфицирование мяса из кишечного содержимого. Возможно попадание возбудителя в молоко при кампилобактериозном мастите у коров.
Передача возбудителя от человека к человеку происходит редко, в случаях заражения детей раннего возраста от взрослых.
Фекально-оральный механизм передачи инфекции реализуется преимущественно алиментарным путем. Заражение происходит при употреблении в пищу инфицированных мясных и молочных продуктов без достаточной термической обработки, а также овощей и фруктов.
Возможен водный путь передачи инфекции. Известны случаи инфицирования кампилобактериями при контакте с больными животными, особенно при наличии у них диареи.
У беременных возможна трансплацентарная передача инфекции.
К кампилобактериозу восприимчивы все возрастные группы, однако преимущественно болеют дети до 10 лет, включая новорожденных.
Лица, имеющие постоянный (профессиональный) контакт с сельскохозяйственными животными, подвергаются повышенному риску инфицирования кампилобактериями. Высокая восприимчивость к кампилобактериозу отличает лиц с ослабленной резистентностью, иммунодефицитными состояниями, тяжелой сопутствующей патологией (алкоголизм, наркомания, сердечно-сосудистые заболевания, сахарный диабет, злокачественные новообразования), а также после гастрэктомии, лечения иммунодепрессантами.
Постинфекционный иммунитет мало изучен.
Заболевания регистрируется в виде спорадических случаев, небольших и реже — эпидемических вспышек.
Географическое распространение кампилобактериоза очень широко, он встречается на всех континентах, что связано с интенсификацией животноводства, возросшей международной торговлей животными, кормами, продуктами животного происхождения, ростом урбанизации.
Патогенез и патологоаиатомическая картина. Изучены мало. Возбудитель попадает в организм человека через рот с инфицированными продуктами и водой. Развитие вариантов течения заболевания определяется состоянием резистентности макроорганизма к инфекции. У лиц с нормальной реактивностью организма заражение может не сопровождаться клиническими проявлениями и ограничивается субклинической формой с бактериовыделением. В желудочно-кишечном тракте, преимущественно в тонкой (тощей) ки шке и реже в толстой, в месте входных ворот инфекции возникают воспалительные изменения слизистой оболочки. Выраженные адгезивные свойства позволяют кампилобактериям быстро колонизировать слизистую оболочку, а инвазивные свойства и выделение энтеротоксина приводят к развитию воспаления.
При большой инфицирующей дозе и, главное, ослабленном организме развивается фаза бактериемии с диссеминаци-ей возбудителя в различные органы и ткани. Сепсис сопровождается образованием вторичных очагов в сердце, ЦНС, легких, печени, мягких мозговых оболочках и др.
У беременных при бактериемии возбудитель проникает через плаценту, что приводит к аборту, преждевременным родам и внутриутробному заражению плода.
У части людей с иммунодефицитом кампилобактериоз может протекать хронически с поражением эндокарда, суставов и других органов, по типу хрониосепсиса.
Патологические изменения слизистой оболочки толстой кишки варьируют от ее отека и гиперемии, иногда с кровоизлияниями, до выраженного разрыхления. Редко наблюдаются более значительные изменения с некротическими участками. На аутопсии при септической форме кампилобактериоза обнаруживают множественные микроабсцессы в головном мозге, миокарде, печени, скелетных мышцах; язвенные некротические изменения в кишечнике и почках.
Клиническая картина. Продолжительность инкубационного периода составляет 1—6 дней, чаще 1—2 дня.
По клиническому течению выделяют следующие формы кампилобактериоза: гастроинтестинальную, генерализованную (септическую), хроническую, субклиническую (бактериовыде-ление).
Кампилобактериоз в подавляющем большинстве случаев протекает как острая кишечная инфекция, т. е. в гастроинте-стинальной форме. Заболевание начинается остро с гриппопо-добного продромального периода. В течение 1—2 дней больные жалуются на общую слабость, головную боль, боли в мышцах и суставах, озноб. Температура тела обычно повышается до 38 °С. В дальнейшем присоединяются тошнота, реже рвота, боли в эпи- и мезогастрии. Боли в животе могут быть очень интенсивными по типу колики. Клинические проявления острого гастроэнтерита, с преобладанием признаков энтерита, сходны с симптомами при других кишечных инфекциях. На фоне болевого синдрома у больных появляется обильный, жидкий, пенистый, зловонный, затем водянистый стул (обычно до 10 раз в сутки). При многократном обильном стуле могут появиться признаки обезвоживания, деминерализации и ацидоза. У больных снижен тургор кожи, отмечаются сухость кожи и слизистых оболочек, судороги в мышцах конечностей, снижение диуреза. Особенно тяжело переносят дегидрацию дети первого года жизни, у них клиническая картина заболевания напоминает холеру.
На 2—3-й день от начала диареи нередко присоединяются признаки колита: в обильном водянистом стуле появляются патологические примеси — кровь и слизь. При микроскопическом исследовании фекалий выявляют воспалительный экссудат и лейкоциты, обычно можно обнаружить большое количество кампилобактерий. Боли в животе имеют схваткообразный характер, нередко симулируют картину «острого .живота» с перитонеальными симптомами.
Тяжелая форма заболевания встречается редко, при ней
значительно выражена общая интоксикация, температура тела достигает 40 °С, сопровождается сильным ознобом, иногда — бредом и спутанным сознанием. В гемограмме может быть умеренный лейкоцитоз.
При легкой форме клинические проявления заболевания могут сохраняться 1—2 сут. В среднем продолжительность диареи составляет 2—10 дней. Вместе с тем даже кратковременный энтероколит (в течение 2—3 дней) приводит к резкому истощению и ослаблению больных. Нередко боли в животе и общий дискомфорт и недомогание сохраняются после прекращения диареи. Период реконвалесценции продолжается от 2 дней до 3 нед. Обычно гастроинтестинальная форма кампи-лобактериоза заканчивается полным выздоровлением, однако могут развиваться рецидивы.
При гастроинтестинальной форме кампилобактериоза у части больных развиваются терминальный илеит и мезаденит (см. «Псевдотуберкулез»), а также реактивный артрит, экзантема, кардиопатии и другие поздние проявления кампилобактериоза.
Реактивный артрит развивается обычно через 1—2 нед после начала диарейного синдрома. Может поражаться один (чаще коленный) сустав, возможно распространение патологического процесса на голеностопные, лучезапястные суставы, мелкие суставы кисти и стоп.
Через 2—3 нед от начала заболевания у больных может появиться экзантема — пятнистая, пятнисто-папулезная, урти-карная, описана узловатая эритема.
Генерализованная (септическая) форма встречается преимущественно у детей первого года жизни и реже — у ослабленных взрослых.
Заболевание протекает в виде сепсиса с бактериемией и многими органными поражениями. У больных отмечаются выраженный синдром общей интоксикации, заторможенность, спутанность сознания. Лихорадка характеризуется значительными суточными колебаниями температуры, сопровождается потрясающими ознобами и профузным потоотделением. У больных быстро развиваются истощение, снижение массы тела, анемия. В большинстве случаев имеются боли в животе, может быть рвота и диарея. При осмотре больных определяются артериальная гипотензия, тахикардия, глухость сердечных тонов, увеличение размеров печени, иногда желтуш-ность кожных покровов.
На этом фоне развиваются клинические признаки пневмонии, перитонита, абсцессов печени, головного мозга. Микроабсцессы могут образовываться в почках и миокарде. Описаны кампилобактериозные менингит, эндокардит.
Кампилобактериозный сепсис может осложниться инфек-ционно-токсическим шоком.
Субклиническая форма кампилобактериоза выявляется при обследованиии в эпидемическом очаге и характеризуется выделением возбудителя из испражнений при отсутствии клинических признаков заболевания. Длительность выделения кам-пилобактерий у человека составляет 2—3 нед, в редких случаях достигает 3 мес. В сыворотке крови у бактериовыделителей отмечается нарастание титра специфических антител.
Хроническая форма кампилобактериоза характеризуется вялым волнообразным течением. Заболевание развивается постепенно, отмечаются длительная субфебрильная лихорадка, общая слабость, снижение работоспособности, недомогание, потливость, раздражительность, нарушение сна, снижение аппетита, снижение массы тела. Периодически у больных появляются умеренные боли в животе, тошнота, рвота, диарея. На этом фоне возникают признаки очаговых поражений: артриты, кератиты, конъюнктивит, реже — тромбофлебит, эндокардит, эмпиема плевры. У женщин часто развиваются вагинит, вульвовагинит, эндоцервицит, может быть бесплодие. Во время очередного обострения возможно появление признаков менингита.
По течению хронический кампилобактериоз напоминает хрониосепсис.
Прогноз. Обычно благоприятный. При генерализованных (септических) формах у новорожденных и больных с иммунодефицитом возможны летальные исходы.
Диагностика. Многообразие клинических проявлений инфекции и отсутствие типичного для данного заболевания сим-птомокомплекса делают клиническую диагностику затруднительной, а чаще — невозможной.
Для подтверждения диагноза кампилобактериоза используют лабораторные методы, важнейшими из которых являются бактериологический и бактериоскопический. Основным материалом для исследования служат испражнения больных, вместе с тем исследованию подлежат кровь, цереброспинальная жидкость и другие биологические материалы (например, гной из абсцессов). При фазово-контрастной микроскопии определяют характер подвижности возбудителя, типичный для кам-пилобактерий.
Посевы проводят непосредственно на селективные питательные среды или после предварительного обогащения в течение суток.
Для серологической диагностики используют методы микро-агглютинации, иммунофлюоресценции, РСК, РПГА, ИФА. Исследуют парные сыворотки, взятые с интервалом 10—14 дней.
Дифференциальная диагностика. Кампилобактериоз дифференцируют от острых кишечных инфекций другой этиологии (сальмонеллез, эшерихиоз, пищевые токсикоинфекции, дизентерия, холера), хирургических заболеваний органов брюшной полости. Генерализованную форму приходится дифференцировать от пневмонии, менингитов, сепсиса другой этиологии. Дифференциальную диагностику хронической формы кампилобактериоза проводят с такими инфекционными заболеваниями, как бруцеллез, кишечный иерсиниоз и псевдотуберкулез, токсоплазмоз.
Лечение. Наиболее эффективными средствами этиотроп-ной терапии являются эритромицин и гентамицин, возможно использование канамицина, карбенициллина, фуразолидона. Лечение проводят с использование обычных возрастных дозировок препаратов при гастроинтестинальной форме в течение 7 дней. В случае генерализованной формы кампилобактериоза применяют сочетание антимикробных препаратов с учетом чувствительности к ним выделенных штаммов возбудителя с увеличением продолжительности курса лечения. Для лечения хронической формы используют повторные курсы различных антибактериальных препаратов с интервалом между ними 7— 10 дней, дополнительно назначают средства иммунокорриги-рующей терапии.
Объем и состав патогенетической и симптоматической терапии определяются клиническими проявлениями кампилобактериоза. По показаниям больным проводят регидратацию водно-солевыми растворами, дезинтоксикацию, гипосенсиби-лизацию, общеукрепляющее и иммунорегулирующее лечение.
Профилактика. Основой профилактики кампилобактериоза являются санитарно-гигиенические мероприятия. Важное значение имеет соблюдение санитарно-ветеринарных правил содержания скота и птицы на животноводческих и птицеводческих фермах и предприятиях по их переработке. Существенная роль в профилактике кампилобактериоза принадлежит соблюдению санитарных правил на предприятиях по кулинарной обработке и реализации продуктов питания животного происхождения. Специфическая профилактика кампилобактериоза не разработана.
ЛИСТЕРИОЗ
Листериоз (listeriosis) — инфекционное заболевание, зоо-ноз, характеризуется клиникой или острого сепсиса с поражением ЦНС, миндалин, лимфатических узлов, печени или имеет хроническое течение.
История вопроса. Изучение листериоза как инфекционной болезни начато чуть свыше 100 лет назад, когда в 1892 г. во Франции впервые эта болезнь была обнаружена у кроликов. Позже появились сообщения об аналогичном заболевании и у других животных. Интерес к листериозу возрос после нескольких вспышек пищевого листериоза у людей в конце 80-х годов XX в. (США, Канада, Мексика, Швейцария, Великобритания), употреблявших в пищу молоко, сыры, мясные продукты, квашеную капусту. Летальность при этом достигала 33 %.
В нашей стране листериоз животных регистрируется с 1956 г., а листериоз человека — только с 1992 г.
Этиология. Возбудитель — Listeria monocytogenes — представляет собой небольшие палочки или коккобактерии, не образующие капсул и спор, имеющие тенденцию формировать короткие цепочки. Впервые выделены Мюррей и соавт. в 1926 г., по предложению Пири в 1927 г. названы в честь Д. Листера, изучавшего возбудитель при эпизоотии болезни у грызунов. Листерии — перитрихи, подвижны. Серологически выделено 4 серотипа (16 сероваров), серовары 4b, 1а, lb обусловливают 90 % всей заболеваемости людей.
Во внешней среде листерии довольно устойчивы, они длительно сохраняются в испражнениях, почве, зерне, во льду, могут размножаться при температуре холодильника, но быстро погибают при нагревании, под воздействием дезинфицирующих препаратов. Под воздействием солнечных лучей погибают через 2—15 сут. Листерии чувствительны к антибиотикам тетрациклиновой группы, пеницилли-нам, рифампицину, стрептомицину, эритромицину.
Эпидемиология. Листериоз — широко распространенное опасное инфекционное заболевание человека и животных, он встречается во всех странах мира. У людей листериоз может проявляться как спорадически, так и в виде вспышек пищевого характера, внутрибольнич-ных эпидемий в родильных домах.
В природных условиях листериозом болеют многие виды диких животных, заболевание встречается практически у всех видов сельскохозяйственных и домашних животных, декоративной и домашней птицы. Источником для людей являются больные и переболевшие животные, в том числе грызуны — листерионосители, которые своими выделениями заражают окружающую среду.
Человек заражается в результате: а) употребления в пищу мяса, молока, творога, сыров от больных и переболевших животных, а также салатов, овощей, других продуктов и воды, инфицированных грызунами (особенно часто человек заражается, употребляя в пищу ранние овощи, при хранении которых в холодильнике происходит накопление листерии и даже повышение их вирулентности); б) вдыхания пыли при уборке жилых и других помещений, где живут грызуны или больные, в том числе переболевшие животные; в) контакта с больными животными, а также при укусе клещами или блохами, паразитирующими на животных.
Кроме того, заражение происходит при употреблении продуктов от больных животных — молока, мяса, яиц, мороженого, мягких сыров.
Рабочая группа ВОЗ, рассмотрев полученные данные о листерио-зе человека, сделала вывод, что в современных условиях заражение человека листериозом происходит преимущественно алиментарным путем, без участия животных в цикле передачи.
Естественная восприимчивость людей не высокая; заболевания возникают в основном у лиц пожилого возраста, новорожденных, у лиц, страдающих различного рода иммунодефицитами, в том числе обусловленными опухолями, лекарственными средствами, хроническими заболеваниями.
Патогенез и патологоанатомическая картина. Листерии проникают в организм человека и животного через желудочно-кишечный тракт, органы дыхания, слизистые оболочки зева, носа, глаз, поврежденную кожу, а также через плаценту. Так как состояние иммунной системы в значительной степени определяет возможность развития клинически выраженной формы болезни, листериозом заболевают преимущественно дети первого года жизни и лица в возрасте старше 55 лет. Предрасполагающими факторами являются состояния, характеризующиеся иммуносупрессией. Так, заболевают чаще лица, длительно получающие кортикостероиды, иммунодепрессанты, больные новообразованиями, диабетом, ВИЧ-инфицированные и др. Вертикальная (трансплацентарная) передача инфекции приводит к генерализованной форме листериоза у плода. В случае генерализации процесса происходит проникновение возбудителя в кровь, развивается острое лихорадочное заболевание. Диссеминация листерий, их оседание в ретикулоэндо-телиальной системе (печень, селезенка, лимфатические узлы) определяет соответствующую симптоматику, а проникновение в нервную систему ведет к развитию менингитов и менинго-энцефалитов. Чаще встречающаяся острая форма характеризуется лихорадкой, длящейся от 3 дней до 2 нед, интоксикацией, увеличением печени и селезенки; возможна крупнопятнистая сыпь на коже. При железистой (бубонной) форме наряду с общими симптомами отмечается ангина, подчелюстной, реже шейный и подмышечный лимфаденит (ангинозно-желези-стый вариант) или односторонний гнойный конъюнктивит и околоушной лимфаденит — глазо-железистый вариант. Нервная форма, проявляющаяся менингитом, менингоэнцефали-том, энцефалитом, сочетается с ангиной, конъюнктивитом, лимфаденитом.
Длительное сохранение листерий в почках имеет значение для внутриутробного заражения плода.
Клиническая картина. Инкубационный период длится 2— 4 нед. Клиническое течение листериоза отличается разнообразием, в зависимости от преимущественной локализации патологического процесса выделяют следующие формы болезни: 1) ангинозно-септическую; 2) глазо-железистую; 3) железистую; 4) нервные формы (менингиты, менингоэнцефалиты, энцефалиты, психозы); 5) тифоподобную; 6) листериоз беременных; 7) листериоз новорожденных (септическое течение). По течению различают острые, подострые и хронические формы.
Как правило, заболевание начинается внезапно, спустя 2— 4 нед после заражения. У больного температура тела повышается до 38—39 "С, появляются общая слабость, головные, суставные и мышечные боли. Иногда развиваются ангина, конъюнктивит, увеличение лимфатических узлов, печени, селезенки, рвота, жидкий стул, нередко развивается менингоэнцефа-лит. Нередко появляется крупнопятнистая или эритематозная сыпь, сгущающаяся в области крупных суставов; на лице иногда образуется фигура бабочки. При железистых формах выявляются увеличенные и болезненные лимфатические узлы, в частности подчелюстные, шейные, подмышечные, мезентери-альные. У больных нервной формой листериоза обнаруживаются менингеальные симптомы: Кернига, Брудзинского, ригидность мышц затылка. Цереброспинальная жидкость вытекает под давлением, отмечаются цитоз и небольшое увеличение количества белка. Дети в 75 % случаев листериоз переносят в виде нервной формы.
Иногда в клинической картине ведущими являются лихорадка (длительность лихорадки при листериозе варьирует от 3 дней до 2 нед), симптомы общей интоксикации, наличие сыпи, гепатолиенального синдрома, что позволяет выделять этот вариант как тифоподобный. У некоторых больных в клинической картине на первый план выступают симптомы острого гастроэнтерита, острого пиелита, острого эндокардита.
Железистая форма листериоза встречается в 15—20 % случаев, она клинически протекает часто с септической лихорадкой, ознобами, потливостью, увеличением печени, селезенки и лимфатических узлов. В зависимости от клинических проявлений выделяют ангинозно-железистую или ангинозно-септическую, собственно железистую и глазо-железистую формы.
Ангинозно-железистая форма встречается чаще, у больного с первых дней заболевания выявляются ангина (от катаральной до дифтеритической и язвенной), шейный лимфаденит, моноцитарная и мононуклеарная реакция крови. При глазо-железистой форме листериоза ведущим симптомом является поражение глаз в виде конъюнктивита с выраженным отеком век, сужением глазной щели.
Среди взрослых больных нервная форма наблюдается в 5— 10 % случаев, она проявляется менингеальными, менингоэн-цефалитическими и редко энцефалитическими симптомами. У больных наряду с интоксикацией, лихорадкой, увеличением лимфатических узлов, печени и селезенки выражена ригидность мышц затылка, симптомы Кернига, Брудзинского, повышенные рефлексы, парестезия и гиперестезия, клонические судороги, бред, нарушение сознания. При анализе спинномозговой жидкости ликвор прозрачный, вытекает под повышенным давлением, в нем отмечается увеличение белка, цитоз смешанный, нейтрофильно-лимфоцитарного характера. Содержание сахара и хлоридов не изменяется.
Листериоз наибольшую опасность представляет для беременных и новорожденных, вызывая выкидыши, мертворожде-ния, пороки развития плода, а также менингоэнцефалиты, сепсис и пневмонии у новорожденных. Даже при своевременной антибиотикотерапии смертность при перинатальном и неонатальном листериозе достигает 30—50 %.
У большинства женщин, у которых родился ребенок с врожденным листериозом, отсутствовали типичные проявления листериоза. А. П. Казанцев (2000) полагает, что внутриутробное инфицирование происходит не в результате бессимптомной инфекции (носительства), а в результате обострения латентного листериоза во время беременности. Это обострение может проявляться в виде легких гриппоподобньгх заболеваний или в более тяжелых формах.
Весьма тяжело листериоз протекает у новорожденных, он, как врожденная инфекция, характеризуется тяжелым течением и нередко приводит к гибели детей. Это своеобразное септически протекающее заболевание, сопровождающееся образованием специфических гранулем в различных органах. Как правило, при заражении плода рождается мертвый или недоношенный ребенок, который неизбежно погибает в течение первых 2 нед жизни.
Для клинической картины листериоза новорожденных характерны лихорадка (38—39 °С и выше), одышка, цианоз, специфическая листериозная бронхопневмония, протекающая иногда с выраженными нарушениями бронхиальной проходимости и ателектазами, возможно развитие гнойного плеврита. В большинстве случаев обнаруживаются увеличенные печень и селезенка, часто наблюдается желтуха. В отдельных случаях развиваются менингеальные симптомы, иногда судороги, неравномерность сухожильных рефлексов, параличи. Характерна экзантема, сыпь захватывает туловище и конечности, вначале это темно-красные пятна, затем они превращаются в папулы, а некоторые в везикулы. После выздоровления у 15— 20 % реконвалесцентов сохраняются резидуальные явления со стороны центральной нервной системы.
Возможно хроническое течение листериоза, когда возбудитель длительное время может находиться в организме, не вызывая заметных клинических проявлений. Периодически возможны обострения в виде легких гриппоподобньгх заболеваний или обострения хронического пиелита. В случае развития иммунодефицита (новообразования, лейкозы, лимфогранулематоз, прием кортикостероидов и др.) у этих лиц может наступить манифестация болезни вплоть до генерализованной инфекции.
Прогноз неблагоприятный у детей до 1 года и у взрослых старше 60 лет, а также у лиц с тяжелой сопутствующей патологией (рак, СПИД и др.). Прогноз более благоприятный у взрослых без тяжелой сопутствующей патологии.
Диагностика. Клиническая диагностика трудна, диагноз должен быть подтвержден лабораторно. Серологические методы включают реакцию агглютинации (диагностический титр
1:400—1:800), РСК (диагностический титр 1:5—1:10), РНГА (диагностический титр 1:100). Серологическая диагностика недостаточно эффективна из-за ложноположительньк результатов, обусловленных антигенным родством листерий и стафилококков. В связи с ограниченной ценностью серологической диагностики в основном используется бактериологическое исследование, материалом являются кровь, смывы зева, цереброспинальная жидкость, околоплодные воды, плацента, органы мертворожденных или умерших.
Лечение. Обычно листериоз развивается на фоне других заболеваний, поэтому нужно лечить не только листериоз, но и те заболевания, которые обусловили развитие листериозной инфекции. Этиотропная терапия включает антибиотики тет-рациклиновой группы (тетрациклин) по 0,25—0,4 г 4 раза в сутки в течение всего лихорадочного периода и еще 5—7 дней. Можно назначать пенициллин, эритромицин или сочетание ампициллина с гентамицином или пенициллином. Антибиотики назначаются в обычной дозировке.
Лечение хронических форм при обострении такое же, как и при острых. При отсутствии выраженных обострений после лечения антибиотиками назначают сульфаниламиды в обычных дозах в течение 7—10 дней.
При глазо-железистой форме дополнительно к проводимому лечению проводят закапывание в глаза 20 % раствора альбуцида, 1 % эмульсии гидрокортизона.
ТОКСОПЛАЗМОЗ
Токсоплазмоз (Toxoplasmosis) — зоонозный протозооз, характеризующийся хроническим течением, поражением нервной системы, лимфаденитом, увеличением печени и селезенки, частым поражением скелетных мышц, миокарда и глаз. При врожденном токсоплазмозе нередко возникают тяжелые поражения нервной системы и глаз.
Исторические сведения. Возбудитель токсоплазмоза был впервые выделен от кролика итальянским ученым А. Сплендоре, представившим описание паразита и предпринявшим опыты по заражению им здоровых кроликов, морских свинок и собак. Пснти одновременно в 1908 г. Ш. Николь и Л. Мансо, проводившие работы по лейшманио-зу у диких животных в Тунисе, обнаружили во внутренних органах грызунов Ctenodactylus gondii неподвижных одноклеточных паразитов, выделили их в самостоятельный род Toxoplasma (от греч. tox-оп — арка, дуга) и присвоили им видовое название Toxoplasma gondii. В России первая обстоятельная работа по токсоплазмозу была опубликована В. Л. Якимовым и Н. Коль-Якимовой (1912), обнаружившими это заболевание у собак. Д. Н. Засухин и Н. А. Гайский (1930) выделили токсоплазмы от сусликов в Западном Казахстане,
Г. Я. Змеев (1935) обнаружил аналогичных паразитов у крыс в Туркмении.
Первым указал на патогенное значение токсоплазм для человека А. Кастеллани (1914). Он обнаружил этих паразитов у солдата, погибшего в Шри-Ланке (бывш. о. Цейлон). А. И. Федорович (1916) при исследовании крови на малярию обнаружила токсоплазмы у ребенка; она же выявила этих паразитов у собак. Чешский офтальмолог Дж. Янки (1923) описал случай левостороннего микрофтальма и двусторонней колобомы желтого пятна вследствие токсоплазмоза у ребенка, умершего при явлениях гидроцефалии.
Важные всесторонние исследования по токсоплазмозу людей и животных проведены А. Сэбином и другими американскими вирусологами в 1937—1955 гг. Исследователи выделили токсоплазмы от морских свинок, выявили патогенность их для мышей, кроликов, кур и обезьян, изучили размножение паразитов в пораженных ими клетках и органах и предложили применять PC К для диагностики токсоплазмоза. Американские исследователи наблюдали несколько случаев врожденного и приобретенного токсоплазмоза у людей. А. Сэбин и X. Фельдман в 1948 г. разработали оригинальный метод окраски токсоплазм, используемый в диагностике инвазии и в настоящее время, — реакция Сэбина—Фельдмана.
Этиология. Возбудитель — Toxoplasma gondii — относится к отряду Eucoccidiida, подотряду Eimeriina, семейству Eimeriidae, подсемейству Isosporinae. Форма тела возбудителя зависит от фазы развития. В фазе трофозоита он приобретает форму полумесяца или дольки апельсина, имея один конец заостренный, другой — закругленный. Длина тела 4—7 мкм, ширина 2—4 мкм. Снаружи тело покрыто двухслойной пелликулой. Цитоплазма гомогенная с мелкими гранулами. Ядро имеет диаметр 1,5—2 мкм. Методом Романовского—Гимзы цитоплазма окрашивается в голубые тона, ядро — в рубиново-красные. Тип движения у токсоплазм скользящий.
Токсоплазмы — облигатные внутриклеточные паразиты, размножающиеся в клетках СМФ путем продольного деления или эндодио-гении (внутреннее почкование). Размножившиеся паразиты заполняют пораженные ими клетки, плотно прилегая друг к другу. Такие скопления паразитов называются псевдоцистами. Они не имеют собственной оболочки. Пораженные клетки разрушаются, освободившиеся токсоплазмы проникают в здоровые клетки, где вновь формируются псевдоцисты.
У токсоплазм наблюдается и половое размножение, которое происходит в эпителиальных клетках кишечника окончательных хозяев — кошек и диких видов семейства Feleidae (кошачьих). После пер-орального инвазирования токсоплазмы проникают в эпителиальные клетки пищеварительного тракта, где размножаются путем множественного деления, или шизогонии, с образованием мерозоитов. В дальнейшем одна часть мерозоитов преобразуется в мужские половые клетки (микрогаметы), другая—в женские (макрогаметы). В результате слияния гамет внеклеточно или в клетке хозяина формируются ооцисты размером 20—100 мкм, заключенные в собственную плотную оболочку. Ооцисты, выделенные с фекалиями в окружающую среду, могут сохранять жизнеспособность длительное время. При соответствующих температуре и влажности воздуха и доступе кислорода в каждой ооцисте через несколько дней образуются по две спороцисты с четырьмя спорозоитами. Такие ооцисты приобретают инвазивность.
Во внутренних органах при хроническом токсоплазмозе могут образовываться истинные цисты. Они либо подвергаются обызвествлению, либо разрушаются с выходом токсоплазм и проникновением их в здоровые клетки, что влечет за собой рецидив заболевания.
Разные штаммы токсоплазм отличаются неодинаковой вирулентностью и антигенной структурой. В целом Т. gondii считается паразитом с относительно низкой патогенностью. Очень большую опасность представляет Т. gondii лишь для беременных при их свежем заражении во время первой беременности, так как в 40 % случаев это обеспечивает вертикальную передачу возбудителя плоду и в большинстве случаев последующие его тяжелые поражения.
Токсоплазмы в стадии трофозоитов неустойчивы к воздействию термических и некоторых химических агентов. Они быстро погибают при нагревании до 55 °С и в течение 5—10 мин от воздействия 50 % спирта, 1 % раствора фенола, 1 % раствора хлороводородной кислоты, 2 % раствора хлорамина.
Культивирование токсоплазм производится в куриных эмбрионах и на культурах тканей. Для поддержания их роста используют и лабораторных животных (белых мышей и др.), заражаемых внугрибрю-шинно. Через 3—6 дней инвазированные животные погибают; в брюшной полости их обнаруживается экссудат с большим количеством псевдоцист и одиночных паразитов.
Эпидемиология. Токсоплазмоз — убиквитарный протозойный зоо-ноз. Естественным резервуаром токсоплазм служат многие виды домашних и диких млекопитающих и птиц, среди которых возникают значительные эпизоотии, часто сопровождаемые массовыми абортами.
Известны антропоургические и природные очаги токсоплазмоза. В антропоургических очагах токсоплазмоз обнаружен у крупного рогатого скота, овец, коз, лошадей, верблюдов, свиней, ослов, собак, кошек, домовых грызунов, кроликов, кур, уток, цесарок, индеек, канареек и др. В природных очагах токсоплазмоз выявлен практически почти у всех обследованных видов млекопитающих и птиц, которым принадлежит решающая роль в рассеивании токсоплазм. Особенно часто поражаются грызуны, в том числе зайцы. У последних токсоплазмоз приобретает характер крупных и тяжелых эпизоотии.
В антропоургических очагах источниками инвазии человека служат сельскохозяйственные и домашние животные, а также домовые грызуны. Особое значение придается кошкам, которые вместе с другими представителями семейства кошачьих являются единственными окончательными хозяевами токсоплазм. При отсутствии окончательных хозяев в естественных природных условиях циркуляция возбудителя долго поддерживаться не может. В организме кошек происходит половой цикл развития возбудителя, выделяемого с фекалиями в окружающую среду в виде ооцист, обладающих высокой устойчивостью и сохраняющихся в течение многих месяцев в детских песочницах, почве садов, огородов и т. д.
Промежуточные хозяева токсоплазм — человек и животные различных семейств — в большинстве своем представляют эпидемиологический тупик, кроме тех, которые становятся добычей кошек (мыши, крысы, другие грызуны, птицы) и тем самым поддерживают жизненный цикл токсоплазм. Трансплацентарная передача описана у всех промежуточных хозяев, в том числе у человека. Особенно важное значение это приобретает у грызунов, так как некоторые из них способны передавать возбудителя нескольким поколениям. В настоящее время установлено, что контакт с промежуточными хозяевами (собаками, сельскохозяйственными животными, грызунами) практически не может привести к заражению человека.
Заражение человека происходит алиментарным путем при попадании цист в пищеварительный тракт в процессе дегустации (опробования) сырого мясного фарша или при употреблении в пищу недостаточно термически обработанного мяса, особенно овец, свиней, кроликов (молоко и молочные продукты, по-видимому, не являются причиной заражения). Заражение осуществляется и при попадании в пищеварительный тракт ооцист, выделенных кошками с испражнениями (при загрязнении рук почвой, песком), или при контакте с инвазированными кошками.
В лабораториях наблюдалось заражение персонала при попадании высоковирулентных штаммов токсоплазм через поврежденную кожу (при уколе пастеровской пипеткой или иглой шприца, содержащих чистую культуру токсоплазм). Человек, как и другие промежуточные хозяева, для окружающих неопасен, однако свежее заражение во время первой беременности может привести к внутриутробному заражению плода. Описаны единичные случаи заражения человека при трансплантации органов. Специальными исследованиями доказано также, что кровь доноров, больных токсоплазмозом, безопасна для реципиентов, следовательно, исключается возможность заражения и при контакте с кровью (гинекологов, хирургов, лаборантов). Исключены также воздушно-капельный, трансмиссивный и половой пути передачи возбудителя инвазии.
Сезонность заболеванию несвойственна, оно регистрируется в любое время года. К инвазии более восприимчивы лица молодого возраста, у людей старше 60 лет токсоплазмоз встречается крайне редко.
Токсоплазмоз широко распространен во многих странах мира, особенно в тропических районах. Установлено, что в северных районах земного шара инфицированность населения находится в пределах 4—11%, а в тропических районах она достигает 64—68 %. В среднем токсоплазмозом заражено 20—30 % населения мира.
Патогенез и патологоанатомическая картина. Входными воротами инвазии служат органы пищеварения, внедрение возбудителя происходит преимущественно в нижних отделах тонкой кишки. Затем Т. gondii с током лимфы достигают регионарных (мезентериальных) лимфатических узлов. Здесь токсо-плазмы размножаются, вызывая воспалительные изменения с формированием гранулемы, напоминающей по клеточному составу туберкулезные или бруцеллезные. Затем паразиты проникают в кровь и гематогенно разносятся по всему организму, фиксируются в органах, богатых клетками СМФ (печень, селезенка, лимфатические узлы). Наряду с этим избирательно поражаются нервная система, глаза, миокард, скелетные мышцы. В этих органах происходит размножение токсоплазм с образованием псевдоцист, а в дальнейшем, по мере формирования иммунитета, о граничивающего бурное размножение возбудителей, в органах и тканях образуются цисты.
Последние могут сохраняться в организме десятки лет или пожизненно. В нервной системе, мышцах образуются очаги некроза с последующей их кальцификацией и формированием петрификатов.
Важное значение в патогенезе заболевания имеет аллергическая перестройка организма.
У большой части алиментарно инвазированных людей возникает первично-латентная форма приобретенного токсоплаз-моза со стойкой компенсацией патологического процесса без его клинической манифестации. Лишь иногда (около 1 % всех инвазированных) наблюдаются вялотекущие, рецидивирующие формы первично-хронического токсоплазмоза и крайне редко (0,2—0,5 % от общего числа больных) — острая форма токсоплазмоза с декомпенсированным генерализованным процессом и тяжелым течением.
При внутриутробном заражении в первые месяцы беременности обычно наступает гибель плода и самопроизвольный выкидыш, но не исключается возможность эмбриопатии и рождения детей с дефектами развития. В случае заражения в поздний период беременности ребенок рождается с признаками генерализованного токсоплазмоза.
При тяжелых летальных генерализованных формах приобретенного токсоплазмоза патологоанатомически обнаруживаются признаки анемии, кровоизлияния в серозные оболочки, дилатация полостей сердца, очаги пневмонии или отек легких, некротические очаги в печени и селезенке, набухание лимфатических узлов, полнокровие сосудов головного мозга. Патоморфологическая картина пораженных тканей представляется в виде очаговых некрозов, диффузной или гранулема-тозной пролиферации ретикулярных клеток, лимфогистиоци-тарньгх и плазмоклеточных инфильтратов по периферии некротических очагов. В пораженных тканях обнаруживаются паразиты (трофозоиты).
При врожденном токсоплазмозе может происходить недоразвитие полушарий большого мозга. Поражение эпендимы, возникновение спаек в желудочках мозга, облитерация под-паутинных пространств приводят к развитию гидроцефалии. В случае поздней фетопатии появляются очаги некроза в коре большого мозга, подкорковой области и стволовом отделе, обызвествление и продуктивное воспаление вещества головного мозга и его оболочек. Нередко развивается менингоэнце-фалит. Возникают острые очаги некробиоза в сетчатке с образованием гранулем в сосудистом тракте, что свидетельствует о развитии эндофтальмита.
Генерализованная форма врожденного токсоплазмоза пато-морфологически характеризуется поражением головного мозга, гепато- и спленомегалией, желтухой, миокардитом, интер-стициальной пневмонией, язвенными поражениями кишечни-
ка. В печени и селезенке выявляются очаги реактивного мие-лоэритробластоза, в паренхиматозных органах — некрозы и диффузная лимфогистиоцитарная инфильтрация с эозинофи-лами. Редко наблюдаются висцеральные и генерализованные формы без поражения головного мозга. Все эти изменения не специфичны для токсоплазмоза.
Клиническая картина. Инкубационный период при случайных лабораторных заражениях человека продолжается около 2 нед. При естественном инфицировании длительность инкубационного периода определить трудно, так как токсоплазмоз чаше протекает в виде первично-латентной или первично-хронической формы с постепенным началом заболевания.
В зависимости от механизма заражения различают приобретенный и врожденный токсоплазмоз.
Приобретенный токсоплазмоз может протекать в следующих клинических формах: 1) острый; 2) хронический и 3) латентный токсоплазмоз; последняя форма подразделяется на первично-латентную, протекающую обычно без клинических проявлений и с редко возникающими обострениями, и на вторично-латентную, при которой нередко отмечаются обострения и развиваются резидуальные проявления (калъцифика-ты, рубцы после хориоретинита, снижающие зрение, и др.).
Острый приобретенный токсоплазмоз — редкая форма заболевания, у большей части больных протекает с маловыражен-ной симптоматикой (слабость, недомогание, миалгии, неврастенические реакции) и заканчивается выздоровлением. Диагноз устанавливается с трудом.
В редких случаях острый токсоплазмоз может протекать в генерализованной, тяжелой форме, характеризующейся острым началом, лихорадкой, выраженной общей интоксикацией, увеличением печени и селезенки, развитием миокардита, частым появлением полиморфной, обычно розеолезно-папу-лезной экзантемы.
Острые формы могут протекать без симптомов энцефалита (тифоподобные, или экзантемные, формы) и с признаками энцефалита (энцефалитические, менингоэнцефалитические, или церебральные, формы). Энцефалит всегда выявляется на фоне других признаков генерализованного токсоплазмоза, что помогает распознаванию заболевания. Эта форма токсоплазмоза протекает наиболее тяжело, часто с летальным исходом.
При стихании патологического процесса заболевание переходит во вторично-хроническую форму с резидуальными явлениями (симптоматическая эпилепсия, снижение интеллекта и др.).
Хронический токсоплазмоз — длительное, вялотекущее заболевание, характеризующееся субфебрильной температурой тела, симптомами хронической интоксикации, на фоне которых появляются множественные органные поражения нервной системы, глаз, миокарда, мышц и др. Заболевание начинается постепенно. Больные жалуются на общую слабость, снижение аппетита, нарушение сна, раздражительность, головную боль, снижение памяти, сердцебиения и боли в сердце, боли в мышцах, суставах, иногда нарушение зрения.
При обследовании почти у всех больных отмечается суб-фебрильная температура тела, которая может оставаться на таком уровне месяцами или выявляться в виде волн различной продолжительности, чередующихся с периодами апирек-сии. Частым симптомом является генерализованный лимфаденит: увеличиваются периферические (шейные, затылочные, подмышечные, паховые) и мезентериальные лимфатические узлы. Иногда мезаденит бывает резко выражен, что обусловливает ошибочные диагнозы туберкулезного мезаденита, аппендицита, аднексита и др. Лимфатические узлы вначале мягкие, болезненные при пальпации, затем уменьшаются в размерах, становятся плотными, малоболезненными или безболезненными. Печень увеличена более чем у половины больных, при пальпации может быть умеренно болезненной, значительных нарушений функций ее не наблюдается. Нередко выявляется увеличение селезенки.
Частым проявлением хронического токсоплазмоза бывает специфический миозит. Отмечаются боли в мышцах, в толще которых можно прощупать болезненные уплотнения, а при рентгенографии у части больных удается выявить кальцифи-каты в мышцах. Возможны боли в суставах, но без признаков их воспаления.
Характерно поражение сердечно-сосудистой системы, что проявляется артериальной гипотензией, иногда тахикардией и нарушениями ритма. Отмечаются смешение границ сердца влево, приглушение тонов сердца, признаки сердечной недостаточности — картина миокардита. ЭКГ почти у всех больных показывает очаговые или диффузные изменения миокарда.
Органы дыхания страдают редко, поражения напоминают проявления пневмоцистоза.
Многие больные жалуются на снижение аппетита, сухость во рту, тошноту, тупые боли в эпигастральной области, вздутие живота, задержку стула, нередко отмечается похудание. При исследовании желудочного сока выявляются снижение секреции и уменьшение кислотности желудочного сока. Рентгенологически определяется нарушение моторной функции толстого отдела кишечника.
У большинства больных имеются многообразные изменения нервной системы. Относительно редко поражаются периферические нервы, чаще в патологический процесс вовлекается ЦНС. Иногда это проявляется в виде умеренно выраженных невротических симптомов (эмоциональная лабильность, снижение работоспособности, раздражительность, мнительность, канцерофобия и т. д.). У некоторых больных развиваются тяжелые неврозы по типу истерии, часто бывают диэн-цефальные расстройства, может возникнуть симптоматическая эпилепсия. Как правило, наблюдаются вегетососудистые нарушения. Часто отмечаются поражения глаз, хориоретинит, увеит, прогрессирующая близорукость. Нарушаются функции эндокринной системы (расстройства менструального цикла, импотенция, вторичная надпочечниковая недостаточность, реже снижается функция щитовидной железы). У иммунно-компрометированных больных (ВИЧ/СПИД) неврологические расстройства могут быть обусловленны токсоплазмозным абсцессом головного мозга, визуализируемым при КТ или МРТ.
При исследовании периферической крови выявляются лейкопения, нейтропения, относительный лимфоцитоз, тенденция к увеличению количества эозинофильных лейкоцитов. СОЭ остается нормальной.
Латентный токсоплазмоз характеризуется тем, что даже, при тщательном клиническом обследовании больного симптомов токсоплазмоза выявить не удается (при первично-латентной форме) или отмечаются лишь резидуальные явления в виде старых очагов хориоретинита, кальцификатов, склеро-зированных лимфатических узлов (при вторично-латентной форме). Заболевание диагностируется при лабораторном и инструментальном обследовании пациентов. На фоне иммунной супресии может наступить клиническая манифестация латентной инвазии.
Врожденный токсоплазмоз подразделяется на следующие формы: 1) острый; 2) хронический; 3) латентный и 4) резиду-альный токсоплазмоз (гидроцефалия, олигофрения, эпилепсия и т. д.); встречается относительно редко, возникает в результате трансплацентарной передачи инфекции при заражении женщин во время первой беременности или незадолго перед ней. Острая форма врожденного токсоплазмоза протекает тяжело в виде общего генерализованного заболевания, которое проявляется выраженной интоксикацией, лихорадкой, увеличением печени (нередко с желтухой) и селезенки, макулопапулезной экзантемой; у многих больных на этом фоне развиваются тяжелый энцефалит и поражения глаз (преимущественно в виде хориоретинита — до 30—50 %).
При переходе врожденного токсоплазмоза из острой в хроническую форму выявляются последствия энцефалита в виде гидроцефалии, олигофрении, развития симптоматической (височной, или джексоновской) эпилепсии, а также различные поражения органов зрения, вплоть до микро- и анофтальма. Вначале эти проявления отмечаются на фоне субфеб-рильной температуры тела, интоксикации, миозитов, лимфаденита. Затем постепенно активность процесса стихает и сохраняются лишь последствия энцефалита. В этих случаях можно говорить о резидуальном врожденном токсоплазмозе.
Прогноз. При приобретенном токсоплазмозе благоприятный, при врожденном — серьезный.
Диагностика. Распознавание токсоплазмозов основывается на тщательном клиническом обследовании больных, включая данные специальных исследований органов и систем (ЭКГ, осмотр глазного дна, рентгенография черепа и пораженных мышц). Учитывая, что положительные серологические и аллергические реакции часто встречаются у здоровых людей (до 30 %) и больных другими заболеваниями, оценивать их следует осторожно.
Из серологических реакций наиболее распространена РСК с токсоплазменным антигеном, более чувствительными являются реакция с красителем (реакция Сэбина—Фельдмана), РНГА, ИФА и НРИФ, которые становятся положительными через 1—2 нед после инфицирования. Из аллергологических методов применяются внутрикожная проба с токсоплазмином, титрационная проба с токсоплазмином, реакция повреждения нейтрофильных лейкоцитов и РБТЛ. Перечисленные иммунологические методы достаточно специфичны, получение положительных диагностических титров достоверно свидетельствует о заражении человека токсоплазмами. Для диагностики заболевания необходимы повторное серологическое обследование и получение данных о переходе отрицательных реакций в положительные или о нарастании титров антител в динамике заболевания. Ценность иммунологической диагностики повышается при одновременном использовании нескольких методов с раздельным определением антител классов IgM и IgG. Широко применяется ПЦР-диагностика токсоплазмоза.
Используется паразитологический метод, основанный на обнаружении возбудителя при микроскопировании окрашенных мазков крови и центрифугата цереброспинальной жидкости, пунктата или биоптатов лимфатических узлов, миндалин, а также гистологических срезов тканей органов трупов. При патологии беременности на токсоплазмы исследуют плаценту, околоплодные воды и оболочки. Для изоляции токсоплазм проводят биопробу на лабораторных животных (белых мышах) с последующим (через 7—10 дней) приготовлением мазков из перитонеальной жидкости и окрашиванием их по Романовскому—Гимзе. При отрицательном результате исследование повторяют, заражая перитонеальным экссудатом вторую группу мышей. Через 3 нед выживших животных вскрывают, готовят мазки-отпечатки из тканей головного мозга для выявления цист токсоплазм. Одновременно животных обследуют серологически для обнаружения у них сероконверсии.
Лечение. Терапия больных токсоплазмозом должна быть комплексной.
При остром токсоплазмозе или при рецидиве хронического токсоплазмоза основное значение принадлежит этиотропным препаратам, которые оказывают активное воздействие на тро-фозоиты. Используют пириметамин (хлорохин, дараприм) в комбинации с сульфадимезином и фолиевой кислотой в течение 4—6 нед. Могут проводиться три 7—10-дневных курсов лечения указанными препаратами с интервалом 7—10 дней. Лечение проводят под контролем периферической крови из-за токсического действия обоих препаратов на костный мозг. При тяжелом течении болезни, особенно в случаях поражения глаз, этиотропную терапию сочетают с применением глюко-кортикостероидов.
Альтернативными этиотропными препаратами являются, в частности, атоваквон, хингамин, сульфаниламидные (сульфа-пиридазин, сульфадиметоксин и др.), антибиотики тетрацик-линового ряда, клиндамицин, макролиды. Для лечения беременных используют ровамицин (Spiramycine). Назначают патогенетическую терапию в зависимости от тяжести клинической картины болезни.
При хронических формах токсоплазмоза возбудитель в организме больных находится почти исключительно в форме цист, на которые указанные выше препараты практически не действуют. В этих случаях хороший эффект дает комплексная терапия, включающая 5—7-дневный курс химиотерапии (хингамин, тетрациклин) для подавления токсоплазм в стадии тро-фозоитов в сочетании с витаминами, средствами неспецифической гипосенсибилизации (димедрол, пипольфен, супра-стин, глюкокортикостероиды в небольших дозах). В обязательном порядке производится курс специфической иммунотерапии токсоплазмином. Для каждого больного подбирают индивидуальное рабочее разведение препарата с помощью титрационной пробы. Во время лечения токсоплазмином ежедневно проводят общее УФО, начиная с 1/4 биодозы до 1 биодозы. Беременные, если у них выявляются положительные результаты РСК и внутрикожной пробы и отсутствуют клинические проявления токсоплазмоза, лечению не подлежат. Беременные, больные хронической формой токсоплазмоза с выраженными клиническими проявлениями, нуждаются в проведении профилактического курса иммунотерапии. Наибольшую угрозу для беременных представляет свежее инвазирова-ние. В этих случаях проводят химиотерапию (1—2 курса). Хи-миотерапевтические препараты нельзя назначать в первые 3 мес беременности, так как многие из них (особенно хлори-дин, сульфадимезин и тетрациклин) обладают тератогенным действием и могут вызвать повреждение плода.
Профилактика. Мероприятия по борьбе с токсоплазмозом домашних животных, ограничение контакта с кошками, соблюдение правил личной гигиены для предупреждения попадания ооцист (через загрязненные руки, запрещение употребления и дегустации сырого мясного фарша и недостаточно термически обработанного мяса). Особенно тщательно эти правила должны соблюдаться женщинами во время беременности.
АМЕБИАЗ
Амебиаз (Amoebiasis) — протозойная инфекция, характеризующаяся язвенным поражением толстой кишки, возможностью образования абсцессов в различных органах и склонностью к затяжному и хроническому течению.
Исторические сведения. Возбудителя амебиаза — дизентерийную амебу — впервые обнаружил Ф. А. Леш в 1875 г. в Петербурге в кале больного, длительное время страдавшего кровавым поносом.
В 1883 г. Р. Кох в Египте, проводя патологоанатомическое исследование трупов людей, погибших от дизентерии, в четырех случаях обнаружил амеб в гистологических срезах тканей кишечных язв и стенках абсцесса печени. Ему удалось выявить амеб и в испражнениях двух больных дизентерией. К. Картулис (1886) в Египте доказал патогенную роль амеб в поражении кишки и печени. В самостоятельную нозологическую форму под названием «амебной дизентерии», в отличие от «бациллярной дизентерии» это заболевание было выделено Каунсильманом и Ф. Лефлером в 1891 г. В настоящее время оно сохраняется для обозначения амебного поражения кишечника, а под названием «амебиаз» подразумевается поражение любого органа гистолитической амебой.
В 1903 г. Ф. Шаудинн представил подробное описание дизентерийной амебы, присвоив ей название Entamoeba histolytica.
В 1912 г. в практику терапии амебиаза был введен солянокислый эметин, отличающийся высокой амебоцидной активностью.
Этиология. Возбудитель амебиаза — Entamoeba histolytica— относится к простейшим подтипа Sarcodinae (ложноножковые), суперклассу Rhizopoda, классу Lobosea, подклассу Gymnamoebia, порядку Amoebida, подпорядку Tubulina, семейству Entamoeba. Морфологически Е. histolytica не отличима от непатогенной Е. dispar. Различия выявляются при анализе ДНК и на основании изоэнзимных характеристик зимодемов амеб (до 22). Жизненный цикл дизентерийной амебы включает две стадии — вегетативную (трофозоит) и покоя (циста), которые могут переходить одна в другую в зависимости от условий обитания в организме хозяина.
Вегетативная стадия цикла развития паразита включает в себя 4 формы амеб: тканевую, большую вегетативную, просветную и предцистную, каждая из форм имеет морфологические и функциональные особенности (рис. 18).
Тканевая
форма (тканевый трофозоит Е. histolytica)
дизентерийной
амебы длиной 20—25 мкм обладает высокой
подвижностью и инвазионной способностью.
Движение осуществляется толчкообразно
с помощью псевдоподий. Тканевая форма
обнаруживается толжо при остром амебиазе
в пораженных органах и редко в испражнения>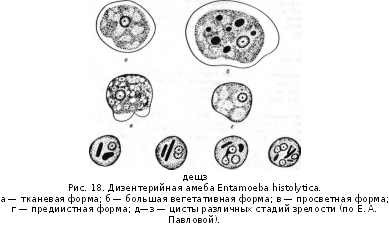
больного человека. Большая вегетативная форма (forma magna) длиной от 30—40 до 60—80 мкм обладает подвижностью и способностью к фагоцитозу эритроцитов (трофозоит-эритрофаг). Эта форма паразита обнаруживается только при кишечном амебиазе в свежевыде-ленных фекалиях больного человека.
Просветная форма амебы (forma minuta, или просветный трофо-зоит Е. histolytica) имеет меньшую длину (до 15—20 мкм) и обладает малой подвижностью. Эта форма амебы обитает в просвете толстой кишки и обнаруживается в испражнениях реконвалесцентов острого кишечного амебиаза, при хроническом рецидивирующем течении болезни и иногда у носителей амеб (после приема слабительного). Предцистная форма длиной 12—20 мкм, малоподвижная, обнаруживается в кале реконвалесцентов острого кишечного амебиаза и у носителей амеб после приема слабительного.
Трофозоиты амеб не стойки во внешней среде, в фекалиях больного погибают через 30 мин.
Стадия покоя Е. histolytica существует в виде цист различной степени зрелости. Зрелые 4-ядерные цисты имеют округлую форму и диаметр до 9—14 мкм и являются инвазионными. Цисты обнаруживаются в кале у носителей амеб, реконвалесцентов острого кишечного амебиаза, у больных хроническим рецидивирующим амебиазом в стадии ремиссии.
При попадании зрелых цист в тонкую кишку человека происходит разрушение их оболочек, и из них выходит четырехъядерная материнская форма амебы, при делении которой образуются 8 одноядерных амеб. При благоприятных условиях амебы размножаются, превращаясь в просветные трофозоиты, которые обитают в проксимальных отделах толстой кишки и, попадая при пассаже кишечного содержимого в дистальные отделы кишки, трасформируются в пред-цистные стадии и далее в цисты. Цисты отличаются высокой устойчивостью к факторам внешней среды. Во влажных фекалиях при температуре 17—20 "С и в воде, свободной от бактериальной сапрофитной флоры, они не утрачивают жизнеспособности около 1 мес, в затемненной и увлажненной почве — до 8 дней. В охлажденных пищевых продуктах, на фруктах, овощах, предметах домашнего обихода цисты способны жить несколько дней. Губительное действие на цист оказывает высокая температура. Воздействие низкой температуры (до -20—21 °С) цисты переносят несколько месяцев. Высушивание цист губит почти мгновенно.
Обычные дезинфицирующие вещества в зависимости от химического состава и концентрации по-разному действуют на цист: 5 % раствор формалина и 1 % раствор хлорамина не оказывают на них заметного отрицательного влияния; в растворе сулемы (1:1000) цисты погибают в течение 4 ч, в растворе крезола (1:250) — через 5—15 мин. Раствор эметина слабой концентрации (1: 5 000 000) оказывает на цист губительное действие.
Эпидемиология. Амебиаз — антропонозный кишечный протозооз. Источником инвазии является человек, выделяющий четырехъядер-ные цисты Е. histolytica в окружающую среду. Эпидемиологически наиболее опасны носители амеб, затем реконвалесценты острого кишечного амебиаза и больные хроническим рецидивирующим амебиазом в стадии ремиссии. Выделение цист инвазированными лицами может продолжаться многие годы, а за сутки один носитель амеб способен выделять с фекалиями 300 млн цист и более. Больные с острыми проявлениями кишечного амебиаза, выделяющие с фекалиями преимущественно вегетативные формы паразита, нестойкие во внешней среде, эпидемиологической опасности не представляют.
Механизм передачи инфекции фекально-оральный. Возможны различные пути распространения амебиаза — пищевой, водный, контактно-бытовой. Факторами передачи возбудителя чаще являются пищевые продукты, особенно овощи и фрукты, реже — вода, предметы домашнего обихода, белье, посуда, игрушки, дверные ручки и т. д. В условиях антисанитарии возможно заражение при непосредственном (прямом) контакте с цистовыделителем. Рассеиванию цист амеб способствуют синантропные мухи и тараканы. В кишечнике этих насекомых цисты Е. histolytica сохраняют жизнеспособность до 48-72 ч.
Болеют амебиазом все возрастные группы населения обоего пола, но преимущественно мужчины в возрасте 20—50 лет, люди с низким уровнем материального обеспечения и живущие в плохих санитарно-гигиенических условиях. Особо восприимчивы к амебиазу женщины в III триместре беременности и послеродовом периоде (что связано, вероятно, с особенностями клеточного иммунного ответа у беременных), а также лица, получившие иммунодепрессивную терапию.
Амебиазу свойственна спорадическая заболеваемость, возможность эпидемических вспышек ставится под сомнение. Заболевания регистрируются круглогодично, с максимумом в жаркие месяцы, когда механизм передачи реализуется с наибольшей полнотой, а сопротивляемость организма снижена в связи с перегреванием, нарушением водно-электролитного обмена и др.
Инвазия Е. histolytica встречается во всех странах мира, но самая высокая заболеваемость имеет место в районах тропического и субтропического климата, особенно в странах Центральной, Южной и Юго-Восточной Азии и Африки. В Россию возможен занос амебиаза из этих стран и южных стран бывшего Советского Союза. Заболеваемость амебиазом повсюду значительно ниже частоты носительства дизентерийной амебы.
Патогенез и патологоанатомическая картина. У большинства инвазированньгх просветные трофозоиты амеб мо гут долгое время обитать в кишечнике, не вызывая заболевания. При неблагоприятных условиях (снижение сопротивляемости ор га-низма, дефицит пищевого белка, дисбактериоз, сопутствующие инфекционные или воспалительные заболевания кишки и др.) амебы внедряются в стенку кишки, где размножаются. В патогенезе амебиаза большое значение имеет степень вирулентности штаммов возбудителя. Штаммы с более высокой вирулентностью чаше выделяются от больных кишечным амебиазом, чем от бессимптомных цистовыделителей. Существенное значение принадлежит также микробному пейзажу в кишечнике. Некоторые виды бактерий способствуют внедрению амеб в ткани, их присутствие в толстой ки шке является фактором, способствующим возникновению заболевания.
Непосредственный контакт Е. histolytica с ки шечными эпителиальными клетками реализуется посредством паразитарного белка (субъединицы с молекулярной массой 170 кДа). Разрушение клеток и проникновение трофозоитов в стенку ки ш-ки обеспечиваются прямым действием собственных ферментов амеб, в частности Са++-зависимой фосфолипазы А, колла-геназы, обладающих протеолитической активностью и низкими значениями рН в паразитарных эндоплазматических везикулах. Паразитарные протеиназы приводят к дезинтеграции клеточного экстрацеллюлярного матрикса и тканевых структур. В атакованных амебами клетках повы шается уровень ионизированного кальция, что способствует развита ю клеточного некроза, опережающего апоптоз клеток. В генезе инвазии большое значение имеет способность амебных протеиназ к деградации секреторного IgA и IgG, что препятствует связыванию последних с поверхностью трофозоитов.
В связи со способностью амеб лизировать нейтрофилы, в очагах амебного поражения эти клетки обнаруживаются редко, а воспалительная инфильтрация вокруг очагов поражения слабо выражена. Продукты распада лейкоцитов являются дополнительными факторами разрушения тканей.
Патологический процесс при кишечном амебиазе в основном локализуется в слепой и восходящей ободочной кишке. Иногда поражается прямая кишка, еще реже — другие отделы кишечника. Цитолиз эпителия и некроз тканей в кишечнике приводят к образованию язв.
В типичных случаях ранняя стадия кишечного амебиаза проявляется гиперемией и отеком слизистой оболочки, возникновением на ней мелких эрозий и возвышающихся узелков с желтой точкой на вершине. Узелки заполнены детритом и содержат трофозоиты-гематофаги Е. histolytica. Разрушение узелков вследствие некроза приводит к образованию язв. Величина язв колеблется от нескольких миллиметров до 2— 2,5 см в диаметре. Язвы, имеющие вид колб, отличаются набухшими подрытыми краями; они окружены зоной гиперемии и разобщены участками здоровой ткани (рис. 19; см. цв. вклейку). Глубокое дно язв, достигающее подслизистой основы, покрыто гноем. В толще ткани и дна язв обнаруживаются тканевые трофозоиты с фагоцитированными эритроцитами.
При тяжелом течении кишечного амебиаза, сопровождающемся распадом тканей, под слизистой оболочкой возникают синусы, которые, соединяясь, образуют обширные язвы с неправильной формы краями. Углубление язв до мышечной и серозной оболочек может вызвать перфорацию кишечной стенки и развитие гнойного перитонита — осумкованного или чаще диффузного. Заживление и рубцевание глубоких язв приводит к стенозу толстой кишки с развитием частичной и полной непроходимости. Глубокие изъязвления стенки кишки обусловливают появление кишечных кровотечений.
Гематогенная диссеминация трофозоитов-гематофагов вызывает развитие внекишечного амебиаза с формированием очагов некроза («абсцессов») в печени, легких, головном мозге и других органах. Длительный, хронически протекающий кишечный амебиаз может послужить причиной образования кист, полипов и амебом. Амебомы представляют собой опухолевидные образования в стенке толстой кишки, состоящие из грануляционной ткани, фибробластов и эозинофильных лейкоцитов. Для хронического амебиаза характерно развитие свищей между кишкой и соседними органами (мочевой пузырь, мочеточники, влагалище), между абсцессом печени и полостями плевры и перикарда, кожных свищей. Нарушение функции печени может быть обусловлено перифлебитом воротной вены и портальным фиброзом, относящимися к пастинвазии.
В процессе инвазии к различным протеинам Е. histolytica вырабатываются антитела, которые могут быть обнаружены в сыворотке крови больных уже с 7-го дня заболевания, в особенности антитела к 170 кДа протеинам амебы (у 95 % больных), и сохраняются у реконвалесцентов до 10 лет. В крови, слюне и фекалиях больных обнаруживаются секреторные anti-lectine-IgA.
Клиническая
картина. Различают
три основные формы клинически
манифестного амебиаза: 1) кишечный
амебиаз; 2) внекишечный амебиаз, 3) кожный
амебиаз (рис. 20).
Кишечный амебиаз, или амебная дизентерия—основная и наиболее частая клиническая форма инфекции.
Инкубационный период продолжается от 1—2 нед до 3 мес и дольше. Заболевание может протекать в тяжелой, средней тяжести и легкой форме.
При остром кишечном амебиазе самочувствие больных остается удовлетворительным длительное время, интоксикация не выражена, температура тела нормальная или субфебрильная. Лишь у небольшой части больных появляются общая слабость, быстрая утомляемость, головные боли, снижение аппетита, чувство тяжести в эпигастрии, иногда кратковременные боли в животе, метеоризм. Кардинальным симптомом кишечного амебиаза является расстройство стула. В начальный период стул обильный, каловый, с прозрачной слизью, 4—6 раз в сутки, с резким запахом. Затем частота дефекации возрастает до 10—20 раз в сутки, стул теряет каловый характер, представляет собой стекловидную слизь. Позже примешивается кровь, что придает испражнениям вид малинового желе. В острой форме болезни возможны постоянные или схваткообразные различной интенсивности боли в животе, усиливающиеся при дефекации. В случае поражения прямой кишки появляются мучительные тенезмы. Живот мягкий или слегка вздут, болезненный при пальпации по ходу толстой кишки.
При эндоскопическом исследовании толстой кишки обнаруживаются язвы величиной от 2 до 10—20 мм в диаметре, чаше всего на вершинах складок. Язвы имеют отечные, набухшие, подрытые края; дно может достигать подслизистой основы, покрыто гноем и некротическими массами. Язва окружена зоной (пояском) гиперемии. Слизистая оболочка, свободная от язв, выглядит малоизмененной, практически нормальной, но иногда могут определяться ее небольшая отечность и гиперемия.
Ирригоскопия выявляет неравномерное заполнение отделов толстой кишки, наличие спазма и быстрого опорожнения кишечника.
Острые проявления кишечного амебиаза сохраняются обычно не более 4—6 нед. Затем без этиотропного лечения чаще всего происходит улучшение самочувствия и купирование колитного синдром. Ремиссия может продолжаться от нескольких недель до нескольких месяцев, вслед за ней наступает возврат всех или большинства симптомов амебиаза.
Заболевание принимает хронический характер и без специфического лечения продолжается многие годы и даже десятилетия.
Хронический кишечный амебиаз имеет рецидивирующее и непрерывное течение. При рецидивирующей форме заболевания периоды обострения чередуются с периодами ремиссии, во время которой стул оформляется, а самочувствие больных становится хорошим. При непрерывном течении периоды ремиссии отсутствуют, заболевание протекает с периодическим ослаблением или усилением клинических проявлений.
При хроническом течении кишечного амебиаза постепенно развиваются астенический синдром, дефицит белков и витаминов, снижение питания. Больные предъявляют жалобы на неприятный вкус во рту, чувство жжения и болезненность языка. Аппетит снижен или отсутствует. В период обострения частота дефекаций достигает 20—30 раз и более в сутки. Болевой синдром при этом не выражен или отсутствует совсем.
Черты лица заостряются Язык обложен белым или серым налетом. Живот обычно втянут, при пальпации безболезненный или слабо болезненный в подвздошных областях, реже по ходу всей толстой кишки.
У большинства больных выявляются симптомы поражения сердечно-сосудистой системы: лабильность пульса, тахикардия, приглушение сосудистых тонов сердца и расширение его границ. Печень при неосложненном кишечном амебиазе обычно нормальных размеров, но иногда незначительно увеличивается, при пальпации безболезненна или немного чувствительна. Размеры селезенки остаются нормальными. При длительном течении кишечного амебиаза в гемограмме обнаруживаются анемия, эозинофилия, моноцитоз, лимфоцитоз, увеличение СОЭ. В запущенных случаях нарастает истощение, развивается кахексия, от которой и наступает смерть.
Эндоскопическая картина при хроническом кишечном амебиазе разнообразна. Наряду с язвами можно обнаружить кисты, полипы, амебомы, разграничить которые при осмотре затруднительно. При рентгенологическом обследовании больного хроническим кишечным амебиазом выявляются те же, что и в острой фазе болезни, изменения, а также отсутствие гаустрации, иногда рубцовые изменения со стенозированием кишечника. Амебомы при рентгеноскопии дают дефекты наполнения и симулируют опухоли.
При кишечном амебиазе могут развиваться многочисленные осложнения, среди которых наиболее распространены пе-риколиты, перфорация стенки кишечника с последующим перитонитом, гангрена слизистой оболочки, отслойка ее (расслаивающий колит), кровотечение, острый специфический аппендицит, амебомы, стриктуры кишечника, выпадение прямой кишки и др.
Некоторые авторы считают осложнениями кишечного амебиаза все варианты внекишечной локализации амебного процесса.
Внекишечный амебиаз — одна из клинических форм инвазии. Наиболее часто встречается амебиаз печени. Он может возникнуть во время острых проявлений кишечного амебиаза или спустя несколько месяцев и даже лет. Известно, однако, что у 30—40 % больных не удается выявить в анамнезе кишечные проявления амебиаза. Более часто болеют мужчины, чем женщины (соотношение 96:4).
Амебиаз печени протекает остро, подостро и хронически. Наблюдается в двух клинических формах: в виде амебного гепатита и абсцесса печени (рис. 21; см. цв. вклейку).
Острый амебный гепатит развивается чаше всего на фоне симптомов кишечного амебиаза. В течение нескольких дней происходит равномерное увеличение печени, иногда значительное, которое сопровождается болями в правом подреберье, обычно без иррадиации. При пальпации печень несколько уплотнена и умеренно болезненна. Желтуха развивается редко. Температура тела чаще субфебрильная с периодическими подъемами до высоких цифр, но может оставаться нормальной. В гемограмме определяется умеренный лейкоцитоз.
Постоянными симптомами абсцесса печени являются увеличение печени и нередко боли с локализацией их в месте развития патологического процесса. Боли могут быть различной интенсивности, иррадиируют в правое плечо, усиливаются при глубоком дыхании, пальпации печени, перемене положения больного в постели. Температура поднимается до 39 °С и выше, температурные кривые приобретают ремиттирующий, гектический или постоянный тип. Лихорадка сопровождается ознобами; при снижении температуры наблюдается усиленное потоотделение. Выражены явления интоксикации. Характерен вид больных: исхудание, ввалившиеся щеки и глаза, заостренные черты лица, подавленность. Тургор кожи снижен, иногда кожные покровы приобретают землистый оттенок. В тяжелых случаях появляется отечность кожи, стоп и голеней.
У больных амебным абсцессом печени страдает сердечнососудистая система. Тоны сердца приглушены или глухие, максимальное и минимальное артериальное давление понижены. Пульс учащен. Иногда развивается желтуха. Живот обычно вздут, слабо участвует в акте дыхания, в правом подреберье нередко определяется мышечное напряжение. Часто выявляется пастозность подкожной клетчатки кожи грудной клетки справа. Рентгенологическое исследование выявляет высокое -стояние диафрагмы с уменьшением подвижности правого купола, при поддиафрагмальной локализации абсцесса может определяться выпот в правом плевральном синусе.
При хроническом течении амебного абсцесса печени лихорадка становится неправильной, нарастают слабость, истощение, держатся постоянно давящие боли в правом подреберье. Печень увеличена, болезненна, при локализации абсцесса на передней поверхности ее он может прощупываться в виде опухолевидного образования (до 10 см в диаметре). Абсцессы бывают одиночные или множественные, локализуются они, как правило, в правой доле печени.
В гемограмме при амебном абсцессе печени находят ней-трофильный лейкоцитоз (15—50 х 109/л) со сдвигом лейкоцитарной формулы влево, СОЭ повышена. При длительном течении развивается гипохромная анемия.
Абсцессы печени осложняются перигепатитом, под-диафрагмальным абсцессом, а при их прорыве — гнойным перитонитом, плевритом, перикардитом, медиастинитом.
Летальность при амебных абсцессах печени без специфического лечения достигает 25 % и выше.
Амебиаз легких развивается при гематогенном заносе амеб в легкие или при прорыве абсцесса печени в плевральную полость. Клинически он протекает как специфическая плевропневмония или абсцесс легкого.
При пневмонии появляются боли в груди, кашель, сухой или со скудной макротой, иногда с примесью крови. Температура тела нормальная или субфебрильная. Перкуторно выявляется притупление, аускультативно — мелкопузырчатые хрипы. Рентгенологическое исследование обнаруживает инфильт-ративные изменения в легких без признаков образования полости. В периферической крови иногда определяется небольшой нейтрофильный лейкоцитоз, СОЭ повышена.
Пневмонии отличаются вялым течением и без специфического лечения могут переходить в абсцессы легкого.
Амебные абсцессы легких, как правило, принимают хроническое течение.
Температура субфебрильная с периодическими высокими подъемами. Больные выделяют большое количество мокроты с кровью («шоколадная» мокрота, «анчоусный соус»), в которой можно обнаружить амебы. Развиваются язвенный ларингит и трахеит.
Рентгенологически определяется полость в пораженном легком с горизонтальным уровнем содержащейся в ней жидкости.
Абсцессы легких приводят иногда к гнойному плевриту, эмпиеме, пиопневмотораксу, перикардиту, печеночно-легоч-ным свищам и др.
Амебы из кишечника могут гематогенно проникать в головной мозг, где возможно возникновение амебных абсцессов с развитием очаговых и общемозговых симптомов.
У больных отмечаются сильные головные боли, тошнота, рвота; температура тела субфебрильная или нормальная. Неврологическая симптоматика зависит от локализации абсцессов и степени поражения мозговых центров. Прижизненная диагностика затруднена.
Описаны амебные абсцессы селезенки, почек, женских половых органов с соответствующей симптоматикой.
Амебиаз кожи в подавляющем большинстве случаев является вторичным процессом. На коже главным образом перианальной области, промежности и ягодиц появляются эрозии и(или) язвы. Амебные язвы могут образовываться вокруг гнойных свищей печени или вблизи операционных швов после вскрытия амебных абсцессов.
Язвы глубокие, малоболезненные, с почерневшими краями, издают неприятный запах. В соскобе из язв обнаруживаются вегетативные формы амеб.
Прогноз. При отсутствии специфической терапии серьезный, при несвоевременной диагностике внекишечного амебиаза — плохой. При раннем распознавании и правильной терапии амебиаза прогноз благоприятный.
Диагностика. В диагностике амебиаза имеют значение тщательно собранный эпидемиологический анамнез, анамнез заболевания, данные клинического обследования больных.
Дифференциальный диагноз кишечного амебиаза проводится с другими протозойными инфекциями, дизентерией, неспецифическим язвенным колитом, раком кишечника, а при амебном абсцессе печени — с гнойными ангиохолитами, раком желчных путей, иногда с малярией, висцеральным лейшманиозом, тифо-паратифозными заболеваниями.
При абсцессах в легких следует иметь в виду туберкулез, абсцедирующие пневмонии другой этиологии.
Помогают распознаванию ректороманоскопия и биопсия слизистой оболочки кишки, рентгенологическое исследование. При поражении печени с диагностической целью прибегают к сканированию, УЗИ, компьютерной томографии (КТ), гепатолиенографии, лапароскопии, лапаротомии, пункции абсцесса под контролем УЗИ или КТ.
При амебиазе легких важное значение имеет рентгенография. Однако инструментальные методы не всегда позволяют дифференцировать амебиаз от других причин деструктивного поражения органов.
Решающим для диагноза амебиаза является обнаружение трофозоитов-гематофагов Е. histolytica в испражнениях, в мокроте, содержимом абсцессов, материале из дна язв, полученном путем соскоба, забора кюреткой, аспирации и т. д. Выявления просветных трофозоитов и цист Е. histolytica в кале недостаточно для окончательного диагноза, так как оно может наблюдаться в случаях носительства амеб или в период ремиссии хронического кишечного амебиаза.
Исследуют свежеполученный кал (не позднее 10—15 мин после дефекации); иногда требуется многократное (не менее трех раз) паразитологическое изучение фекалий.
При остром амебиазе диагностическая провокация слабительными средствами противопоказана, в стадии ремиссии хронического кишечного амебиаза повторное паразитологическое изучение фекалий проводится нередко после дачи больным солевого слабительного.
Если исследование свежих испражнений на месте невозможно, их пересылают в лабораторию в консерванте.
Основным методом обнаружения амеб является микроскопия нативных препаратов испражнений. Широко используется изучение мазков, окрашенных раствором Люголя и железным гематоксилином по Гейденгайну, которые могут храниться неограниченное время. При микроскопии испражнений больных кишечным амебиазом наряду с трофозоитами амеб часто обнаруживают кристаллы Шарко—Лейдена.
Дополнительным и вспомогательным методом паразитоло* гической диагностики амебиаза может служить культивирование амеб на искусственных питательных средах с бактериями (среда Робинсона и др.).
Ценные данные для распознавания всех форм амебиаза, но особенно внекишечных и амебом, можно получить при постановке иммунологических (серологических) реакций. Так, при кишечном амебиазе иммунологические методы положительны у 60—70 % больных, при амебном абсцессе печени — не менее чем у 95 % после 7-го дня болезни. В РИГА антитела к амебам в титре 1:128 и более могут обнаруживаться у реконвалесцентов в течение 10 лет и более.
Наиболее чувствительны ИФА, РИГА, ИФМ, ВИЭФ. Высокоспецифическими тестами являются обнаружение с помощью ELISA антител к поверхностным протеинам и субъединичным антигенам, выявление в испражнениях или печеночном пунктате структурных антигенов Е. histolytica. Перспективны методы обнаружения ДНК Е. histolytica с помощью ПЦР в патологическом субстрате.
Дифференциальная диагностика. Кишечный амебиаз диф^ ференцируют от других протозойных инфекций, дизентерии, неспецифического язвенного колита, рака кишечника, а при амебном абсцессе печени — от гнойных ангиохолитов, рака желчных путей, иногда от малярии, висцерального лейшма-ниоза. При абсцессах в легких следует иметь в вицу туберкулез, абсцедирующие пневмонии другой этиологии.
Лечение. Для специфической терапии амебиаза предложено большое количество эффективных препаратов. Все они разделены на три группы.
Группа I — препараты прямого контактного действия не просветные трофозоиты амеб (прямые амебоциды), к которым относятся дилоксанида фуроат, аминозидин, хиниофон (ят-рен), дийодохин, 8-оксихинолины (интетрикс, интестопан и др.). Применяются для санации носителей амеб и терапии хронического кишечного амебиаза в стадии ремиссии.
Дилоксанида фуроат, наиболее эффективный амебоцидный препарат, применяют перорально, аминозидин — перорально на протяжении 5—10 дней.
Хиниофон (ятрен) назначают в течение 10 дней. В случае необходимости после 10-дневного перерыва проводят еще один курс лечения в течение 10 дней. Одновременно хиниофон можно применять в виде клизм (по 1—2 г препарата на стакан теплой воды).
Дийодохин (дийодогидроксихинолин) также применяется в течение 10 дней.
Тилихинол-тилброхинол (интетрикс) применяют в течение 10 дней.
Группа И — препараты, действующие на тканевые трофозоиты (тканевые амебоциды) эффективны против тканевых и просветных форм амеб, что используется в терапии острого кишечного и внекишечного амебиаза: эметина гидрохлорид, дигидроэметин, ниридазол, хингамин, тетрациклины, фторхи-нолоны.
Эметина гидрохлорид применяется внутримышечно или подкожно. Лечение проводится в стационаре под контролем ЭКГ. Менее токсичным и высокоэффективным амебоцидом является дигидроэметин, который назначают внутримышечно, подкожно или per os.
Для лечения больных с кишечным амебиазом эметин и дигидроэметин применяют в течение 5 дней, для терапии амебного процесса печени курс увеличивается вдвое — до 10 дней.
Ниридазол (амбильгар) превосходит по амебоцидному эффекту эметин и дигидроэметин. Применяется перорально в течение 7—10 дней больным кишечным и внекишечным амебиазом.
Выраженным противопротозойным действием обладает хингамин (хлорохин, делагил, ризоцин). Применяется преимущественно для лечения больных с амебными абсцессами печени, так как быстро всасывается из кишечника и концентрируется в печени в неизмененном виде. Препарат назначают перорально в течение 3 нед.
Группа III —препараты универсального действия, которые с успехом применяются при всех формах амебиаза. Важнейшим представителем группы в настоящее время является метронидазол (метрогил, флагин, трихопол). Он применяется перорально в течение 5—10 дней.
Тинидазол (фазижин) назначают в течение 3 дней. Эффективны также сикнидазол (флагентил) и орнидазол (тиберал).
Тетрациклин применяют детям старше 8 лет и взрослым при кишечном амебиазе в обычных дозах в течение 10 дней с последующим назначением йодохинола на протяжении 3 нед. Антибиотики широкого спектра действия используют как вспомогательные средства с целью изменить микробный биоценоз в кишечнике.
Больным кишечным или внекишечным амебиазом препараты II и III групп обычно назначают в сочетании или с последующим приемом фурамида либо паромомицина в течение 10 дней для уничтожения просветных форм амеб.
При абсцессах печени, легких, мозга и других органов проводят консервативную терапию, на фоне которой у большинства больных улучшение отмечается уже в первые 3 дня.
Полное разрешение процесса происходит в течение нескольких месяцев. К хирургическому вмешательству, преимущественно дренированию полости, прибегают редко — при угрозе осложнений или недостаточном эффекте противоамебной терапии. Некрэктомия может привести к диссеминации паразитов и ухудшить прогноз.
В лечении осложнений кишечного амебиаза (перфорация кишки, аппендицит, свищи, непроходимость кишки, масив-ное кровотечение) ведущее место принадлежит хирургическим методам на фоне комплексной противопаразитарной и патогенетической терапии.
При амебиазе кожи используют 10 % мазь ятрена.
Наряду с этиотропным лечением больным амебиазом в широком объеме проводится патогенетическая и симптоматическая терапия.
Профилактика. Мероприятия, направленные на источник инфекции, включают выявление и лечение цистовыделителей и носителей амеб. Мероприятия, направленные на перерыв передачи инфекции, совпадают с таковыми при острых кишечных инфекциях.
ЗАБОЛЕВАНИЯ, ВЫЗЫВАЕМЫЕ СВОБОДНОЖИВУЩИМИ АМЕБАМИ
Заболевания человека, вызываемые свободноживущими амебами, выявляются редко и наблюдаются, как правило, у им-мунокомпрометированных лиц. Общее число зарегистрированных случаев в мире не превышает нескольких сотен, однако интерес к проблеме обусловлен крайней тяжестью течения с плохим прогнозом болезни, трудностью своевременной диагностики заболеваний.
Первичный амебный менингоэнцефалит
Первичный амебный менингоэнцефалит (ПАМЭ) — инфекция, вызываемая свободноживущими амебами рода Naegle-ria и клинически характеризующаяся развитием тяжелого, почти всегда летального, гнойного менингоэнцефалита.
Исторические сведения. В 1948 г. Е. Дерик в Новой Гвинее описал поражение головного мозга, которое ретроспективно расценено как инфекция свободноживущей амебой из рода Naegleria.
Возбудитель, N. fowleri, назван по имени Малькома Фовлера (детский госпиталь в Аделаиде, Австралия), который вместе с Р. Картером в 1965 г. описал летальный случай амебного менингоэнцефалита, доказанного выделением возбудителя.
Этиология. Возбудитель — Naegleria — свободноживущие амебы из рода Naegleria, порядка Schizoperinida и реже рода Acanthamoeba, подпорядка Acanthopodina, порядка Amoeba.
Являются факультативными паразитами человека и животных. В жизненном цикле амеб различают вегетативную стадию (трофозоит) и стадию цисты. В дистиллированной воде трофозоиты спонтанно и обратимо превращаются в жгутиковые формы. Трофозоиты N. fowleri имеют размеры 10—30 мкм, крупное ядро с плотным центром, образуют псевдоподии.
Свободноживущие трофозоиты обитают в воде, влажной почве, навозе животных и т. д., питаются бактериями. В изолированных от больных трофозоитах имеются включения фагоцитированных эритроцитов, лейкоцитов. Амебы Naegleria хорошо растут в культуре тканей и на агаре в ассоциации с бактериями при оптимальной температуре 45 °С. Вегетативные формы быстро погибают от воздействия желчи, желудочного сока, сыворотки крови и всех дезинфектантов. Цисты имеют сферическую форму с диаметром 9 мкм, содержат центрально расположенное ядро и снабжены однослойной оболочкой, в которой имеются 2 поры для эксцистирования амебы. Цисты чрезвычайно устойчивы к высушиванию и замораживанию, в течение 8 мес сохраняются в воде при 4 °С, резистентны к известным дезинфицирующим средствам. Они сохраняют жизнеспособность в хлорированной воде, обнаруживаются в питьевой воде, в увлажнителях кондиционеров и пр.
Свободноживущие амебы, особенно N. fowleri, патогенны для лабораторных животных (мышей, морских свинок, кроликов, обезьян); при парентеральном заражении у них, как правило, развивается летальная генерализованная инфекция.
Эпидемиология. Изучена недостаточно. Роль животных и человека как источников инфекции не выяснена. Большинство описанных случаев заражения ПАМЭ было связано с купанием в естественных (пруды, небольшие озера) и искусственных (водохранилища) водоемах, из которых были выделены культуры свободноживущих амеб. Возможно, фактором передачи инфекции могут быть загрязненные почвой руки. Описаны случаи заражения воздушным путем при вдыхании пыли с цистами неглерии.
Заражение через рот и передача инфекции от больного к здоровому не доказаны и отрицаются.
Восприимчивость к инвазии не высока: среди миллионов людей, купающихся в открытых водоемах, наблюдаются единичные заболевания. У людей молодого возраста в эндемичных районах выявлены положительные серологические тесты, что свидетельствует о наличии бессимптомных форм инвазионного процесса.
Большая часть случаев ПАМЭ выявлена в теплое время года (сезон купания) с максимумом в июле—августе в Северном полушарии и январе—марте в Южном. Болеют преимущественно дети и лица молодого возраста. Заболеваемость обычно спорадическая или носит характер небольших групповых вспышек.
Инвазия зарегистрирована почти на всех континентах. Наибольшее число больных (почти половина известных случаев) выявлено в США, Австралии и Новой Гвинее, Чехии, Словакии, единичные случаи зарегистрированы в Англии, Бельгии, Индии, Новой Зеландии и Африке. Не исключено, что истинная заболеваемость выше регистрируемой.
Патогенез и патологоанатомическая картина. Патогенез инфекции изучен мало. Заболевание возникает после купания в открытом водоеме у исходно здоровых людей различного, но чаще молодого возраста. При моделировании на лабораторных животных установлено, что N. fowleri внедряются через микротравмы на слизистой оболочке носоглотки, откуда они по обонятельным нервам через решетчатую кость проникают в головной мозг, где размножаются преимущественно в сером веществе. Очень быстро развивается диффузное гнойное воспаление серого вещества мозга и его оболочек. При патолого-анатомическом исследовании выявляются фибринозно-гной-ный экссудат на поверхности головного мозга, отек, очаговые кровоизлияния и инфильтрация в тканях мозга и мозжечка. Цистерны основания мозга и вентральные участки обонятельных луковиц часто разрушены. Патологический процесс захватывает поверхностный кортикальный слой серого вещества больших полушарий и базальные ганглии.
Выявляются очаги дегенерации нейронов и демиелиниза^ ции. Трофозоиты N. fowleri в большом количестве обнаруживаются в менингеальной экссудате, цереброспинальной жидкости, в сером веществе мозга, мозжечке, в волокнах обонятельных нервов и периваскулярном пространстве малых и средних артерий и артериол.
На вскрытии определяются также отек легких, пневмония, миокардит, которые не имели клинической манифестации и ввиду отсутствия в тканях трофозоитов N. fowleri считаются неспецифическими. Предполагается, однако, что в терминальной стадии у резко ослабленных сопутствующей патологией больных возможна генерализация амебного процесса с поражением всех или большинства внутренних органов.
Клиническая картина. Инкубационный период (от купания до начала болезни) составляет обычно 3—7 (от 2 до 14) дней.
Заболевание развивается, как правило, внезапно на фоне полного здоровья. Появляются (не всегда) симптомы поражения верхних дыхательных путей — боли и сухость в горле, затем возникают сильные головные боли, повышается температура тела. К указанным симптомам быстро присоединяются рвота, ригидность затылочных мышц и затем потеря сознания. При объективном исследовании выявляются все признаки менингита, клинически протекающего как бактериальный гнойный менингит, иногда в сочетании с очаговой симптоматикой, обусловленной развитием энцефалита.
Течение заболевания бурное и катастрофическое: на 2—7-й день болезни, как правило, наступает смерть, нередко до развития явных симптомов энцефалита и полиорганных поражений. В гемограмме выявляется высокий нейтрофильный лейкоцитоз. При люмбальной пункции определяется повышенное давление цереброспинальной жидкости, которая нередко имеет геморрагический вид, в ней выявляется выраженный нейтрофильный плеоцитоз (от 40 до 26 ООО клеток в 1 мкл) и увеличение содержания белка при отсутствии бактерий. При микроскопии влажных препаратов цереброспинальной жидкости нередко обнаруживаются подвижные трофозоиты N. fowleri, быстро разрушающиеся при окрашивании по Граму.
Прогноз. Плохой, летальность превышает 90 %.
Диагностика. Прижизненное распознавание инвазии затруднено, диагноз в большинстве описанных случаев установлен посмертно. В диагностике следует учитывать эпидемиологические данные, указывающие на факт купания больных в пресноводных водоемах за несколько дней до заболевания. Клиническая диагностика трудна из-за большого сходства клинической картины ПАМЭ с бактериальными гнойными менингоэнцефалитами.
Для паразитологического подтверждения диагноза жидкость и кусочки тканей головного мозга, полученные при аутопсии, высевают на агар, заселенный бактериями.
Используются также культуры тканей, применяется метод интрацеребрального заражения мышей патологическим материалом, полученным от больных или взятым при вскрытии трупов. Разработаны серологические методы диагностики ПАМЭ, наибольшую ценность имеют НРИФ, ИФА. Современные методы диагностики основаны на применении моно-клональных антител, изучения изоэнзимного спектра трофозоитов, ПЦР.
Лечение. Терапия больных первичным амебным менинго-энцефалитом разработана недостаточно. Амебоцидные препараты практически неэффективны.
Обнадеживающие результаты получены при внутривенном применении амфотерицина В (фунгизон или лучше амбизом). Получен клинический эффект от применения миконазола, рифампицина, сульфаметоксазола.
В эксперименте показана эффективность препаратов группы артемизинина.
Положительный эффект может оказать применение иммунной анти-Naegleria сыворотки или моноклональных антител.
Профилактика. Меры борьбы с заболеванием в деталях не известны. Профилактическим мероприятием является запрещение купания в природных водоемах, где обитают амебы родов Naegleria, а также тщательное гигиеническое содержание плавательных бассейнов, контроль за кондиционерами.
Гранулематозный амебный энцефалит
Гранулематозный амебный энцефалит (ГАмЭ) — протозой-ное заболевание, характеризующееся прогрессирующим гранулематозно-деструктивным поражением головного
Iмозга, возникающее преимущественно у иммунокомпроме-тированных людей вследствие инвазии свободноживущими амебами рода Acanthamoeba и Balamuthia mandrillaris.
Исторические сведения. В. mandrillaris были впервые выделены из воды природных водоемов врайоне Телса (Оклахома, США). Первые случаи ГАмЭ, вызванного этими амебами, описаны в 1990 г. ГАмЭ акантамебной природы впервые описали в 1995 г. Дж. Сизон и др., Ловичик и Дж. Сейгел среди умственно отсталых лиц в США.
Этиология. Возбудители — свободноживущие амебы рода Acanthamoeba: A. castellanii, A culbertsoni, A. healyi (A. astronyxis), A. poly-phaga, A. palestinensis, A. hatehetti, A. rhysodes, A divionesis, а также Balamuthia mandrillaris, относятся к подпорядку Acanthopodina, порядку Amoeba. Вегетативная стадия (трофозоит) Acanthamoeba имеет размеры 14—40 мкм, содержит 1 ядро с ядрышком, на плазматической мембране имеются тонкие гребешки. Цисты, диаметром 12— 16 мкм, закючены в двойную оболочку с двумя порами.
Трофозоит Balamuthia mandrillaris имеет размеры около 30 (12— 60) мкм, содержит 1 ядро. Цисты, диаметром 15 (6—30) мкм, имеют трехслойную оболочку. Акантамебы являются аэробами, размножаются при температуре 25—35 °С.
Эпидемиология. В естественных условиях Acanthamoeba и В. mandrillaris обитают в воде, почве и в воздухе в различных регионах мира. Простейшие часто выявляются в носоглотке здоровых людей.
Обнаружение серопозитивных результатов у населения различных регионов свидетельствует о широком распространении простейших.
Возбудители проникают в организм человека через кожу и слизистые оболочки при купании в открытых водоемах или при контакте с почвой. Наибольшей восприимчивостью к инвазии обладают умственно отсталые или психически больные лица, а также иммуноком-прометированные люди — больные сахарным диабетом, ВИЧ/ СПИДом, внутривенные потребители психоактивных веществ, хронические алкоголики, реципиенты трансплантатов костного мозга и других тканей, больные, получающие противоопухолевые и иммуно-супрессивные препараты. В редких случаях наблюдаются заболевания иммунокомпетентных лиц.
Инвазия распространена повсеместно. Описано около 200 верифицированных случаев заболеваний, вызванных акантамебами, и около 70 заболеваний, вызванных В. mandrillaris, из них полги половина — в США, а также в Центральной Америке, Южной Австралии, Новой Зеландии, странах Европы, Африки.
Патогенез и патологоанатомическая картина. В месте внедрения Acanthamoeba нередко возникают торпидно развивающиеся воспалительные очаги (язвенные поражения кожи, синуситы, пневмония). Это позволяет предположить возможность гематогенной диссеминации простейших с их внедрением в головной мозг и другие органы (легкие, лимфатические узлы, кожу и др.). Наибольшие повреждения развиваются в головном мозге. В среднем мозге, стволе и в мозжечке образуются очаги гранулематозного воспаления, в которых обнаруживаются многоядерные клетки, скопления лимфоцитов, макрофагов. Вокруг гранулем определяются участки некроза ткани мозга. В периваскулярном пространстве выявляются трофозоиты и цисты амеб, что косвенно подтверждает гематогенное распространение возбудителей в ткани мозга.
При макроскопическом изучении определяется выраженный отек головного мозга, кровоизлияния в ткань мозга и мозговые оболочки, ущемление мозжечка. В генезе клеточных поражений большая роль отводится эффекту паразитарных протеаз и других цитолитических факторов и накоплению в цитоплазме клеток свободного кальция.
Инвазия В. mandrillaris развивается как среди иммуно-ком-прометированных, так и иммунокомпетентных лиц. В месте внедрения амеб часто формируются первичные воспалительные очаги, обеспечивающие в дальнейшем гематогенную дис-семинацию паразитов. В ткани головного мозга возникают очаги подострого гранулематозного воспаления, в которых обнаруживаются скопления макрофагов, лимфоцитов, плазмо-цитов, гигантских многоядерных клеток. Характерен ангиит с периваскулярной локализацией трофозоитов и цист. В процесс вовлекаются участки мозговых оболочек, прилегающие к очагу воспаления в ткани мозга.
Клиническая картина. Инкубационный период достоверно не установлен.
Гранулематозный энцефалит, вызываемый Acanthamoeba, начинается постепенно с развития головной боли, невысокой температурной реакции, которые вначале связывают с осложнениями основного заболевания (сахарный диабет, ВИЧ/СПИД, трансплантационная болезнь, внутривенное введение наркотиков и др.). В дальнейшем появляются симптомы очагового пра-жения головного мозга (у 85 % больных), судороги и гемипаре-зы (70 и 55 % соответственно), почти у половины больных — менингеальный синдром, у 1/А пациентов отмечается растройст-во зрения и у '/5 - признаки арахноидита головного мозга. Могут выявляться воспалительные очаги в легких, лимфадено-патия, синуситы, подкожные абсцессы. Прогрессирование проявлений энцефалита приводит к летальному исходу в течение 7—120 дней от начала неврологической симптоматики.
У многих больных за несколько недель до развития симптомов энцефалита появляются язвы на коже и подкожные абсцессы, в биоптатах из которых обнаруживаются Acanthamoeba, что может позволить провести необходимое лечение.
Очаговый энцефалит, вызванный В. mandrillaris, характеризуется постепенным развитием клинических проявлений на фоне умеренной лихорадки, головной боли, рвоты, судорог, прогрессирует в течение нескольких недель или месяцев, напоминая картину опухолевого поражения мозга, гидроцефалии.
Изменения в гемограмме не характерны. В цереброспинальной жидкости определяется умеренно выраженный лим-фоцитарный плеоцитоз (при инвазии акантамебами 500—800 клеток в 1 мкл и при инвазии В. mandrillaris 50—100 клеток), гиперпротеиноррагия и выраженная гипогликоррагия.
Компьютерная томография выявляет множественные некротические очаги в корковых отделах мозга, мало отличимые от опухолевых, туберкулезных и токсоплазмозных поражений.
Прогноз неблагоприятный.
Диагностика. В большинстве случаев диагноз устанавливается посмертно.
В клинике гранулематозный амебный энцефалит может быть заподозрен при развитии картины очагового асептического менингоэнцефалита у иммунокомпрометированных или умственно отсталых больных. Большое значение имеет обнаружение амеб в очагах поражения кожи, воспалительном экссудате придаточных пазух носа, которые возникают у пациентов задолго до неврологических расстройств. В спинномозговой жидкости простейшие не выявляются. Показано диагностическое значение биопсии очагов поражения головного мозга. Возможно культивирование Acanthamoeba на кровяном агаре или на агаре с живыми микроорганизмами (P. aeruginosa, Е. coli, Е. larogenes и др.).
В. mandillaris культивируются на аксенических клеточных культурах.
Разработаны методы диагностики В. mandrillaris с помощью моноклональных антител.
Лечение. Терапия ГАмЭ не разработана. В отдельных наблюдениях получен положительный эффект от применения сульфаниламидов в сочетании с триметопримом (кортим), диамидиновых производных (пентамидина и др.), ивермекти-на, амфотерицина В.
Профилактика заключается в запрете на купание в открытых водоемах лицам из групп высокого риска заражения (иму-нокомпрометированные люди и умственно отсталые индивидуумы).
БАБЕЗИОЗ
Син. — пироплазмоз.
1Бабезиоз (Babesiosis) — зоонозный трансмиссивный прото-зооз, протекающий с развитием лихорадочных приступов и гемолитической анемии.
Исторические сведения. Первые случаи заболевания человека описаны в 1957 г. в Югославии, затем в 1969 г. в Эйре. Случаи инвазии пироплазмами грызунов у человека были ранее описаны в 1966 г. и в
1974 г. в США. В России первое описание бабезиоза опубликовано С. А. Рабиновичем в 1978 г.
Этиология. Возбудители — паразитические простейшие Babesia di-vergens и В. microti, относятся к царству Animalia, полцарству Protozoa, типу Apicomplexa, классу Sporozoea, подклассу Coccidia, отряду Eucoccidiida, подотряду Piroplasmia, порядку Piroplasmida, роду Babesia. Паразиты имеют грушевидное тело, при окраске по Романовскому—Гимзе обнаруживают бледно-голубого цвета цитоплазму и руби-ново-красное ядро, напоминая малярийные плазмодии (в особенности P. falciparum), отличаются от последних отсутствием пигмента. Бабезии паразитируют в эритроцитах, вызывая их разрушение.
Эпидемиология. Бабезиоз — трансмиссивный зоонозный прото-зооз.
Резервуаром паразитов служат различные животные: рогатый скот для В. divergens в Восточной Европе и России, грызуны для В. microti в Северной Америке.
Заражение человека происходит трансмиссивным путем через укус клещей Ixodes dammini, в редких случаях возможно заражение в процессе гемотрансфузии. Наиболее восприимчивыми к инвазии являются пациенты с осложненным преморбидным фоном, особенно лица со спленэктомией.
Патогенез и патологоанатомическая картина продолжают изучаться. Показана высокая чувствительность к В. divergens спленэктомированных людей, тогда как В. microtus могут паразитировать в эритроцитах пациентов с благополучным преморбидным статусом.
Клиническая картина. Заболевание протекает с симптомами, напоминающими малярию, и характеризуется приступообразной высокой лихорадкой, прогрессирующей гемолитической анемией, в тяжелых случаях, преимущественно на фоне спленэктомии, может развиться гемоглобинурия с почечной недостаточностью. Более доброкачественно протекает инвазия В. microti.
Прогноз у большинства больных благоприятный.
Диагностика. Решающим в распознавании болезни является обнаружение бабезий в препаратах периферической крови (мазок и толстая капля), окрашенных по Романовскому—Гимзе. Возможна изоляция паразитов при заражении кровью больных лабораторных животных (хомячков для В. microti и телят для В. divergens). Разработаны методы серологической диагностики с использованием МФА (метод флюоресцирующих антител), обнаруживающий антитела в титре до 1:1024.
Лечение. Эффективная этиотропная терапия не разработана. Обычно применяют противомалярийные средства, в частности хлорохина дифосфат, который назначают взрослым в течение 3—5 дней. Эффективны хинина сул ьфат в сочетании с клиндамицином внутривенно или перорально в течение 7— 10 дней или атоваквон в сочетании с азитромицином в течение 5—7 дней. На фоне приема препаратов отме чается снижение температуры тела, но паразиты могут сохраняться в эритроцитах в течение нескольких недель.
Профилактика. Включает комплекс ветеринарных мероприятий и методы защиты от нападения иксодовых клещей. •
КРИПТОСПОРИДИОЗ
Криптоспоридиоз (Cryptosporodiosis) — зоонозный кишеч-, ный протозооз, проявляющейся преимущественно синдромами водянистой диареи, мальдигестии и мальабсорбции, приводящими к обезвоживанию и потере массы тела.
Исторические сведения. Впервые криптоспориций выделил Е. Ти-зер (1907) на гистологических срезах желудка мышей. В последующем были описаны вызванные криптоспорщиями заболевания змей, индеек, кроликов, затем у телят. В 1976 г. Ф. Найм и соавт. описали вызванную криптоспоридиями диарею у американской 3-летней девочки.
В 1984 г. Т. Навин и Д. Яранек отметили преобладание иммуно-компрометированных пациентов (40 человек) среди описанных 58 больных криптоспоридиозом.
Этиология. Возбудитель — Cryptosporidium parvum, единственный патогенный для человека представитель рода Cryptosporidium, относящегося к классу Sporozoea, подклассу Coccidia, имеет мелкие размеры (2—6 мкм), окрашивается по Романовскому—Гимзе. С. parvum паразитируют на поверхности эпителиоцитов пищеварительного тракта позвоночных животных и человека, отграничиваясь от клеточной цитоплазмы двойной оболочкой. В связи с этим криптоспорщии рассматриваются как внутриклеточные экстрацитоплазматические паразиты. В редких случаях криптоспорщии поражают эпителий дыхательных путей. В организме хозяина криптоспорщии, как и другие кокцидии, последовательно проходят бесполую и половую стадии цикла развития, продолжительность которого составляет 4—7 сут.
Возбудитель проникает в организм хозяина в результате заглатывания толстостенных ооцист, содержащих 4 спорозоита. Последние после высвобождения достигают эпителиальных клеток, на поверхности которых превращаются в трофозоиты, отделенные от клеточной цитоплазмы двойной оболочкой, сформированной за счет клетки. Трофозоиты проходят бесполое размножение (шизогония) с образованием шизонтов, содержащих 8 мерозоитов 1-го типа. Последние проникают в новые эпителиальные клетки, в которых шизогония повторяется, что приводит к увеличению численности паразитов. После нескольких подобных циклов шизогонии мерозоиты 1-го типа образуют шизонты, содержащие 4 мерозоита 2-го типа, которые трансформируются в мужские (микрогаметоциты) и женские (макро-гаметоциты) половые клетки. Оплодотворение последних формирует зиготы, которые превращаются в ооцисты, содержащие спорозоиты (спорогония). Большая часть (около 80 %) ооцист представлена толстостенными ооцистами, выделяющимися с испражнениями или иногда с глоточной слизью во внешнюю среду, где они могут сохраняться в течение длительного времени.
Толстостенные ооцисты устойчивы к различным дезинфектантам. Меньшая часть ооцист (20 %) является тонкостенными, они высвобождают заключенные в них спорозоиты в просвет кишки, обусловливая аутосуперинвазию и длительное паразитирование криптоспо-ридий в организме хозяина.
Эпидемиология. Криптоспоридиоз — зоонозная кишечная инвазия.
Основным источником инвазии для человека являются домашние животные, особенно молодняк: телята, поросята, ягнята, молодые кошки и собаки, а также другие животные (грызуны, птицы и др.), инфицирующие воду, почву и другие объекты внешней среды. В редких случаях источником возбудителей может служить инвазирован-ный человек.
Механизм заражения человека — фекально-оральный. Факторами передачи возбудителей служат вода, пища, в том числе молоко. Аэрозольный механизм передачи не установлен, а поражение криптоспоридиями органов дыхания чаще всего обусловлено забросом возбудителя в дыхательные пути с рвотными массами. Поражение эпителия урогенитального тракта возникает при инфицировании кишечным содержимым восходящим путем. Возможно заражение от больного человека контактно-бытовым путем через общие предметы обихода.
Восприимчивость к криптоспоридиозу невысокая. Контингента-ми высокого риска заражения являются ветеринары, животноводы, рабочие мясокомбинатов и мясобоен. С. parvum является одним из возбудителей «диареи путешественников». Чувствительность к инвазии значительно увеличивается у иммунокомпрометированных лиц, в связи с чем могут возникать случаи нозокомиальной инвазии криптоспоридиями. Криптоспоридиоз распространен повсеместно, но чаще отмечается в тропических странах. Заболевание нередко возникает при посещении различных стран в условиях нарушенного санитарно-гигиенического режима.
Патогенез и патологоанатомическая картина. Возбудитель проникает в организм в виде толстостенных ооцист с 4 споро-зоитами, из которых образуются трофозоиты, повреждающие эпителиоциты желудка, тонкой и толстой кишки, вызывающие укорочение и уплощение микроворсинок, рас ширение крипт. Развивается выраженная мононуклеарная инфил ьтрация lamina propria слизистой оболочки пищеварительного тракта. Увеличение численности популяции трофозоитов в результате шизогонии с образованием мерозоитов 1-го типа и аутоинвазии тонкостенными ооцистами обусловливает колонизацию и повреждение паразитами различных участков пищеварительного тракта, что приводит к нарушению ферментативных процессов пристеночного пищеварения и всасывания нутриентов, повышению осмолярности химуса, развита ю массивной водянистой диареи осмолярного типа, синдромов дегидратации, деминерализации, мальдигестии и мальабсорбции.
В случаях проникновения криптоспоридий в дыхательные пути развиваются метаплазия эпителия и воспалител ьная инфильтрация слизистой оболочки, формируются очаги пневмонии.
Адекватный иммунный ответ предупреждает шизогонию мерозоитов 1-го типа и аутоинвазию тонкостенных ооцист и обеспечивает, таким образом, элиминацию паразитов.
После перенесенного заболевания развивается непродолжительный, нестойкий иммунитет.
У иммунокомпрометированных пациентов шизогония мерозоитов 1-го типа и аутосуперинвазия тонкостенными ооци-стами не контролируется, что приводит к формированию в организме больного большой популяции паразитов, вызывающих прогрессирующее поражение пищеварительного тракта и(или) органов дыхания, развитие дегидратации, мальабсорбции, кахексии и выраженного общетоксического синдрома.
Наиболее тяжелые и распространенные поражения с вовлечением различных органов возникают у больных ВИЧ/ СПИДом, в связи с чем криптоспоридиоз отнесен к группе СПИД-индикаторных оппортунистических инфекций.
Клиническая картина. Инкубационный период продолжается от 3—7 дней до 3 нед, составляя в среднем 4—14 дней.
Различают гастроинтестинальную (основную) и респираторную (редкую) формы криптоспоридиоза. Течение болезни в значительной мере определяется исходным иммунным статусом пациента.
У иммунокомпетентных пациентов развивается гастроинте-стинальная форма, которая протекает в виде субклинической инвазии или острого доброкачественного гастроэнтерита.
В манифестных случаях отмечается бурное начало болезни, характеризующееся интенсивными схваткообразными болями в мезогастрии, профузной водянистой («холероподобной») диареей 5—10 раз в день, тошнотой и нередко повторной рвотой. Температура тела нормальная или слегка повышенная. Диарея и рвота сопровождаются умеренно выраженными признаками дегидратации в виде жажды, сухости слизистых оболочек, понижения тургора кожи, тоническими судорогами мышц конечностей.
В большинстве случаев через 5—12 дней проявления болезни быстро купируются, лишь в некоторых случаях диарея и фебрильная гипертермия продолжаются в течение 4 нед.
Обострения и рецидивы не отмечены.
У иммунокомпрометированных индивидуумов (пациенты с врожденными иммунодефицитами, реципиенты органных трансплантатов, лица, подвергавшиеся лучевому лечению или иммуносупрессивной терапии, больные ВИЧ/СПИДом и др.) наряду с гастроинтестинальной может развиваться бронхоле-гочная форма, иногда с диссеминацией в другие органы.
Гастроинтестинальная форма у таких больных отличается тяжелым и продолжительным (6—8 нед и более) течением с профузной водянистой диареей (до 10—17 л/сут), повторной рвотой, нарастанием проявлений дегидратации и деминерализации.
Диарейный синдром сопровождается лихорадочной и общетоксическими реакциями. Характерна резистентность диареи к медикаментам, используемым для лечения острых кишечных инфекций. Больные быстро теряют массу тела.
Бронхолегочная форма криптоспоридиоза наблюдается редко и обычно развивается на фоне гастроинтестинальной формы у больных ВИЧ/СПИДом. Заболевание характеризуется длительной лихорадкой, распространенным лимфаденитом, мучительным кашлем с отхождением скудной слизисто-гнойной мокроты, содержащей ооцисты С. parvum, признаками выраженной дыхательной недостаточности.
Рентгенологическое исследование выявляет признаки бронхита и двусторонней интерстициальной пневмонии. При эндоскопии выявляются трахеит, бронхит, в биоптатах слизистой оболочки обнаруживается метаплазия эпителия, в клетках и бронхиальном секрете видны ооцисты криптоспоридий.
Прогноз. Гастроинтестинальная форма у иммунокомпетентных больных заканчивается выздоровлением, у половины больных ВИЧ/СПИДом в течение 6 мес наблюдается летальный исход. Бронхолегочная форма завершается смертью больных.
Диагностика. Клинический диагноз основывается на выявлении у пациентов из группы высокого риска заражения криптоспоридиями остро возникшей водянистой диареи, не купируемой общепринятыми средствами.
Дифференциальный диагноз проводят с бактериальными и вирусными кишечными инфекциями, лямблиозом, микроспо-ридиозом.
Верификация диагноза достигается обнаружением ооцист криптоспоридий в нативных мазках из испражнений или мокроты больных с использованием окраски по Романовскому— Гимзе. При отрицательных результатах используют методы обогащения. Забор материала следует производить с соблюдением мер по предотвращению случайного инфицирования.
Разработаны серологические методы диагностики криптоспоридиоза (ИФА).
Лечение. Достаточно эффективных этиотропных средств терапии криптоспоридиоза нет.
Наибольшей эффективностью обладают спирамицин, применяемый в течение 2—3 нед, и аминозидин, назначаемый также в течение 2—3 нед.
Получен положительный эффект от применения нитазок-санида в течение 3 дней. Ал- нативными средствами могут быть азитромицин, кларитромицин и рифабутин, ко-тримок-сазол.
У иммунокомпетентных пациентов возможны случаи выздоровления без применения этиотропных препаратов. Полноценная легкоусвояемая пища без грубой клетчатки (стол № 4 по Певзнеру), прием большого количества жидкости через рот достаточны для выздоровления иммунокомпетентных больных с легкой и даже средней тяжести формами криптоспоридиоза.
У лиц с иммунодефицитами любой природы, и прежде всего при ВИЧ/СПИДе, заболевание приобретает затяжное прогрессирующее течение, поэтому данной категории больных с первых дней болезни необходима этиотропная терапия спира-мицином, амнозццином или другими препаратами.
Учитывая нередкое сочетание криптоспоридиоза с лямб-лиозом или кампилобактериозом, целесообразно назначение метронидазола, тинидазола, гентамицина и других препаратов, эффективных при этих инфекциях.
Решающее значение при лечении больных с профузной диареей имеет патогенетическая терапия, направленная на восстановление водно-электролитного равновесия.
Регидратационная терапия проводится с первых часов заболевания и с учетом степени дегидратации (см. «Холера»).
Купированию диарейного синдрома у больных ВИЧ/ СПИДом способствует прием октреотица — синтетического аналога соматостатина — по 100 мг трижды в день до получения эффекта.
Больных с респираторным криптоспоридиозом, нередко сочетающимся с пневмоцистной, кандидозной, пневмококковой и другими видами инфекций, лечат антибиотиками широкого спектра действия, а также амфотерицином В, спирами-цином или азитромицином и имидазольными производными (миконазол, кетоконазол, итраконазол, флюконазол и др.).
По показаниям проводят иммунокорригирующую терапию (иммуномодуляторы, иммунозаместительное лечение — переливание лейкотромбовзвеси, назначение препаратов, содержащих колониестимулирующие факторы, введение иммуноглобулинов).
БАЛАНТИДИАЗ
Син. — дизентерия инфузорная
Балантидиаз (Balantidiasis) — кишечное зоонозное прото-зойное заболевание, характеризующееся язвенным поражением толстой кишки и симптомами общей интоксикации.
Исторические сведения. Впервые сообщение о заболевании человека балантидиазом было представлено в 1857 г. шведским врачом
П. Мальмстеном, обнаружившим балантидий в кале 2 больных, страдавших поносом. Ему же принадлежит первое описание патологоана-томической картины заболевания у человека. К 1861 — 1862 гг. относят первые находки балантидий у свиней, зараженность которых может доходить до 60—80 %.
После работы Н. Соловьева (1901), установившего внутриткане-вый паразитизм балантидий, балантидиаз был выделен в самостоятельную нозологическую форму.
Этиология. Возбудитель болезни — Balantidium coli — относится к семейству Balantididae, классу Ciliata (ресничные инфузории), типу Protozoa.
В. coli является наиболее крупным представителем паразитических простейших человека. Жизненный цикл паразита включает две стадии — вегетативную и цистную.
Вегетативная форма В. coli овальная, более узкая с одной стороны; размеры 50—80 мкм в длину и 35—60 мкм в ширину. Тело инфузории покрыто пелликулой и расположенными в виде спиральных рядов ресничками длиной 4—6 мкм, колебательные движения которых обеспечивают вращательно-поступательное движение возбудителя. На переднем конце В. coli расположено ротовое отверстие — перистом, окруженное ресничками длиной до 10—12 мкм, способствующими захвату пищевых комочков. На противоположном конце тела имеется цитопиг.
Под пелликулой определяется эктоплазма, в средней части и на заднем конце расположены две сократительные вакуоли. Эндоплазма инфузории мелкозернистая, содержит вакуоли, заключающие бактерии, крахмал, эритроциты и лейкоциты. После окрашивания удается дифференцировать ядерный аппарат, состоящий из бобовидной формы макронуклеуса и микронуклеуса.
Вегетативные формы В. coli размножаются путем двойного деления, однако в определенные периоды возможен половой процесс по типу конъюгации.
Вегетативные формы паразита чувствительны к неблагоприятным условиям внешней среды и быстро в ней погибают; в фекалиях могут сохраняться до 5—6 ч.
Цисты В. coli округлой формы, достигают 50—60 мкм в диаметре. Различают двухконтурную оболочку и ядерный аппарат в виде макро- и микронуклеуса, иногда — вакуоль.
Цистная форма может сохранять жизнеспособность во внешней среде в течение нескольких недель.
Эпидемиология. Балантидиаз — кишечный зооноз. Резервуаром возбудителей являются свиньи, почти всегда инвазированные В. coli. Выявлена зараженность крыс, собак, но их роль в эпидемиологии ба-лантидиаза не выяснена. В крайне редких случаях при особо неблагоприятных условиях инвазированный человек может становиться Дополнительным резервуаром возбудителя.
Механизм заражения — фекально-оральный, реализуемый водным путем, через воду, зараженную фекалиями свиней. Дополнительными факторами передачи возбудителя могут служить почва, овощи, синантропные мухи.
Балантидиаз регистрируется преимущественно среди сельских жителей, занимающихся свиноводством, при этом показатели зараженности колеблются от 1—3 до 28 %. Наибольшее число случаев ба-лантидиаза описано в странах Азии, Европы и Америки.
Патогенез и патологоанатомическая картина. Проглоченные цисты В. coli достигают восходящих отделов толстой кишки и, превращаясь в вегетативные формы, размножаются, преимущественно в слепой кишке. Паразитирование инфузорий в просвете кишки может сопровождаться слабо выраженными общетоксическими расстройствами.
Благодаря способности синтезировать гиалуронидазу, ба-лантидии приобретают возможность внедряться в слизистую оболочку толстой кишки, вследствие чего развивается гиперемия пораженных участков, на которых далее образуются эрозии и язвы. Отмечается усиление пролиферации эпителия кишечных крипт, его некроз с образованием эрозий, на месте которых в дальнейшем могут формироваться глубокие язвы.
Миграция В. coli в подслизистую основу обусловливает образование воспалительного отека, лимфоцитарной, гистиоци-тарной и сегментоядерной инфильтрации, иногда — микроабсцессов.
Язвенные дефекты расположены, как правило, в местах перегибов кишечной стенки преимущественно в слепой, сигмовидной и прямой кишке. Язвы различаются по размеру и срокам образования, площадь некоторых из них может достигать нескольких квадратных сантиметров. Язвы расположены вдоль складок слизистой оболочки, края их неровные, подрытые, дно покрыто желеобразными некротическими массами, часто черного цвета. Окружающие участки слизистой оболочки гиперемированы, отечны (рис. 22; см. цв. вклейку).
В патологический процесс часто вовлекается червеобразный отросток с развитием гнойного и некротического аппендицита.
Описаны поражения миокарда, печени, тонкой кишки.
Паразитирование В. coli, развитие воспалительной реакции и гнойно-некротических изменений в толстой кишке обусловливают образование токсичных субстанций, ответственных за развитие интоксикационного синдрома в клинической картине заболевания.
Клиническая картина. Балантидиаз может протекать в субклинической, острой, хронической непрерывной и хронической рецидивирующей формах. В очагах инвазии возможно носительство В. coli.
Инкубационный период составляет 1—3 нед, но бывает и более коротким. Субклиническая форма характеризуется отсутствием признаков интоксикации и дисфункции кишечника. Заболевание распознается при эндоскопическом исследовании, которое выявляет катарально-геморрагическое или язвенное поражение слизистой оболочки толстой кишки; возможны нарушения функциональных проб печени, эозино-филия.
Острая форма балантидиаза протекает обычно с выра-
Рис. 1. Лимфатический аппарат тонкой кишки при брюшном тифе, а — гипертазия мезентериальныч лимфатических узлов; б — отторжение nei ротическпх масс с образованием язв в тонкой кишке (по И. В. Давыдо; скому).
Вклейка Шувалова
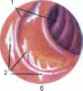
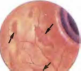
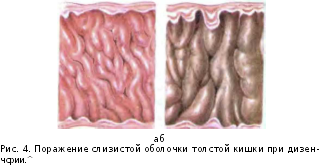
АИф.3БилибТну]. Н3 К°Же ЖИВ°Та У бОЛЬНОГ° бРюшным тифом (по
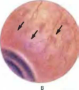
Рис. 5. Ректороманоскопия при дизентерии.
а — катарально-слизистый проктосигмоидит" выраженная гиперемия (1) слизистой оболочки и отложения на ней слизи (2); 6—эрозивный проктосиг-моитит эрозии (I) и отложения слизи (2) на вершине складок катарально измененной слизистой оболочки; в — катарально-геморрагический проктосигмоидит. участки кровоизлияний на слизистой оболочке обозначены стретка-ми, г — эрозивно-язвенныи проктосигмоидит- язва и эрозии на счизпстои оболочке обозначены стречками.
а-острый катаральным колит: складки слизистой оболочки утопшены гипе-ремировамы, имеются кровоизлияния; б - ДифтеритическиГХ'ГстТнки
пГенпям^Ги С-нИп'СТОИ Т УТ°"ШеНЫ П0КРЫ™ Фибровыми на-ложениями (по И В. Давыдовскому).
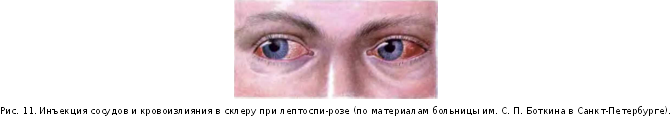
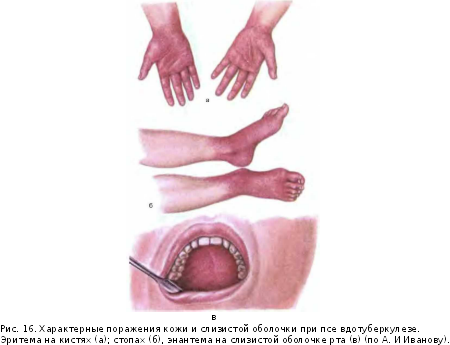
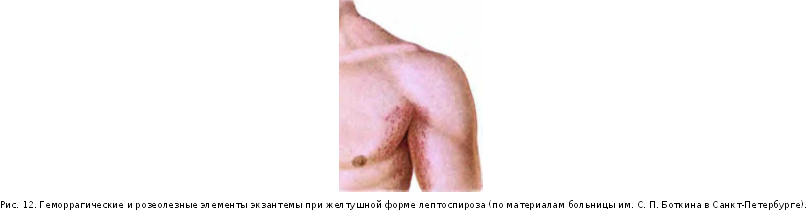
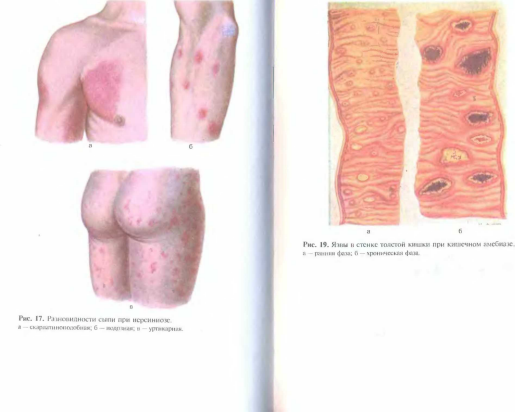
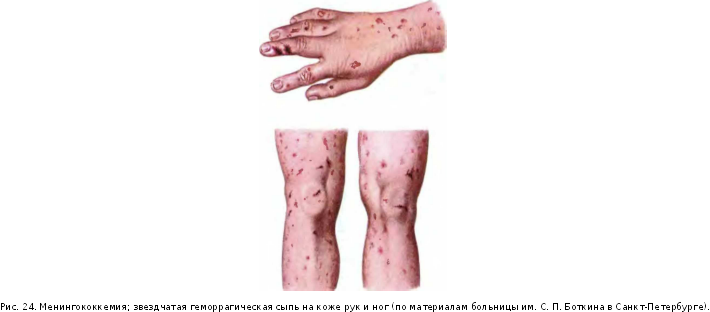
Рис. 21. Абсцесс печени при амебиазе.
А
Рис. 26. Дифтерия глотки, лока- Рис. 27. Дифтерия глотки, рас-лизованная форма. Гиперемия пространенная форма (по Н. И. дужек, пленчатый налет на мин- Нисевич и В. Ф. Учаикину). далинах (по Н. И. Нисевич и В. Ф. Учайкииу).
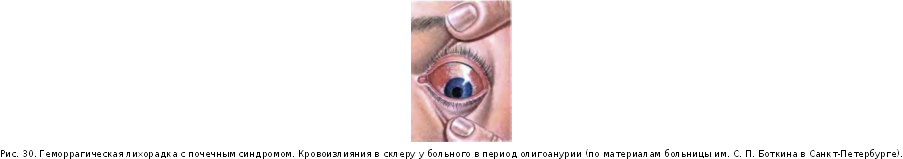
Рис. 28. Дифтерия глотки, токсическая форма. Отек шейной клетчатки (по Н. И. Нисевич и В. Ф. Учаикину).
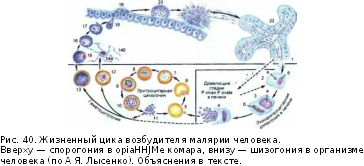
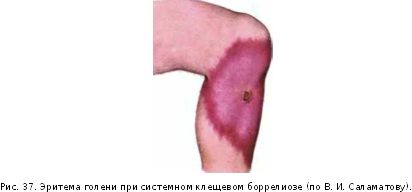

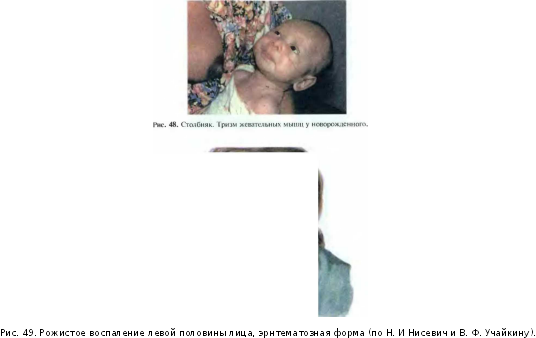
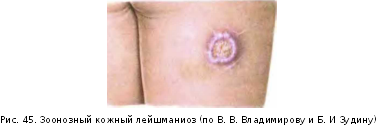
Рис. 44. Микроскопия стернапьного пунктата при висцеральном леишманиозе. Гиперплазия ретикулогистиоцитарных элементов, огромное количество лейшманий, расположенных вне- и внутрикле-точно (по А. И. Кассирскому).
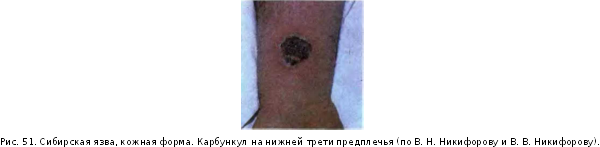
Рис. 50. Сибирская язва, генерализованная форма. Поражение внут-ригрулных лимфатических узлов (по В. II Никифорову и В. В. Никифорову).
женными явлениями общей интоксикации и симптомами колита, в зависимости от степени выраженности которых различают легкую, средней тяжести и тяжелую формы болезни.
Заболевание начинается, как правило, остро, с повышения температуры до высоких цифр. Лихорадочная реакция часто имеет неправильный характер. Возникают головная боль, тошнота, многократная рвота, прогрессирует общая слабость.
Постоянными признаками балантидиаза являются сильные боли в животе и диарея. Стул обильный, жидкий, часто с примесью крови и гноя, гнилостным запахом. Частота дефекаций может колебаться от 3—5 раз в сутки при легких до 15—20 при тяжелых формах заболевания. По мере прогрессирования балантидиаза снижается масса тела больных, заметно нарушается трудоспособность.
Продолжительность острой формы около 2 мес. При отсутствии своевременной терапии заболевание переходит в хроническую форму.
Хроническая рецидивирующая форма балантидиаза протекает 5—10 лет, иногда и более, с чередованием периодов обострения (до 1—2 или 3—4 нед) и периода ремиссии (до 3—6 мес). Признаки общей интоксикации менее выражены, чем при острой форме болезни, кишечные расстройства часто превалируют над общетоксическими.
Хроническая непрерывная форма балантидиаза характеризуется монотонным течением с умеренно выраженными токсическими и кишечными проявлениями на протяжении ряда лет. При отсутствии этиотропного лечения может приводить к кахексии.
В случае вовлечения в патологический процесс червеобразного отростка развивается клиническая картина острого аппендицита, сопровождающаяся повышением температуры, появлением местных признаков раздражения брюшины, симптомов Ровзинга, Ситковского, Щеткина— Блюмберга и др.
В ряде случаев наблюдается развитие характерных осложнений: кишечное кровотечение, перфорация язв толстой кишки с развитием разлитого гнойного перитонита. Кишечные осложнения могут обусловить летальный исход заболевания.
Прогноз. При своевременном распознавании и адекватной терапии обычно благоприятный. Летальность в эндемичных очагах около 1 %. При спорадической заболеваемости наблюдались высокие показатели летальности — до 16—29 %, в настоящее время эти показатели снизились.
Диагностика. Диагноз балантидиаза основывается на данных эпидемиологического и профессионального анамнеза, указывающих на пребывание в эндемичном районе или контакт со свиньями; клинических проявлений болезни с длительной неправильной лихорадкой, болями в животе и многократным жидким стулом с гнилостным запахом; результатах
