
- •Державний вищий навчальний заклад
- •Міністерства освіти і науки України фізична хімія
- •1.Термодинаміка розчинів електролітів
- •Лабораторна робота №1
- •Експериментальна частина
- •Розрахунки
- •Лабораторна робота № 2
- •Експериментальна частина
- •Розрахунки
- •1. Розрахувати δт крист. Розчину електроліту.
- •2. Розрахувати ізотонічний коефіцієнт Вант – Гоффа (і) та ступінь дисоціації розчину електроліту.
- •3. Розрахувати осмотичний коефіцієнт в розчині електроліту.
- •4.Розрахувати коефіцієнт активності електроліту.
- •Лабораторна робота №3
- •Експериментальна частина
- •Лабораторна робота №4
- •Експериментальна частина
- •Розрахунки
- •Лабораторна робота № 5
- •Експериментальна частина
- •Розрахунок кількості іонізованих форм
- •Спектрофотометричний метод визначення константи іонізації
- •Рівняння для визначення рКа
- •2. Якщо функціональна група, що визначається, основа, тоді
- •Вибір аналітичної довжини хвилі
- •Визначення приблизного значення рКа
- •Точне визначення величини рКа
- •Експериментальна частина
- •Розрахунки
- •2. Електрична провідність розчинів електролітів
- •Лабороторна робота №6
- •Контрольні запитання
- •Експериментальна частина
- •Визначення точної концентрації розчину слабкого електроліту методом кондуктометричного титрування;
- •2. Визначення електропровідності розчинів слабкого електроліту відомих концентрацій, розрахунок ступеню дисоціації слабкого електроліту
- •Лабораторна робота №7
- •Експериментальна частина
- •Лабораторна робота №8
- •Експерементальна частина
- •Розрахунки
- •3. Електрохімія Рівноважні електрохімічні процеси
- •3.1. Міжфазні стрибки потенціалу. Поняття електродного потенціалу.
- •3.2 Гальванічний елемент Даніеля-Якобі
- •3.3. Електрорушійна сила гальванічного елемента, рівняння Нернста
- •3.4. Класифікація електродів
- •3. Газові електроди
- •1. Хлорсрібний електрод сі- | АgСl |Аg
- •2. Каломельний електрод сі | Нg2с12 | Нg
- •Лабораторна робота №9
- •Експериментальна частина
- •Розрахунки
- •Розрахунки
- •Лабороторна робота № 10
- •Експериментальна частина
- •Розрахунки
- •Розрахунки
- •Лабороторна робота № 11
- •Експериментальна частина
- •Розрахунки
- •Лабораторна робота №12
- •Експериментальна частина
- •Підготовка до аналізу
- •Приготування екстрагую чого розчину
- •Приготування екстрагую чого розчину для визначення нітратів в капусті,редисці, редькі
- •Підготовка іономеру до роботи
- •Проведення аналізу сирого рослинного матеріалу
- •Приклади розв´язування задач
- •4.Хімічна кінетика
- •Приклади розв‘язку задач
- •Задачі для самостійного рішення
- •Лабораторна робота №13
- •Література
- •Ряд стандартних електродних потенціалів
- •Фізична хімія
Розрахунки
Визначить рКа для кожного з 10 розчинів згідно з рівнянням 1.6:
рКа = рН + lg d1 – d/ d- dм
Отримані результати занесіть у табл..2. Визначить середнє значення та відхилення від нього. Для цього кожне значення рКа перетворіть в антилогарифм і знайдіть середнє значення всіх антилогарифмів. Середнє значення антилогарифмів перетворіть у логарифм, який і буде правильною середньою величиною рКа.
Наприклад, візьміть 3 величини рКа: 2,10; 2,80; 2,50. Знайдемо їх антилогарифми:
1. 102,10 = 126
2. 102,80 = 631
3. 102,5 = 316
Середнє значення
126 + 631 + 316 / 3 = 357,67
Знаходимо
за цим середнім значенням рКа(середнє):
![]()
Таким чином, середнє значення рКа = 2,55. Далі розраховуємо відхилення від середнього значення. Для цього знаходимо найбільше відхилення значення рКа в досліджуємій серії розчинів від знайденої середньої величини рКа
Кінцевий результат: рКа середнє ± знайдене найбільше відхилення. Зробіть висновки до роботи окремим реченням.
2. Електрична провідність розчинів електролітів
Електропровідність розчину електроліту — це його здатність проводити електричний струм під дією електричної напруги. У розчинах електролітів електричний струм переноситься за рахунок переміщення іонів (провідники ІІ роду). Електропровідність — це величина обернена до опору:
![]() ;
(2,1)
;
(2,1)
![]() ;
;
де
L
- електропровідність, R,![]() - відповідно опір розчину, питомий опір
розчину,S
- проща поперечного перерізу, l-
довжина провідника.
- відповідно опір розчину, питомий опір
розчину,S
- проща поперечного перерізу, l-
довжина провідника.
Величина, обернена до питомого опору, називається питомою електропровідністю:
![]() ;
(2.2)
;
(2.2)
![]()
де — питома електропровідність.
Питома
електропровідність — це електропровідність
1 м3
розчину, який знаходиться між електродами
площею
![]() ,
розташованими на відстані
,
розташованими на відстані
![]() один від одного.
один від одного.
Питома електропровідність залежить від природи електроліту, температури, концентрації іонів у розчині:
![]() ,
(2.3)
,
(2.3)
де
с—
концентрація електроліту моль/л,
![]() —
ступінь дисоціації електроліту, F—
число Фарадея,
—
ступінь дисоціації електроліту, F—
число Фарадея,
![]() абсолютні
швидкості катіонів та аніонів.
абсолютні
швидкості катіонів та аніонів.
З підвищенням температури питома електропровідність зменшується. Причина — зменшення в’язкості середовища (внаслідок чого зростає швидкість руху іонів) та підвищення ступеню іонізації.
При
розведенні концентрованих розчинів
![]() спочатку зростає за рахунок послаблення
міжіонних електростатичних сил (у
випадку сильних електролітів) і збільшення
ступеня іонізації (у випадку слабких
електролітів). Подальше розведення
призводить до зменшення загальної
концентрації іонів у розчині, внаслідок
чого електропровідність зменшується.
спочатку зростає за рахунок послаблення
міжіонних електростатичних сил (у
випадку сильних електролітів) і збільшення
ступеня іонізації (у випадку слабких
електролітів). Подальше розведення
призводить до зменшення загальної
концентрації іонів у розчині, внаслідок
чого електропровідність зменшується.
Окрім
питомої електропровідності, застосовується
ще один параметр для характеристики
електричних властивостей розчинів —
еквівалентна
електропровідність![]() .
.
Еквівалентна
електропровідність
—
це електропровідність розчину, який
містить 1 кг – екв. електроліту,
розташованого між двома електродами
площею
![]() ,
відстань між якими
,
відстань між якими
![]() .
.
Очевидно,
що між параметрами
![]() існує зв'язок:
існує зв'язок:
![]() (2.4)
(2.4)
Якщо
між електродами, що мають площу
і розташовані на відстані
,
розмістити розчин одно- нормального
електроліту (![]() ),
то виконується співвідношення:
),
то виконується співвідношення:
![]() (2.5)
(2.5)
Коли
концентрація виражається в одиницях
моль/л, використовують поняття молярної
електричної провідності
![]() .
Взаємозвязок між молярною та еквівалентною
електропровідністю виражається
рівнянням:
.
Взаємозвязок між молярною та еквівалентною
електропровідністю виражається
рівнянням:
![]() ;
;
![]() , (2.5а)
, (2.5а)
де
![]() та
та
![]() –величини зарядів катіонів та аніонів,що
утворились при дисоціації молекули;
–величини зарядів катіонів та аніонів,що
утворились при дисоціації молекули;
![]() та
та
![]() - число катіонів і аніонів,що утворилось.
- число катіонів і аніонів,що утворилось.
Еквівалентну електропровідність можна розглядати і як функцію розведення V.
Розведення — це об’єм розчину, який містить 1 екв.електроліту:
![]() (2.6)
(2.6)
При
додаванні великої кількості розчинника
еквівалентна електропровідність за
рахунок повної дисоціації зростає і
досягає максимального значення
![]() .
.
Цю величину називають граничною еквівалентною електропровідністю при нескінченному розведенні
![]() (2.7)
(2.7)
Це математичний запис закону незалежного руху іонів Кольрауша: при нескінченному розведенні розчину електроліту іони рухаються незалежно один від одного, а електрична провідність його складається з електропровідності, обумовленої кожним з видів іонів.
Для
розчинів сильних електроліті вводять
поняття коефіцієнта
електропровідності
![]() :
:
![]() (2.8)
(2.8)
Параметр за своїм фізичним змістом близький до поняття ступеня дисоціації слабких електролітів:
![]() (2.9)
(2.9)
Визначивши
дослідним шляхом питому електропровідність
можна розраховувати згідно рівняння
(2.5) еквівалентну електропровідність
![]() ,
а також ступінь дисоціації (2.9) та
константу дисоціації слабкого електроліту:
,
а також ступінь дисоціації (2.9) та
константу дисоціації слабкого електроліту:
![]() (2.10)
(2.10)
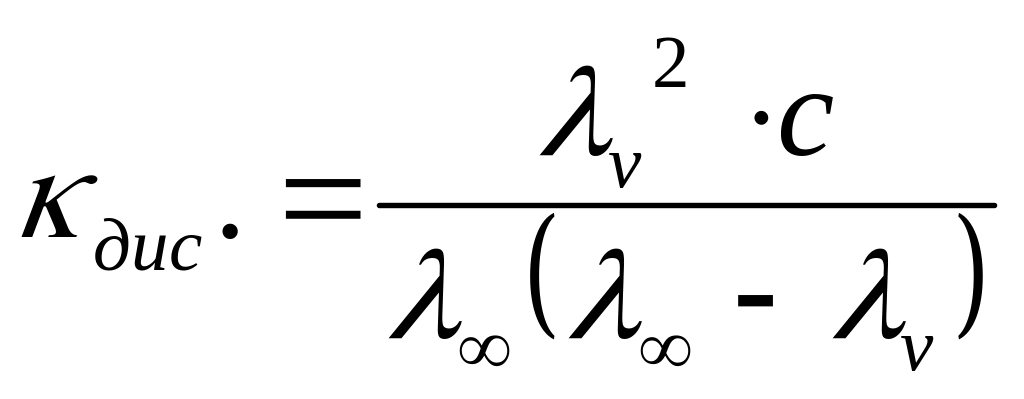 (2.11)
(2.11)
