
- •Державний вищий навчальний заклад
- •Міністерства освіти і науки України фізична хімія
- •1.Термодинаміка розчинів електролітів
- •Лабораторна робота №1
- •Експериментальна частина
- •Розрахунки
- •Лабораторна робота № 2
- •Експериментальна частина
- •Розрахунки
- •1. Розрахувати δт крист. Розчину електроліту.
- •2. Розрахувати ізотонічний коефіцієнт Вант – Гоффа (і) та ступінь дисоціації розчину електроліту.
- •3. Розрахувати осмотичний коефіцієнт в розчині електроліту.
- •4.Розрахувати коефіцієнт активності електроліту.
- •Лабораторна робота №3
- •Експериментальна частина
- •Лабораторна робота №4
- •Експериментальна частина
- •Розрахунки
- •Лабораторна робота № 5
- •Експериментальна частина
- •Розрахунок кількості іонізованих форм
- •Спектрофотометричний метод визначення константи іонізації
- •Рівняння для визначення рКа
- •2. Якщо функціональна група, що визначається, основа, тоді
- •Вибір аналітичної довжини хвилі
- •Визначення приблизного значення рКа
- •Точне визначення величини рКа
- •Експериментальна частина
- •Розрахунки
- •2. Електрична провідність розчинів електролітів
- •Лабороторна робота №6
- •Контрольні запитання
- •Експериментальна частина
- •Визначення точної концентрації розчину слабкого електроліту методом кондуктометричного титрування;
- •2. Визначення електропровідності розчинів слабкого електроліту відомих концентрацій, розрахунок ступеню дисоціації слабкого електроліту
- •Лабораторна робота №7
- •Експериментальна частина
- •Лабораторна робота №8
- •Експерементальна частина
- •Розрахунки
- •3. Електрохімія Рівноважні електрохімічні процеси
- •3.1. Міжфазні стрибки потенціалу. Поняття електродного потенціалу.
- •3.2 Гальванічний елемент Даніеля-Якобі
- •3.3. Електрорушійна сила гальванічного елемента, рівняння Нернста
- •3.4. Класифікація електродів
- •3. Газові електроди
- •1. Хлорсрібний електрод сі- | АgСl |Аg
- •2. Каломельний електрод сі | Нg2с12 | Нg
- •Лабораторна робота №9
- •Експериментальна частина
- •Розрахунки
- •Розрахунки
- •Лабороторна робота № 10
- •Експериментальна частина
- •Розрахунки
- •Розрахунки
- •Лабороторна робота № 11
- •Експериментальна частина
- •Розрахунки
- •Лабораторна робота №12
- •Експериментальна частина
- •Підготовка до аналізу
- •Приготування екстрагую чого розчину
- •Приготування екстрагую чого розчину для визначення нітратів в капусті,редисці, редькі
- •Підготовка іономеру до роботи
- •Проведення аналізу сирого рослинного матеріалу
- •Приклади розв´язування задач
- •4.Хімічна кінетика
- •Приклади розв‘язку задач
- •Задачі для самостійного рішення
- •Лабораторна робота №13
- •Література
- •Ряд стандартних електродних потенціалів
- •Фізична хімія
2. Каломельний електрод сі | Нg2с12 | Нg
Робочий розчин цього електрода - хлорид калію, електрод - ртуть, покрита каломеллю Нg2С12. За аналогією із хлорсрібним електродом можна записати окремі електродні реакції:
Нg2+ + 2 = 2Нg°, (3.25)
Нg![]() Сl2
= Нg2+
+ 2Сl-,
(3.26)
Сl2
= Нg2+
+ 2Сl-,
(3.26)
і сумарну реакцію
Нg2С12 +2 = 2Нg + 2Сl-. (3.27)
Відповідно, електродні потенціали можна подати у вигляді:
для реакції (3.25):
![]() ,
,
для реакції (3.26)
![]()
Нарешті, в узагальненому вигляді маємо:
![]() .
(3.28)
.
(3.28)
де
![]() - добуток розчинності каломелі Нg2С12.
- добуток розчинності каломелі Нg2С12.
Окислювально-відновні (Red-Ох) електроди. Електроди цього типу за встановленою класифікацією належать до електродів третього виду, відмінною властивістю яких є те, що всі компоненти, які беруть участь у електрохімічній реакції, знаходяться в розчині. Інертний метал, який використовується у цих системах (як правило, платина), є лише резервуаром для електронів; безпосередньо в реакції він участі не бере.
Типовими представниками електродів третього виду є феро-фери електрод та хінгідронні електроди. Розглянемо їх особливості.
Феро-фери електроди Fе3+ | Fе2+ | Рt
Конструктивно цей електрод виконаний у вигляді платинованої пластинки, зануреної у розчин, що містить іони заліза різної валентності (наприклад, FеС13 та FеС12). Платинована пластинка здобуває певний потенціал внаслідок того, що іони заліза різної валентності перетворюються один в одного; при цьому вони або віддають електрони платинованій пластинці, або беруть їх від неї.
Електродна реакція записується у вигляді:
Fе3++1
![]() Fе2+,
Fе2+,
а електродний потенціал розраховується за формулою:
![]() (3.29)
(3.29)
Стандартний
потенціал
![]() відповідає
умові
відповідає
умові
![]()
2.
Хінгідронні
електроди С6Н402,
С![]() Н4(ОН)2,
Н+
| Рt
Н4(ОН)2,
Н+
| Рt
Це
найбільш складні електроди третього
роду, вони використовуються на практиці
для визначення кислотності розчинів.
Щоб приготувати такий електрод, необхідно
пластинку інертного металу занурити у
розчин хінгідрону, який є еквімолекулярною
сполукою хінону
![]() та
гідрохінону
та
гідрохінону
![]() .
.
Сумарну електродну реакцій можна записати у вигляді:
С6Н402 + 2 + 2Н+ = С6Н4(ОН)2. (3.30)
Маючи на увазі, що всі речовини, які беруть участь у хімічній реакції - тверді речовини, електродний потенціал можна визначити за допомогою рівняння
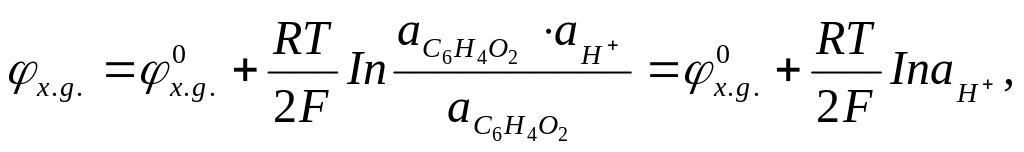 (3.31)
(3.31)
або у скороченому вигляді, враховуючи, що гідрохінон у розчині є слабкою кислотою:
![]() (3.32)
(3.32)
З останнього виразу випливає, що потенціал хінгідронного електрода визначається тільки активністю іонів водню.
Іон-селективні електроди. Типовим представником цього типу електродів є скляний електрод, конструктивно виконаний у вигляді скляної кульки, заповненої стандартним розчином, у який занурений хлорсрібний електрод. Схематично цей електрод має вигляд:
КС1, АgСl | Аg.
На поверхні скла проходить обернена реакція:
![]() (3.33)
(3.33)
Потенціал скляного електрода визначається так:
![]() (3.34)
(3.34)
Лабораторна робота №9
Тема: визначення значення електрорушійної сили мідно-цинкового гальванічного елементу та визначення значення електродних потенціалів.
Мета: ознайомитись з методикою складання найпростішихгальванічних елементів, вимірювання їх ЕРС,а також електродних потенціалів відносно електродів порівняння; розрахувати електродні потенціали і ЕРС елемента Якобі-Даніеля в залежності від різної активності електроліту.
Прилади і обладнання: прилад для вимірювання ЕРС, пластина із цинку, пластина із міді; хлорсрібний електрод; солевий міст; 5 хімічних стаканів на 50 мл; стакан хімічний на 500 мл; термометр; наждачний папір; гумові капіляри.
Реактиви: розчини: 1M та 0,01М CuSO4 ;. 1М та 0,01M, ZnSO4 ; H2O; насичений розчин KCl (255г/л).
Контрольні запитання:
Наведіть та поясніть схему будови ПЕШ.
Охарактеризуйте поняття електродного потенціалу, стандартного електродного потенціалу. Наведіть формулу Нернста для потенціалу електрода.
Зобразіть будову гальванічного елемента Якобі- Даніеля. Запишіть рівняння електродних реакцій, що проходять при його роботі. За якими ознаками класифікують гальванічні елементи ?
Що називають електрорушійною силою (ЕРС) гальванічного елемента ? Дайте термодинамічне виведення рівняння Нернста.
Як представити ЕРС гальванічного елемента через стрибки потенціалів на межі поділу фаз ?
Охарактеризуйте електроди першого та другого роду (виду). Запишіть електродні реакції, що характерні для даних електродів, та рівняння Нернста для визначення їх потенціалів.
Завдання до роботи:
Зібрати мідно-цинковий гальванічний елемент Якобі-Даніеля та виміряти його ЕРС при різній активності розчинів електролітів.
Порівняти експериментальне значення ЕРС гальванічного елемента з розраховано теоретично за рівнянням Нернста.
Виміряти значення електродних потенціалів мідного і цинкового електродів відносно хлорсрібного електроду.
