
- •1. Строение атома. Строение электронной оболочки атома. Связь строения и химических свойств атома.
- •2. Химическая связь. Строение молекулы.
- •3.Периодический закон д.И. Менделеева. Физический смысл констант в таблице д.И. Менделеева.
- •4. Основы термодинамики. Понятие внутренней энергии, энтальпии. 1 закон термодинамики. Закон Гесса. Следствие из закона Гесса.
- •5. Функции состояния системы: энтропия, энергия Гиббса. Определение направления протекания реакции.
- •6. Кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс в гомогенной и гетерогенной среде.
- •7. Зависимость скорости реакции от температуры. Катализ. Виды катализа.
- •8. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •9.Растворы. Процесс растворения. Концентрация раствора. Классификация растворов.
- •10. Свойства растворов неэлектролитов. 1 и 2 закон Рауля. Осмотическое давление.
- •12. Ионное произведение воды, pH растворов.
- •13. Ионообменные процессы. Равновесие в водных растворах электролитов.
- •14. Гидролиз солей. Классификация солей по реализации процесса гидролиза. Гидролиз солей по катиону.
- •15. Гидролиз солей по аниону. Степень гидролиза. Влияние условий на степень гидролиза.
- •16. Поверхностные явления. Дисперсные системы. Классификация дисперсных систем.
- •17. Поверхностные явления. Сорбция.
- •18. Дисперсные системы. Коллоидные системы. Классификация.
- •19.Методы получения коллоидных систем. Пептизация. Устойчивость коллоидных систем. Коагуляция.
- •20. Строение мицеллы, образованной в результате реакции обмена
- •21. Овр. Степень окисления элемента. Составление уравнений овр.
- •22. Важнейшие окислители и восстановители. Роль соединения в овр, исходя из степени окисления элемента.
- •23. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Зависимость химической активности металла от значения потенциала. Взаимодействие металлов с солями и кислотами.
- •24. Уравнение Нернста. Гальванические элементы. Эдс гальванического элемента.
- •25. Коррозия металлов. Основные виды и типы коррозии металлов, их характеристика.
- •26. Методы защиты металлов от коррозии.
- •27. Электролиз расплава. Электролиз раствора соли с нерастворимым анодом. Катодные процессы. Порядок восстановления ионов из водных растворов солей.
- •28. Электролиз с активным анодом. Анодные процессы.
- •29. Качественный и количественный анализ вещества. Качественне реакции на катионы и анионы.
- •30. Физико-химические методы анализа (ма): электрохимические, спектральные (оптические), хроматографические, радиометрические, масс-спектрические.
- •31. Общая характеристика металлов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений. S-элементы, их общие характеристики.
- •32. Кальций и магний. Природные соединения. Соединения кальция и магния применяемые в строительстве.
- •33. Природные воды, их состав и классификация.
- •34. Жесткость воды. Классификация жесткости. Способы устранения.
- •36. Общая характеристика неметаллов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений на примере углерода и кремния.
- •37. Полимеры. Классификация полимеров. Особенности свойств полимеров в отличие от низкомолекулярных соединений.
- •38. Методы получения полимеров (реакция полимеризации и поликонденсации)
- •39. Понятие о физических состояниях полимеров. Переход полимера из одного физического состояния в другое.
- •40. Химические реакции в полимерах. Реакции отверждения. Деструкция полимеров.
20. Строение мицеллы, образованной в результате реакции обмена
Мицелла – электронейтральная частица. Дисп среда – жидкая, дисп фаза – твёрдая. Строение рассмотрим на след-м примере: AgNO3+KCl=AgCl↓+KNO3 (KCl в избытке) Ag++NO3-+K++Cl-=AgCl↓+K++NO3- {[mAgCl]*nCl-*(n-x)K+}x-*xK+ [ядро]; nCl- – потенциал, определяющий ионы; (n-x)K+}x-*xK+ – противоионы; nCl-*(n-x)K+ – адсорбционный слой; xK+ – диффуз слой; {гранула}
21. Овр. Степень окисления элемента. Составление уравнений овр.
ОВР – хим процесс, в ходе к-ого у элементов изменяется С.О. С.О. – условный заряд атома элемента в соединении, вычисляемый исходя из предположения, что в-во построено из ионов. ОВР состоит из 2х подпроцессов, к-ые самостоятельно протекать не могут: 1-о-е – отдача е; С.О. повыш-ся, а частица – в-ль: A0-e→A+ 2-в-е – приём е; С.О. пониж-ся, а частица – о-ль: A0+e→A-
Метод электронно-ионного баланса. Правила: 1. При избытке кислорода в исх в-х в кислой: [O2−]+2H+=H2O; в щелочной и нейтральной: [O2−]+H2О=2ОН− 2. При недостатке кислорода в исх в-х в кислой и нейтральной: H2O=[O2−]+2H+; в щелочной: 2ОН−=[O2−]+H2О -е – ок-е, в-ль; +е – в-е, ок-ль.
22. Важнейшие окислители и восстановители. Роль соединения в овр, исходя из степени окисления элемента.
Важнейшие окислители и восстановители. Окислители – атомы, находящиеся в max С.О. Восстановители – неМе в min С.О. Роль соединения в ОВР, исходя из степени окисления элемента. S-2 - H2S, K2S увел. С.О. (в-ль) S+4 - SO2, H2SO3, Na2SO3 увел. С.О. (в-ль), но может и умен. (о-ль), S+6 - SO3, H2SO4, Na2SO4 умен. С.О. (о-ль) S0 - умен. С.О. (о-ль) и увел. (в-ль). Элемент в низшей С.О. – только в-ль, в высшей – только о-ль, в промежуточной – может и то и то.
23. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Зависимость химической активности металла от значения потенциала. Взаимодействие металлов с солями и кислотами.
Е0 – Стандартный электродный потенциал. Значение измеряют в растворах с концентрацией 1 моль/л, давление 1атм=100 Па, t=25оС=298К, его замеряют относительно водородного электрода. Для водорода Е0=0. По значению Е0 металлы располагаются в электрохимическом ряду напряжений металлов. Исходя из положения в ряду можно судить о хим активности атома Ме и иона Ме. При увеличении потенциала: -ум-е акт-ти Ме0; -ув-е акт-ти иона Ме+n; -ум-е хим акт-ти. Взаимодействие металлов с солями 1. Ме с меньшим значением потенциала вытесняют из солей Ме с большим значением. 2. Соль+Ме=новая соль+новый Ме, если: -Ме нах-ся в ряду напряжений до Ме, образующего соль; -образуется растворимая соль. Взаимодействие металлов с кислотами 1. К-та+Ме=соль+H, если: -Ме нах-ся в ряду напряжений до H; -образуется расворимая соль; -к-та растворима. 2. Щелочные Ме для р-ций с р-ми к-т не берут, т.к. они взаимодействуют в первую очередь с водой.
24. Уравнение Нернста. Гальванические элементы. Эдс гальванического элемента.
Уравнение
Нернста:
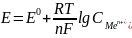 ,
где:
E
– электродный
потенциал (Вт), E0
– стандартный электродный потенциал
(Вт);
R
– универсальная
газовая постоянная, равная 8.31 Дж/(моль·K);
T
– абсолютная
температура;
F
– постоянная
Фарадея (
,
где:
E
– электродный
потенциал (Вт), E0
– стандартный электродный потенциал
(Вт);
R
– универсальная
газовая постоянная, равная 8.31 Дж/(моль·K);
T
– абсолютная
температура;
F
– постоянная
Фарадея (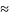 96500
Кл/моль);
n
– число моль
электронов, участвующих в процессе;
96500
Кл/моль);
n
– число моль
электронов, участвующих в процессе;
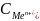 – концентрация
металла, входящего в электрохимич
ур-ие.
Путём преобразований получаем
это ур-ие в след-ем виде:
– концентрация
металла, входящего в электрохимич
ур-ие.
Путём преобразований получаем
это ур-ие в след-ем виде:
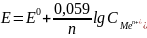 Гальванический
элемент –
устр-во, в к-ом преобразуется ок-в-ая
энергия в электричество. В г эл-те процесс
ок-ия и в-ия протекает в разных местах,
соединённых проводником, в к-ом возникает
постоянный эл ток.
На аноде – окисление
(-), на катоде – восстановление
(+)
ЭДС=Ек(о-я)–Еа(в-я)
>0 (Ек
и Еа
рассчитываются по ур-ию Нернста).
Гальванический
элемент –
устр-во, в к-ом преобразуется ок-в-ая
энергия в электричество. В г эл-те процесс
ок-ия и в-ия протекает в разных местах,
соединённых проводником, в к-ом возникает
постоянный эл ток.
На аноде – окисление
(-), на катоде – восстановление
(+)
ЭДС=Ек(о-я)–Еа(в-я)
>0 (Ек
и Еа
рассчитываются по ур-ию Нернста).
